西格列汀对AGEs作用下系膜细胞自噬的影响*
2017-09-03江颖娟蒋作锋吴小兰吴文法余慧文
江颖娟, 蒋作锋, 吴小兰, 黄 珮, 吴文法, 余慧文
(暨南大学医学院附属广州红十字会医院全科医学科, 广东 广州 510220)
西格列汀对AGEs作用下系膜细胞自噬的影响*
江颖娟, 蒋作锋, 吴小兰, 黄 珮, 吴文法, 余慧文△
(暨南大学医学院附属广州红十字会医院全科医学科, 广东 广州 510220)
目的: 探讨西格列汀对晚期糖基化终末产物(advanced glycation end products,AGEs)作用下系膜细胞细胞外基质和自噬相关蛋白表达的影响。方法: 培养大鼠肾小球系膜细胞,共分5组,分别为正常对照(control)组、AGE组和不同浓度(5 、10和20 μmol/L)西格列汀组。培养48 h后采用MTT法测定细胞活力,采用ELISA法检测细胞培养上清胶原蛋白Ⅳ(collagen IV, Col IV)含量的变化。采用Western blot检测自噬相关蛋白beclin-1、腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)、 p-AMPK、p70S6K和p-p70S6K的蛋白水平。结果: 与control组比较,AGEs可明显引起系膜细胞活力和Col IV表达增加,不同浓度的西格列汀均可明显抑制AGEs诱导的系膜细胞活力和Col IV表达的增加;与control组比较,AGEs可引起系膜细胞自噬相关蛋白beclin-1表达和AMPK磷酸化水平下降,p70S6K磷酸化水平增加;不同浓度的西格列汀均可促进系膜细胞自噬相关蛋白beclin-1表达及AMPK磷酸化,抑制p70S6K磷酸化,并呈一定的浓度依赖性。结论: 西格列汀可能通过引起系膜细胞的自噬发挥肾脏保护作用。
西格列汀; 自噬; 系膜细胞; 糖尿病肾病; Beclin-1; 腺苷酸活化蛋白激酶
糖尿病肾病是糖尿病的主要并发症之一,其发病率逐年上升,是终末肾病的主要病因,已经严重威胁人类健康,但目前尚无有效的治疗方法,因此迫切需要对糖尿病肾病发病机制进行深入的研究,寻求新的治疗糖尿病肾病的药物。有研究表明,自噬在糖尿病肾病的发病机制中发挥着重要的作用[1],因此自噬有望成为糖尿病肾病治疗新的药理作用靶点。
西格列汀(sitagliptin)是一种二肽基肽酶4(dipeptidyl peptidase 4,DPP-4)抑制剂,能够迅速灭活肠促胰岛素胰高血糖素样肽1和糖依赖性胰岛素释放肽等多种激素,增强人体自身的控制血糖能力,是目前临床治疗2型糖尿病的常用药物之一[2]。但研究发现西格列汀除了控制血糖等生理作用外,还可减少糖尿病大鼠肾脏的氧化应激及TNF-α、TGF-β的分泌,抑制结缔组织生长因子的表达,减少尿蛋白的产生[3-4]。以上研究表明,西格列汀可能还对肾脏具有一定的保护作用,但具体机制尚不清楚。近期有研究表明DPP-4抑制剂可通过诱导细胞发生自噬而保护心肌的功能及减轻动脉粥样硬化的程度[5-6],但西格列汀是否通过自噬发挥肾脏保护作用,目前少见报道。因此,本研究以系膜细胞为模型,初步探讨了西格列汀对晚期糖基化终末产物(advanced glycation end products,AGEs)作用下大鼠系膜细胞细胞自噬相关指标的影响,为西格列汀临床治疗糖尿病肾病提供理论基础及依据。
材 料 和 方 法
1 试剂和仪器
西格列汀、DMSO、MTT和大鼠TNF-α购自Sigma-Aldrich;胎牛血清购自PPA;DMEM低糖培养基和青、链霉素溶液(100×)购自杭州吉诺生物医药技术有限公司;胰蛋白酶购自广州威佳科技有限公司;PBS粉剂购自武汉博士德生物工程有限公司;MTT试剂盒购自碧云天生物技术公司;IV型胶原(collagen Ⅳ,Col Ⅳ)检测试剂盒购自南京建成生物工程研究所;抗beclin-1、p70S6K和p-p70S6K抗体购自Abcam;小鼠抗大鼠腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)、p-AMPK、β-actin 单克隆抗体和羊抗小鼠 IgG购自凯基公司;ECL 显色剂购自Pierce;细胞培养瓶、离心管和细胞培养板均购自Corning。3K15低温离心机购自Sigma;TDL-50B低速台式离心机购自上海安亭科学仪器厂。
2 方法
2.1 细胞培养 HBZY-1细胞购自上海艾研科技有限公司。将HBZY-1细胞接种于含10%胎牛血清、1×105U/L 青霉素和100 mg/L 链霉素的DMEM低糖培养基中,于37 ℃、5% CO2培养箱中培养。
2.2 实验分组 实验分为以下5组:对照(control)组:普通DMEM(含糖5.6 mmol/L)完全培养基;AGEs(5%的牛血清白蛋白和0.5%葡萄糖一起溶解于0.2 mol/L磷酸盐缓冲液中,过滤除菌后置于37 ℃的培养箱中8周,最后用透析方法析出AGEs,除菌后备用)处理组:采用0.25 g/L AGEs处理细胞,简称AGE组;药物处理组:在加AGEs处理的系膜细胞中,分别用不同浓度(5 μmol/L、10 μmol/L和20 μmol/L)的西格列汀处理(简称AGE+S5组、AGE+S10组和AGE+S20组)。
2.3 MTT法检测细胞活力 收集对数期细胞,置于96孔板,每孔5 000个细胞,37 ℃、5% CO2温箱培养使细胞贴壁,培养6~24 h。采用无血清培养基同步化24 h,然后按照细胞分组加入不同浓度的药物,继续培养48 h。吸去上清,加入90 μL新鲜培养液,再加入10 μL MTT溶液,继续培养4 h。然后吸掉上清,每孔加入110 μL二甲基亚砜,振荡10 min。在酶联免疫检测仪490 nm处测量各孔的吸光值。每组设定6个复孔。
2.4 ELISA法测定细胞培养上清Col IV的含量 从冰箱取出试剂盒,室温复温平衡30 min。配置标准品加标准品和待测样本,37 ℃恒温箱温育120 min。弃去液体,洗涤液洗板4次。加入工作液100 μL,37 ℃恒温箱温育60 min。洗板5次。依序每孔加入底物溶液90 μL,37 ℃避光显色15 min。每孔加终止液50 μL,终止反应。用450 nm波长测量各孔的吸光值。
2.5 Western blot 检测 beclin-1、AMPK、p-AMPK、p70S6K和p-p70S6K的蛋白水平 细胞加 200 μL预冷的 RIPA 裂解液(含50 mmol/L Tris, pH 7.5, 150 mmol/L NaCl, 1% NP-40, 0.1% SDS, 10 mmol/L EDTA, 1 mmol/L PMSF, 2 mg/L aprotinin, 2 mg/L leupeptin),4 ℃ 12 000 r/min 离心 25 min, 吸取上层液体经BCA 蛋白定量试剂盒测蛋白浓度。调整蛋白浓度后,取 150 μg 细胞总蛋白进行10%SDS-PAGE 分离,蛋白转印至硝酸纤维素膜,5%脱脂牛奶封闭 4 h, 加I 抗 4 ℃过夜, 加II 抗室温孵育 1 h,TBST 清洗后用Odyssey 凝胶成像系统扫描成像,所得结果以 β-actin 为内参照。各组实验至少重复3次。
3 统计学处理
统计分析采用SPSS 16.0软件。计量资料用均数±标准差(mean±SD)表示。各组间比较采用单因素方差分析(one-way ANOVA)和SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 西格列汀 对AGEs作用下大鼠系膜细胞活力的影响
培养48 h,AGE组系膜细胞活力明显高于control组(P<0.01)。不同浓度(5 μmol/L、10 μmol/L和20 μmol/L)的西格列汀均可明显抑制AGEs诱导的系膜细胞的活力(P<0.01),并呈一定的浓度依赖性,见图1。
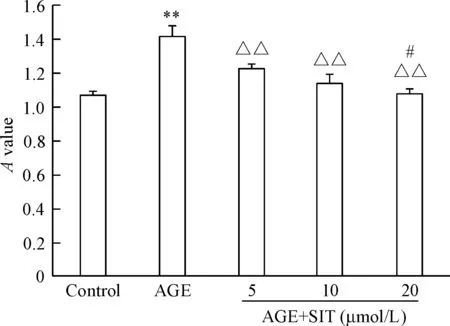
Figure 1.The changes of the viability of the mesangial cells with different treatments. Mean±SD.n=3.**P<0.01vscontrol;△△P<0.01vsAGE;#P<0.05vsAGE+SIT (5 μmol/L).
图1 各组系膜细胞活力的比较
2 西格列汀对AGEs作用下系膜细胞培养上清液Col IV含量的影响
与control组比较,AGE组系膜细胞上清液中Col IV的含量明显增加(P<0.01),不同浓度(5 μmol/L、10 μmol/L和20 μmol/L)的西格列汀可明显降低AGEs诱导下系膜细胞上清液中Col IV的含量,差异具有统计学意义(P<0.05),见图2。
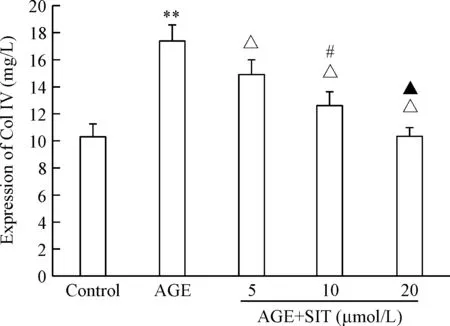
Figure 2.The effects of sitagliptin (SIT) on the content of Col IV in the cell culture supernatant induced by AGEs. Mean±SD.n=3.**P<0.01vscontrol;△P<0.05vsAGE;#P<0.05vsAGE+SIT (5 μmol/L);▲P<0.05vsAGE+SIT (10 μmol/L).
图2 西格列汀对AGEs条件下系膜细胞分泌Col IV的影响
3 西格列汀对AGEs作用下大鼠系膜细胞自噬相关蛋白beclin-1表达的影响
与对照组相比,AGEs可抑制系膜细胞beclin-1的表达(P<0.01);与AGE组相比,不同浓度(5 μmol/L、10 μnmol/L和20 μmol/L)的西格列汀均可明显促进AGEs条件下系膜细胞beclin-1的表达(P<0.01),且随着西格列汀浓度的增加,其促进系膜细胞beclin-1的表达作用增强,呈一定的浓度依赖性,见图3。
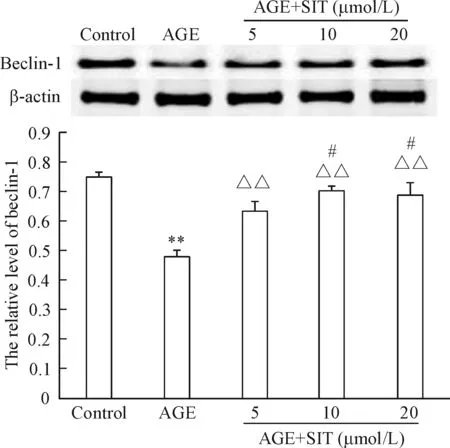
Figure 3.The effects of sitagliptin (SIT) on the protein expression of beclin-1 in the mesangial cells induced by AGEs. Mean±SD.n=3.**P<0.01vscontrol;△△P<0.01vsAGE;#P<0.05vsAGE+SIT (5 μmol/L).
图3 西格列汀对AGEs条件下大鼠系膜细胞beclin-1表达的影响
4 西格列汀对AGEs作用下大鼠系膜细胞TORC1活性的影响
p70S6K 是已知的哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)的底物蛋白,其磷酸化水平反映mTORC1的活性。培养48 h,与对照组相比,AGEs可明显促进系膜细胞p70S6K的磷酸化(P<0.01),不同浓度(5 μmol/L、10 μmol/L和20 μmol/L)的西格列汀可明显抑制AGEs作用下系膜细胞p70S6K的磷酸化(P<0.01),且随着西格列汀浓度的增加,其抑制p70S6K磷酸化的作用更加明显,具有一定的浓度依赖性,见图4。
5 西格列汀对AGEs作用下大鼠系膜细胞AMPK磷酸化的影响
与对照组相比,AGEs可明显抑制系膜细胞AMPK的磷酸化(P<0.01);与AGE组相比,不同浓度(5 μmol/L、10 μnmol/L和20 μmol/L)的西格列汀可明显增加AGEs作用下系膜细胞AMPK的磷酸化(P<0.01),且随着西格列汀浓度的增加,其促进系膜细胞AMPK磷酸化的作用增加,呈一定的浓度依赖性,见图5。

Figure 4.The effects of sitagliptin (SIT) on the expression of p-p70S6K in mesangial cells induced by AGEs. Mean±SD.n=3.**P<0.01vscontrol;△△P<0.01vsAGE;#P<0.05vsAGE+SIT (5 μmol/L).
图4 西格列汀对AGEs条件下大鼠系膜细胞p70S6K磷酸化的影响
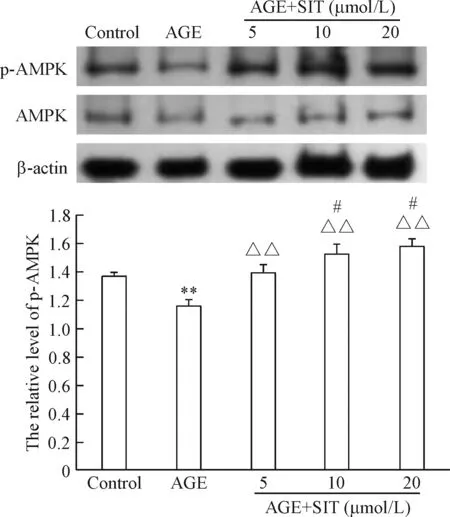
Figure 5.The effects of sitagliptin (SIT) on the protein level of p-AMPK in the mesangial cells induced by AGEs. Mean±SD.n=3.**P<0.01vscontrol;△△P<0.01vsAGE;#P<0.05vsAGE+SIT (5 μmol/L).
图5 西格列汀对AGEs条件下大鼠系膜细胞AMPK磷酸化的影响
讨 论
自噬是胞浆大分子物质和细胞器在膜包囊泡中降解的生物学过程,主要通过对受损细胞器和老化蛋白质等大分子物质进行降解,为合成新的蛋白质和更新细胞器提供所需的原料,维持蛋白代谢平衡及细胞内环境稳定[7]。自噬异常能导致肿瘤、神经退变、糖尿病等多种疾病的发生。糖尿病肾病进展过程的肾小球基底膜增厚、系膜及基质增生聚集、蛋白尿等一系列病理过程与自噬关系密切[8]。研究表明抑制自噬可引起糖尿病肾病患者肾小球滤过率下降,增加TGF-β1和结缔组织生长因子的表达[9]。此外,Munehiro等[10]研究发现,恢复了肾小管的自噬,可改善了糖尿病肾病肾脏的损伤。还有研究指出适度的自噬对糖尿病肾病具有保护作用,能够抑制糖尿病肾病的发生和发展[11]。因此,我们推测通过干预自噬可能可以达到保护肾脏、延缓肾脏疾病进展的目的。
Beclin-1是酵母自噬基因在哺乳细胞中的同源蛋白,参与自噬体的形成,其表达强度与自噬活性紧密相关[7]。本研究证实西格列汀能够抑制AGEs作用下大鼠系膜细胞的活力以及细胞外基质的分泌,初步证实了西格列汀可能具有一定的肾脏保护作用,这与以往的研究具有一致性。同时本研究还证实AGEs可明显抑制系膜细胞beclin-1的表达,这一结果初步表明AGEs可能通过抑制细胞自噬引起糖尿病肾病的发生,而西格列汀可能通过诱导自噬的发生发挥肾脏保护作用。
mTORC1是一种丝氨酸/苏氨酸蛋白激酶,参与自噬小体的诱导及形成,负性调控细胞自噬。有研究指出,抑制mTORC1信号通路可以起到保护肾脏的作用,并减缓糖尿病肾病的发展[12-13]。AMPK是一种异源三聚体蛋白,由α、β和γ亚单位组成,对分解代谢起到关键的作用,是机体能量代谢平衡的总开关。有研究指出糖尿病肾病中激活AMPK不仅可以通过对mTORC1的抑制达到对自噬作用的调控,且可以通过对ULK1激酶调节beclin-1的表达实现对自噬的直接调控作用,减轻细胞外基质的分泌和肾脏的纤维化[14-15]。因此推测AMPK对肾脏的保护作用可能是通过对自噬作用的激活实现的。本研究证实西格列汀可抑制AGEs条件下系膜细胞mTORC1底物蛋白p70S6K的磷酸化,显示西格列汀可抑制AGEs条件下系膜细胞mTORC1的活性。此外,西格列汀还可促进AGEs条件下系膜细胞AMPK的磷酸化。由此可推测西格列汀可能通过促进AMPK的磷酸化及抑制mTORC1的活性进而上调自噬相关蛋白beclin-1表达,从而诱导细胞自噬的发生,发挥肾脏保护作用,但其具体机制仍需进一步研究。
[1] Kume S, Thomas MC, Koya D. Nutrient sensing, auto-phagy, and diabetic nephropathy[J]. Diabetes, 2012, 61(1):23-29.
[2] Nunez DJ, Bush MA, Collins DA, et al. Gut hormone pharmacology of a novel GPR119 agonist (GSK1292263), metformin, and sitagliptin in type 2 diabetes mellitus: results from two randomized studies[J]. PLoS One, 2014, 9(4):e92494.
[3] Maheshwari R, Balaraman R, Sen AK, et al. Effect of concomitant administration of coenzyme Q10 with sitagliptin on experimentally induced diabetic nephropathy in rats[J]. Ren Fail, 2017, 39(1):130-139.
[4] Ali SM, Khalifa H, Mostafa DK, et al. Suppression of connective tissue growth factor mediates the renoprotective effect of sitagliptin rather than pioglitazone in type 2 diabetes mellitus[J]. Life Sci, 2016, 153:180-187.
[5] Murase H, Kuno A, Miki T, et al. Inhibition of DPP-4 reduces acute mortality after myocardial infarction with restoration of autophagic response in type 2 diabetic rats[J]. Cardiovasc Diabetol, 2015, 14:103.
[6] Zeng Y, Li C, Guan M, et al. The DPP-4 inhibitor sitagliptin attenuates the progress of atherosclerosis in apolipoprotein-E-knockout mice via AMPK-and MAPK-depen-dent mechanisms[J]. Cardiovasc Diabetol, 2014, 13:32.
[7] Cabet E, Batonnet-Pichon S, Delort F, et al. Antioxidant treatment and induction of autophagy cooperate to reduce desmin aggregation in a cellular model of desminpathy[J]. PLoS One, 2015, 10(9):e0137009.
[8] Kitada M, Takeda A, Nagai T, et al. Dietary restriction ameliorates diabetic nephropathy through anti-inflammatory effects and regulation of the autophagy via restoration of Sirt1 in diabetic Wistar fatty (fa/fa) rats: a model of type 2 diabetes[J]. Exp Diabetes Res, 2011, 2011:908185.
[9] Koya D, Kitada M, Kume S, et al. Interventions against nutrient sensing pathways represent an emerging new therapeutic approach for diabetic nephropathy[J] Clin Exp Nephrol, 2014, 18(2):210-213.
[10]Munehiro K, Yoshio O, Taeko S, et al. A very-low-protein diet ameliorates advanced diabetic nephropathy through autophagy induction by suppression of the mTORC1 pathway in Wistar fatty rats,an animal model of type 2 diabetes and obesity[J]. Diabetologia, 2016, 59(6):1307-1317.
[11]Liu WJ, Xie SH, Liu YN, et al. Dipeptidyl peptidase IV inhibitor attenuates kidney injury in streptozotocin-induced diabetic rats[J]. J Pharmacol Exp Ther, 2012, 340(2):248-255.
[12]吴德佩, 肖 瑛, 张莹莹, 等. 糖尿病大鼠肾组织中PTEN/AKT/mTOR通路对自噬的调控作用?[J].中国病理生理杂志, 2016, 32(11):2015-2019.
[13]杨凤杰, 周建华, 吕倩影, 等. 雷帕霉素减缓大鼠被动 Heymann 肾炎的进展[J].中国病理生理杂志, 2014, 30(9):1661-1665.
[14]Yao F, Zhang M, Chen L. 5’-Monophosphate-activated protein kinase (AMPK) improves autophagic activity in diabetes and diabetic complications[J]. Acta Pharm Sin B, 2016, 6(1):20-25.
[15]Luo X, Deng L, Lamsal LP, et al. AMP-activated protein kinase alleviates extracellular matrix accumulation in high glucose-induced renal fibroblasts through mTOR signaling pathway[J]. Cell Physiol Biochem, 2015, 35(1):191-200.
(责任编辑: 陈妙玲, 罗 森)
Effect of sitagliptin on autopaghy in mesangial cells induced by AGEs
JIANG Ying-juan, JIANG Zuo-feng, WU Xiao-lan, HUANG Pei, WU Weng-fa, Yu Hui-wen
(DepartmentofGeneralMedicine,GuangzhouRedCrossHospital,SchoolofMedicine,JinanUniversity,Guangzhou510220,China.E-mail:yuhwgz@163.com)
AIM: To investigate the effect of sitagliptin on the autopaghy and the expression of extracellular matrix in mesangial cells induced by advanced glycation end products (AGEs). METHODS: The cells were divided into 5 groups: control group, AGE group, and sitagliptin (5, 10 and 20 μmol/L) groups. After 48 h, the cell viability was measured by MTT assay, and the content of collagen (Col) Ⅳ in the supernatant of the cell culture was detected by ELISA. The protein levels of beclin-1, adenosine monophosphate-activated protein kinase (AMPK), p-AMPK, p70S6K and p-p70S6K were determined by Western blot. RESULTS: Compared with control group, the viability and the expression of Col IV induced by AGEs in the cultured mesangial cells were significantly increased (P<0.01). Sitagliptin decreased the viability and the expression of Col IV induced by AGEs in the mesangial cells in a dose-dependent manner. AGEs significantly inhibited the protein levels of beclin-1 and p-AMPK, but significantly increased the protein level of p-p70S6K. Compared with AGE group, sitagliptin significantly reversed the above results in a dose-dependent manner. CONCLUSION: Autophagy may mediate the protective effect of sitagliptin on mesangial cells induced by AGEs.
Sitagliptin; Autophagy; Mesangial cells; Diabetic nephropathy; Beclin-1; Adenosine monophosphate-activated protein kinase
1000- 4718(2017)08- 1455- 05
2017- 01- 19
2017- 05- 17
广州市卫生和计划生育科技一般引导项目(No. 20161A011020)
R363.2+1; R587.1
A
10.3969/j.issn.1000- 4718.2017.08.018
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-34402117; E-mail: yuhwgz@163.com
