牛肉住肉孢子虫的种类及其危害研究进展
2017-09-03陆瑶瑶杨玉荣
董 辉, 陆瑶瑶,杨玉荣
河南省高校科技创新人才支持计划资助(No.17HASTIT038)
牛肉住肉孢子虫的种类及其危害研究进展
董 辉, 陆瑶瑶,杨玉荣
河南省高校科技创新人才支持计划资助(No.17HASTIT038)
黄牛是住肉孢子虫的中间宿主,住肉孢子虫危害牛肉品质和安全,人类食用患病牛肉会危害健康,引起腹痛、腹泻等症状。我国黄牛住肉孢子虫病的阳性率为3.64%~98.1%,其他国家黄牛住肉孢子虫病的阳性率为42.44%~98.72%。目前,已确定的黄牛住肉孢子虫虫型有5种,分别为S.cruzi、S.hirsuta、S.hominis、S.rommeli、S.heydorni,我国已报道的黄牛住肉孢子虫型有3种S.cruzi、S.hominis和S.heydorni,前两种虫型对牛和人均有致病性。本文综述了黄牛牛肉中住肉孢子虫的生活史、流行情况、种类、致病性以及诊断方法,为监控牛肉中的住肉孢子虫提供参考依据。
牛;牛肉;住肉孢子虫;虫型;致病性;诊断
住肉孢子虫(Sarcocystis)属真球虫目、肉孢子虫科、肉孢子虫属。住肉孢子虫广泛寄生于恒温动物和变温动物,具有严格的宿主选择性,常寄生于横纹肌和中枢神经系统[1]。早在1843年,Miescher第一次在鼠横纹肌中发现了白色线状的住肉孢子虫包囊[2]。经研究证实,住肉孢子虫中间宿主多为食草动物,终末宿主为食肉动物[3]。黄牛是住肉孢子虫的中间宿主[4],已确定5种住肉孢子虫虫型寄生于牛肉中:分别为S.cruzi、S.hirsuta、S.hominis、S.rommeli、S.heydorni,不同虫型的组织分布位置不同,且不同虫型的终末宿主也不相同[1]。S.cruzi流行最为广泛,对养殖业造成的损失最为严重[1]。人类是S.hominis和S.heydorni的终末宿主,感染后可引起人的胃肠道疾病,欧洲食品安全局(European Food Safety Authority)已将S.hominis列为肉品检疫监督过程的危害因子[5]。本文综述了黄牛住肉孢子虫的生活史、流行情况、各型形态学特点、致病性以及诊断方法,为监控牛肉中的住肉孢子虫提供参考依据。
1 黄牛住肉孢子虫的生活史
住肉孢子虫和弓形虫的生活史十分相似,发育过程中必需更换宿主[1]。中间宿主通过吞食终末宿主排出粪便中的卵囊引起感染,终末宿主食入生的或者未煮熟含有住肉孢子虫包囊的肌肉或神经组织而感染[6](图 1)。犬科动物是S.cruzi的终末宿主,野牛和黄牛是S.cruzi的中间宿主,以S.cruzi住肉孢子虫为例解释黄牛住肉孢子虫的生活史。
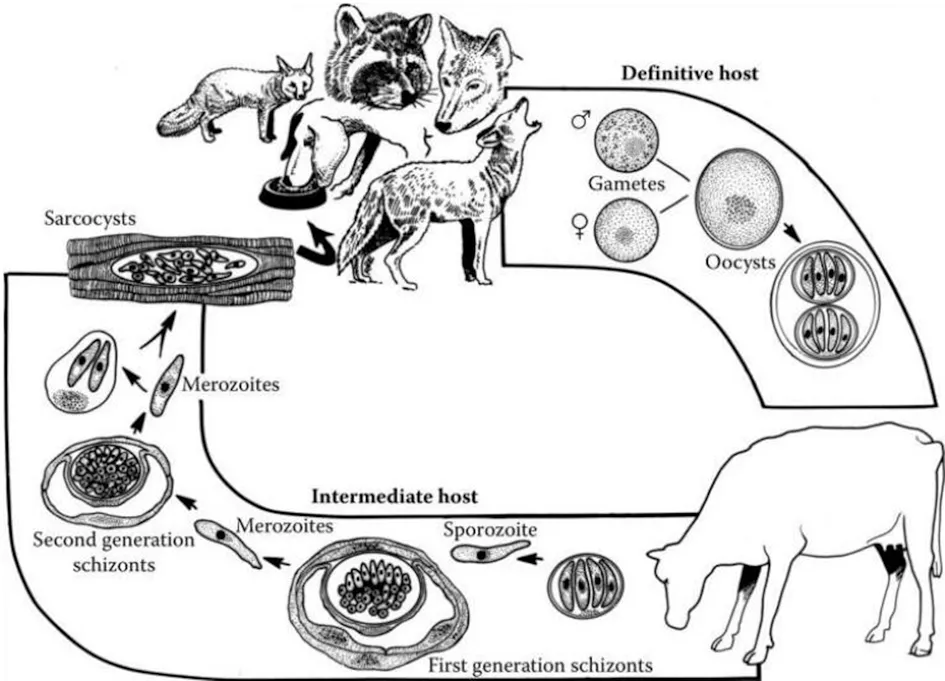
图1 黄牛住肉孢子虫生活史Fig.1 Life cycle of Sarcocystis in cattle
1.1 终末宿主内的有性生殖 终末宿主(狗、狐狸、狼、豺、浣熊)食入S.cruzi住肉孢子虫包囊,经胃、肠道消化释放缓殖子,缓殖子侵入小肠黏膜吸收细胞或杯状细胞,约6 h产生雌配子和雄配子,雌配子和雄配子数量比约为95∶5。约24 h,雌配子和雄配子受精形成合子,合子外分泌囊壁形成卵囊。卵囊移行至固有层,经孢子化形成2个孢子囊,每个孢子囊含有4个子孢子。卵囊壁很薄,孢子囊常破壁而出进入肠腔,因此,未孢子化卵囊、部分孢子化卵囊、单个孢子囊均可随粪便排出。
1.2 中间宿主中的无性生殖 野牛或黄牛食入被S.cruzi卵囊污染的水或饲草,约经过4~7 d,住肉孢子虫卵囊进入小肠,子孢子从孢子囊释放出来,进入肠腔和肠系膜淋巴结动脉上皮细胞。住肉孢子虫卵囊感染后7~15 d,子孢子进入动脉内皮细胞完成第一代裂殖体的发育过程。感染后19~46 d,第一代裂殖子进入全身毛细血管、小动脉内皮细胞完成第二代裂殖体的发育。一般可在感染后的24~46 d,从黄牛的外周血液检测到住肉孢子虫裂殖子。第二代裂殖子从裂殖体释放出来,进入横纹肌或神经系统,形成住肉孢子虫包囊。流行病学调查发现黄牛横纹肌中的住肉孢子虫包囊阳性率可达100%,而心脏、神经系统中包囊的阳性率要比骨骼肌高。推测住肉孢子虫第二代裂殖子在进入横纹肌或神经系统的时候具有选择性,原因尚不清楚。住肉孢子虫包囊一般可在动物体内维持一生,也有部分包囊在3个月后逐渐消失,从包囊释放的缓殖子不能在中间宿主体内继续进行发育。住肉孢子虫卵囊感染后75 d以后形成的包囊才可感染终末宿主,裂殖体和不成熟的包囊均不能感染终末宿主。
2 黄牛住肉孢子虫病的流行与分布
2.1 黄牛住肉孢子虫在其他国家的感染情况 国际上已经确定的黄牛住肉孢子虫有S.cruzi、S.hirsuta、S.hominis、S.rommeli、S.heydorni,其中前3种虫的终末宿主分别是犬科动物、猫科动物、灵长类(人)。而S.rommeli的终末宿主尚不清楚,但人和红狐(Vulpesvulpes)已被证实经口服有S.rommeli包囊的牛肉不能感染[7],S.heydorni的终末宿主是人[8]。世界黄牛住肉孢子虫的阳性率在42.11%~98.72%[1],阳性率在亚洲最低,南美洲最高,见表1。
2.2 黄牛住肉孢子虫在我国的流行情况 根据我国住肉孢子虫形态学观察和流行病调查的报道[13-29],黄牛住肉孢子虫病的阳性率为3.64%~98.1%,见表2。根据已报道文献,我国研究人员对黄牛住肉孢子虫的形态学鉴定、阳性率和感染程度进行了一些研究,运用肉眼观察、压片镜检、蛋白酶消化、石蜡切片H&E染色和扫描电子显微镜等方法,发现的虫型有:S.cruzi、S.hominis、S.heydorni。其中由于养殖方式和地区环境的差异,各个地区S.cruzi的阳性率也不同,但均对黄牛养殖业造成了不同程度的危害。前人报道鉴别方法中多提到运用眼观检查,而可以通过眼观检出的仅是S.hirsuta,虽无明确指出我国存在S.hirsuta,但从侧面显示我国有S.hirsuta住肉孢子虫的存在。
3 黄牛住肉孢子虫的致病性及形态学特点
3.1 黄牛住肉孢子虫的致病性 住肉孢子虫包囊寄生于黄牛的横纹肌中,但并不是所有类型的包囊都对中间宿主存在严重致病性,住肉孢子虫的终末宿主可以是犬科动物、猫科动物或其它动物(表3)。对于中间宿主来说,通过犬科动物传播的住肉孢子虫要比猫科动物或其它动物传播的住肉孢子虫致病性强[1]。黄牛住肉孢子虫中,S.cruzi的致病性最强,感染犊牛或成年牛后,患牛表现为厌食、发热,体重减轻、流产、甚至死亡等症状,影响肉的品质和经济效益。
人们吃生牛肉或未充分煮熟的牛肉,摄入肌肉中S.hominis住肉孢子虫包囊,可排泄S.hominis

表1 世界黄牛住肉孢子虫的阳性率及分布情况Tab.1 Distribution and positive rate of Sarcocystis in cattle of world

表2 中国各地区黄牛住肉孢子虫流行病学调查Tab.2 Epidemiological investigation of sarcocystiosis in cattle of China
NI=not indicated
卵囊,导致人的胃肠道出现腹部不适、腹痛、腹泻等症状。牛肉汉堡是非常流行的快餐食品,伊朗-牛肉汉堡中的住肉孢子虫的阳性率为56.25%[31]。Ahmadi通过PCR-RFLP的方法发现汉堡中存在S.hominis[32],由于住肉孢子虫的致病性,住肉孢子虫感染严重的牛需要销毁。而感染住肉孢子虫轻微的牛,由于虫体寄生及其产生的毒素,肌肉组织受到不同程度的损害,致使肉品中残留毒素,降低营养和价值[17],而S.hominis更是威胁食品安全,危害人类健康,应加强此类寄生虫监管,以防止带有S.hominis的牛肉被人食用。关于S.hirsuta、S.rommeli和S.heydorni的致病性,尚未见报道。
3.2 黄牛住肉孢子虫的形态学特点 黄牛住肉孢子虫5种虫型之间的致病性及形态学特征的差别,见表3。其中S.rommeli是Dubey对S.sinensis-like的重新命名[7],其易与中间宿主为水牛的S.sinesis混淆[34]。不同住肉孢子虫包囊壁的超微结构具有明显的区别,包囊外有囊壁和突起(Villar protrusions,VP),囊壁的厚度不同,VP类型有42种[3]。VP是原囊壁向包囊外表面褶皱形成的突起,突起层下是基质层,基质层向囊腔内伸入形成隔,囊腔被分割成若干个小室[1],小室中含有靠近外周的母细胞和在中央的大量缓殖子。
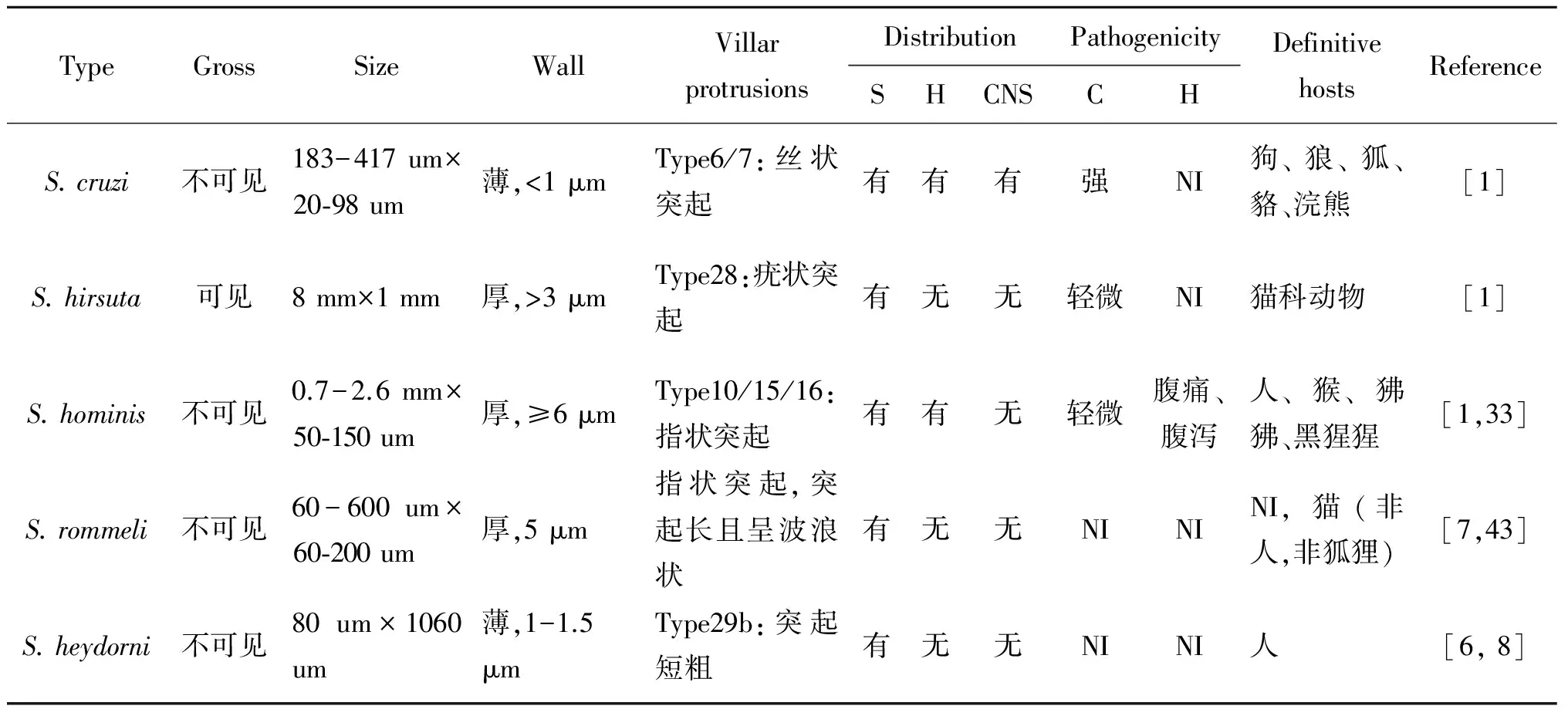
表3 黄牛住肉孢子虫特性比较Tab.3 Comparison of the characteristics of sarcocysts in cattle
C: cattle 黄牛;CNS: central nervous system 中枢神经系统;H: heart 心肌;H: human 人;S: skeletal 骨骼肌;NI=not indicated
4 黄牛住肉孢子虫的检测和鉴定方法
4.1 粪便中住肉孢子虫卵囊的检查 不同住肉孢子虫感染后潜伏期和前驱期不同,大多数住肉孢子虫均可在终末宿主食入住肉孢子虫包囊后的7~14 d,查到粪便中的住肉孢子虫卵囊。因终末宿主仅在有限的特定时期排出住肉孢子虫卵囊,通常粪便中的卵囊检出率比较低。常用糖或盐漂浮卵囊,洗涤粪便,而糖漂浮法要比盐漂浮法对卵囊的损害小,是更为常用的一种方法[1]。
4.2 肌肉中包囊的检查 住肉孢子虫包囊可以通过肉眼直接观察、光学显微镜观察未染色的组织压片、病理组织学以及蛋白酶消化法进行检查。肉眼直接检查黄牛住肉孢子虫时,仅S.hirsuta可以形成肉眼可见的住肉孢子虫包囊[4]。运用组织压片技术可以观察到肉眼看不见的住肉孢子虫包囊。将新鲜的组织固定,经病理组织学切片和染色技术进行检查,可观察包囊周围组织特征且可长期保留样品。蛋白酶消化宿主组织,检测消化液是否含有住肉孢子虫缓殖子或包囊。这几种方法中,病理组织学和蛋白酶消化法检出率较高,但过程较繁琐[1]。
4.3 血清学的检测 酶联免疫吸附方法是快速诊断感染的血清学方法,应用广泛。间接血凝试验反应敏感,与ELISA均易出现假阳性,需严格控制反应条件[35-36]。Dot-ELISA是在常规ELISA方法的基础上发展起来的,Dot-ELISA较ELISA和IFAT而言,Dot-ELISA特异性强,假阳性少[37]。血清学方法简便快速、灵敏度高,但由于住肉孢子虫进入中间宿主体内后进行无性生殖,从子孢子释放到形成第二代裂殖体这一感染过程相对其他传染疾病而言较为漫长,所以无法诊断是急性住肉孢子虫病或慢性住肉孢子虫感染,尚需进一步研究。
4.4 分子生物学检测和基因的多样性 聚合酶链式反应可通过对各种住肉孢子虫特有的保守序列设计特异性引物,进而扩增特异性片段达到检测的目的。18s rRNA、线粒体COX1基因、28sr RNA、 内部转录间隔区(internal transcribed spacer,ITS)均可鉴别住肉孢子虫的基因片段。已报道的关于黄牛住肉孢子虫18s rRNA等PCR引物序列,见表5。为准确快速筛查住肉孢子虫阳性样品,本课题组对表4中序号为2,3,6,7,9的5对引物进行了PCR扩增,发现第7对引物电泳条带明亮,灵敏度高于其他4对引物。分子生物学方法有利于区分虫型,但其判断结果的准确性和特异性取决于基因的分析,有研究运用18s rRNA对住肉孢子虫分型,然而对于虫种鉴别有其局限性,如S.neurona和S.falcatula在结构上差别很大,但18s rRNA序列却几乎相同[1]。
随着分子生物学技术的发展,运用多重PCR测序技术、寄生虫核苷酸序列中片段的差异性、引物与DNA的特异选择性结合、随机扩增的多态性DNA基因片段、特异性强的产物片段鉴别虫型之间的差异等方法,可对住肉孢子虫及其他原虫类寄生虫进行区别、分类以及确定各虫型之间的关系,但通过分子学手段得到的结果只能作为鉴别诊断的一个辅助指标,对其做准确、精确分类的判定还应结合虫的形态,研究其发育过程和感染途径。
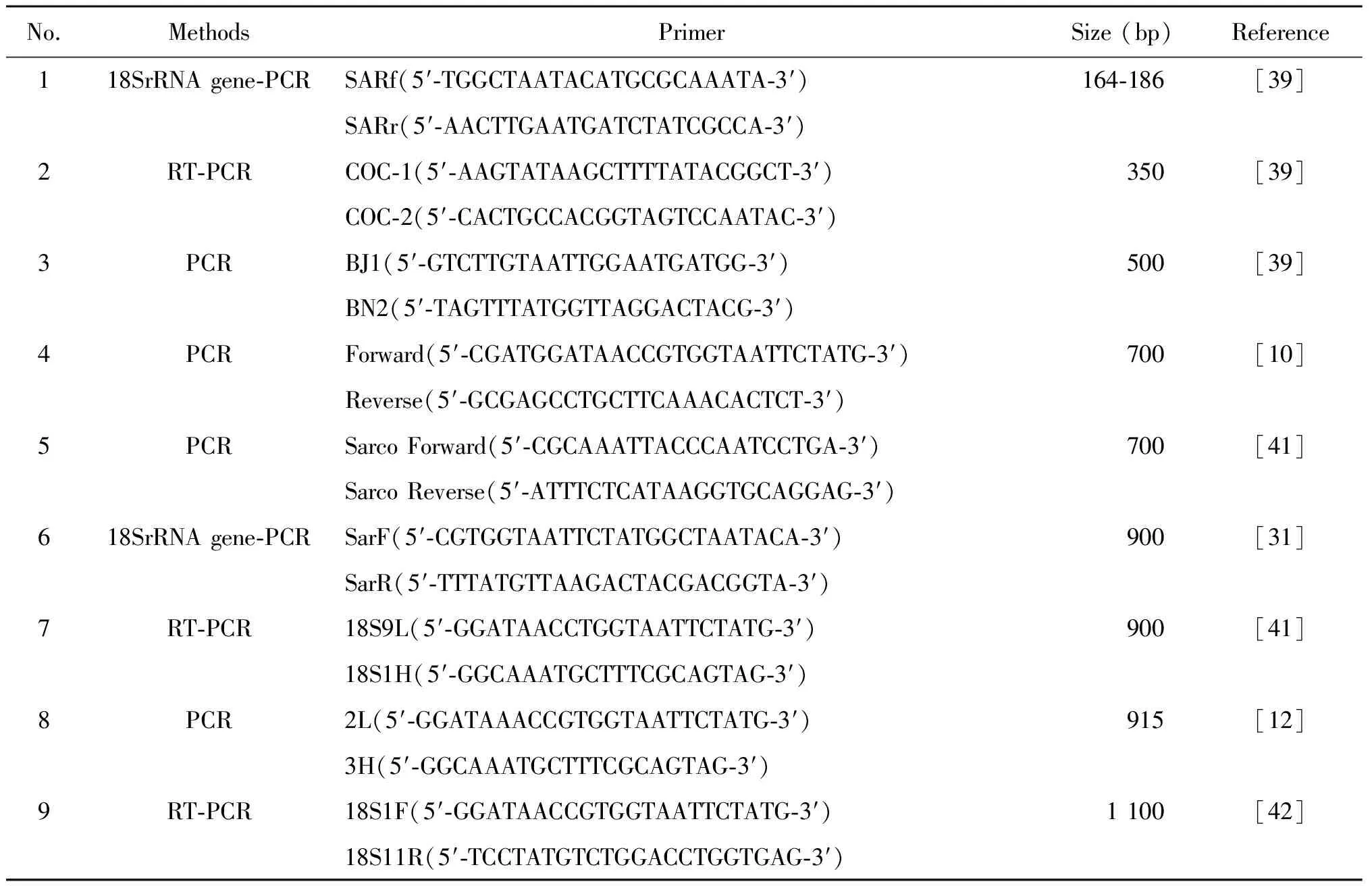
表4 黄牛住肉孢子虫PCR引物序列Tab.4 Sequences of PCR primers of Sarcocystis in cattle
Note:aAmplicons of 164 bp forS.hominis, 172 bp forS.cruzi, and 186 bp forS.hirsuta
5 讨 论
根据住肉孢子虫包囊的形态、大小和壁的薄厚,VP的形状,以及不同终末宿主的特异性可以鉴别并区分虫型。而形态学检测技术(光学显微镜、电子显微镜)结合分子生物学检测技术是鉴别住肉孢子虫虫型之间差异的最有力的方法。近年来,住肉孢子虫新的虫型不断被发现,我国学者对黄牛和水牛住肉孢子虫病的调查研究做出了巨大的贡献。但我国对黄牛住肉孢子虫病的流行病调查尚少,因此进一步加强黄牛住肉孢子虫流行病学调查研究,对于及时掌握住肉孢子虫的感染情况和感染强度进而对其防治具有重要意义。由于黄牛住肉孢子虫对于人和动物危害较大,为减少畜牧养殖业的经济损失和对人身体健康的危害,了解该病的流行病学特点,寻求建立快速、高效、准确的住肉孢子虫病的诊断方法,进而控制该病是目前的研究重点。
[1] Dubey JP, Calero BBR, Rosenthal BM, et al. Sarcocystosis of animals and humans[J]. Boca Raton: CRC Press, 2015.
[2] Fayer R.Sarcocystisspp. in human infections[J]. Clin Microbiol Rev, 2004, 17(4): 894-902. DOI: 10.1128/CMR.17.4.894-902.2004
[3] Saeid R, Nourollahi D, Reza K, et al. Prevalence and histopathological finding of thin-walled and thick-walledSarcocystisin slaughtered cattle of Karaj abattoir, Iran[J]. J Parasit Dis, 2013, 39(2): 272-275. DOI: 10.1007/s12639-013-0341-2
[4] Nourani H, Matin S, Nouri A, et al. Prevalence of thin-walledSarcocystiscruziand thick-walledSarcocystishirsutaorSarcocystishominis from cattle in Iran[J]. Trop Anim Hlth Production, 2010, 42(6): 1225-1227. DOI: 10.1007/s11250-010-9552-z
[5] Blagojevic B, Antic D. Assessment of potential contribution of official meat inspection and abattoir process hygiene to biological safety assurance of final beef and pork carcasses[J]. Food Ctrl, 2014, 36(1): 174-182.
[6] Dubey JP, Van WE, Calerobernal R, et al.Sarcocystisheydorni, n. sp. (Apicomplexa:Sarcocystidae) with cattle (Bostaurus) and human (Homosapiens) cycle[J]. Parasitol Res, 2015, 114(11): 4143-4147. DOI: 10.1007/s00436-015-4645-2
[7] Dubey JP, More G, van Wilpe E, et al.Sarcocystisrommeli, n.sp. (Apicomplexa:Sarcocystidae) from cattle (Bostaurus) and its differentiation fromSarcocystishominis[J]. Jeukary Microb, 2016, 63(1): 62-68. DOI: 10.1111/jeu.12248
[8] Hu JJ, Wen T, Chen XW, et al. Prevalence, morphology, and molecular characterization ofSarcocystisheydornisarcocysts from cattle (BosTaurus) in China[J]. J Parasitol, 2016, 102(5): 545-548. DOI: 10.1645/16-49
[9] Mirzaei M, Rezaei H. A survey onSarcocystisspp. infection in cattle of Tabriz city, Iran[J]. J Parasit Dis, 2014: 1-4. DOI: 10.1007/s12639-014-0551-2
[10] Akhlaghi M, Razavi M, Hosseini A. Molecular differentiation of bovine sarcocysts[J]. Parasitol Res, 2016, 115(7): 1-8. DOI: 10.1007/s00436-016-5020-7
[11] Amairia S, Amdouni Y, Rjeibi MR, et al. First molecular detection and characterization ofSarcocystis, species in slaughtered cattle in North-West Tunisia[J]. Meat Sci, 2016, 122: 55-59. DOI: 10.1016/j.meatsci.2016.07.021
[12] Daptardar M, Singh BB, Aulakh RS, et al. Prevalence and first molecular identification ofSarcocystisspecies in cattle and water buffaloes in India[J]. Acta Parasitol, 2016, 61(3): 523-528. DOI: 10.1515/ap-2016-0069
[13] Wang M, Ma JH. A survey ofSarcocystisinfection in domestic animals[J]. Chin J Vet Med, 1999, 25(12): 11-12. DOI:10.3969/j.issn.0529-6005.1999.12.004. (in Chinese)
汪明, 马俊华. 家畜住肉孢子虫感染情况调查[J]. 中国兽医杂志, 1999, 25(12):11-12.
[14] Tan SC, Luo Y. Advance of sarcocytosis in cattle[J]. Guizhou Anim Sci Vet Med, 1990(2): 7-8. (in Chinese)
谭绍才, 罗怡. 牛肉孢子虫病研究[J]. 贵州畜牧兽医, 1990(2):7-8.
[15] Wang DD, Han XY, Xie BL, et al. Investigation report onSarcocystisof cattle in Guizhou[J]. Chin J Vet Med, 1990,16(03): 14-15. (in Chinese)
王道地, 韩行贇, 谢百练, 等. 贵州黄牛肉孢子虫调查报告[J]. 中国兽医杂志, 1990,16(03): 14-15.
[16] Xu SL. Investigation report on the infection ofSarcocystisin cattle[J]. Heilongjiang Anim Sci And Vet Med, 1989(8): 8-10. (in Chinese)
徐淑兰. 牛住肉孢子虫感染情况的调查报告[J]. 黑龙江畜牧兽医, 1989(8):8-10.
[17] Xu F, Guo LJ, Sha YM, et al. Analysis on the distribution of infectious diseases in the exported meat ofSarcocystisin cattle[J]. Heilongjiang Anim Sci And Vet Med, 2001(8): 33-34. DOI: 10.3969/j.issn.1004-7034.2001.08.026 (in Chinese)
徐峰, 郭丽君, 沙永茂,等. 黄牛住肉孢子虫在出口分割肉中感染分布状况的分析[J]. 黑龙江畜牧兽医, 2001(8):33-34.
[18] Chen HZ. Investigation onSarcocystisof cattle and sheep in south Henan Province[J]. Chin J Vet Med, 1989, 39(7): 26. (in Chinese)
陈宏智. 豫南地区猪、牛、羊住肉孢子虫病的调查报告[J]. 中国兽医杂志, 1989, 39(7):26.
[19] Shi YL, Li Y. Investigation onSarcocystisof cattle and water buffalo in western Hunan Province[J]. Hunan Anim Sci And Vet Med, 1991(2): 34. (in Chinese)
石远隆, 李益. 湘西水牛与黄牛住肉孢子虫的调查[J]. 湖南畜牧兽医, 1991(2):34.
[20] Zhou WP, Xiao BN, Zhang CG. Seroprevalence ofSarcocystisof domestic animals in Hunan Province[J]. Chin J Vet Sci, 2006, 42(6): 40. DOI: 10.3969/j.issn.0529-6005.2006.06.018 (in Chinese)
周望平, 肖兵南, 张长弓. 湖南省家畜住肉孢子虫病的血清学调查[J]. 中国兽医杂志, 2006, 42(6):40.
[21] Jiang CS, Zhang SF, Li JC, et al. Studies on sarcocytosis (I: Prevalence and type ofSarcocystisof cattle in Yanbian)[J]. J Agr Sci Yanbian Univ, 1988,2: 96-98. (in Chinese)
姜昌式, 张守发, 李吉春,等. 肉孢子虫病的研究(Ⅰ:延边黄牛肉孢子虫病流行及种类的调查)[J]. 延边大学农学学报, 1988,2:96-98.
[22] Li JC, Xian LD, Jiang CW. Prevalence of cattle carcasses ofSarcocystisin Yanbian[J]. Jilin Anim Sci Vet Med, 1988,(2): 33-34. (in Chinese)
李吉春, 咸龙德, 姜昌武. 延边黄牛屠体中肉孢子虫感染率调查[J]. 吉林畜牧兽医, 1988,(2): 33-34.
[23] Wu Y. Investigation onSarcocystisof cattle[J]. Meat Hyg, 1997,(11): 17-18. (in Chinese)
吴艳. 牛住肉孢子虫的调查[J]. 肉品卫生, 1997,(11):17-18.
[24] Shi LZ, Zhao HY. Evaluation of an enzyme immunoassay for the detection of antibodies againstSarcocystis, spp. in naturally infected cattle in China[J]. Vet Parasitol, 1987, 24(3/4): 185-194.
[25] Zhang YR. Investigation on the infection ofSarcocystisof live yak in Ledu[J]. J Qinghai Ani Sci Vet Med, 2005, 35(5): 31. DOI: 10.3969/j.issn.1003-7950.2005.05.016 (in Chinese)
张玉蓉. 乐都牦牛住肉孢子虫病感染情况调查[J]. 青海畜牧兽医杂志, 2005, 35(5):31-31.
[26] Zhou WY. Sampling investigation and analysis ofSarcocystisof commercial livestock in Lenghu areas, Qinghai[J]. Chin Anim Hlth Insp, 2011, 28(9): 51-52. DOI: 10.3969/j.issn.1005-944X.2011.09.023 (in Chinese)
周伟业. 青海冷湖地区商品牲畜肉孢子虫病抽样调查与分析[J]. 中国动物检疫, 2011, 28(9):51-52.
[27] Li SS. Investigation report onSarcocystisof market slaughtering cattle[J]. J Qinghai Anim Sci Vet Med, 2014, 44(5): 26. DOI: 10.3969/j.issn.1003-7950.2014.05.015 (in Chinese)
李世双. 市场屠宰牛住肉孢子虫病的调查报告[J]. 青海畜牧兽医杂志, 2014, 44(5):26-26.
[28] Zhou CH, Huang SY. Test report on sarcocytosis in Xichang City[J]. Livestock Poultry Industry, 2013,(6): 66. DOI:10.3969/j.issn.1008-0414.2013.06.047 (in Chinese)
周超洪, 黄世友. 西昌市牛住肉孢子虫病检验报告[J]. 畜禽业, 2013,(6):66-66.
[29] Wang GL, Xu M. Investigation on the infection of sarcocytosis of cattle in Burqin County[J]. Xinjiang Anim Sci Vet Med, 1989,(2):36. (in Chinese)
王光雷, 徐敏. 布尔津县牛住肉孢子虫病感染情况的调查[J]. 新疆畜牧业, 1989,(2):36.
[30] Lian ZQ, Ma JH, Zhou ZB, et al. Investigation on theSarcocystisof human in Gengma County, Yunnan Province[J]. Chin J Zoonoses, 1987, 3(5): 47. (in Chinese)
连自强, 马俊华, 周镇炳,等. 云南耿马县人肉孢子虫病调查[J]. 中国人兽共患病学报, 1987, 3(5):47.
[31] Ahmadi MM, Hajimohammadi B, Eslami G, et al. First identification ofSarcocystishominisin Iranian traditional hamburger[J]. J Parasit Dis, 2015, 39(4): 1-3. DOI: 10.1007/s12639-014-0425-7
[32] Nematollahia A, Khoshkerdar A, Helan JA, et al. A study on rate of infestation toSarcocystiscysts in supplied raw hamburgers[J]. J Parasit Dis, 2015, 39(2): 1-4. DOI: 10.1007/s12639-013-0339-9
[33] Domenis L, Peletto S, Sacchi L, et al. Detection of a morphogenetically novelSarcocystishominis-like in the context of a prevalence study in semi-intensively bred cattle in Italy[J]. Parasitol Res, 2011, 109(6): 1677-1687. DOI: 10.1007/s00436-011-2441-1
[34] Gjerde B, Hilali M. Domestic cats (Feliscatus) are definitive hosts forSarcocystissinensisfrom water buffaloes (Bubalusbubalis)[J]. J Vet Med Sci, 2016, 78(7): 1217-1221.
[35] Zhang CG, Xiao BN, Gong ZF, et al. Comparison of indirect hemagglutination, agar diffusion and enzyme-linked immunosorbent assay for experimental buffalo of sarcocytosis[J]. Chin Anim Hlth Insp, 1991, (2): 8-10. (in Chinese)
张长弓, 肖兵南, 龚振芳,等. 间接血凝、琼脂扩散与酶联免疫吸附试验对试验性水牛枯氏住肉孢子虫病的诊断比较[J]. 中国动物检疫, 1991(2):8-10.
[36] Xiao BN, Zhang CG, Hu SG, et al. DAS-ELISA for the diagnosis ofSarcocystiscruzicirculating antigens of live buffalo[J]. Chin J Vet Sci, 1991, (12):, 32-34. (in Chinese)
肖兵南, 张长弓, 胡述光,等. DAS-ELISA对试验性水牛枯氏住肉孢子虫病循环抗原的诊断[J]. 中国兽医科学, 1991(12):32-34.
[37] Tenter AM. Comparison of dot-ELISA, ELISA and IFAT for the detection of IgG antibodies toSarcocystismurisin experimentally infected and immunized mice[J]. Vet Parasitol, 1988, 29(2/3): 89-104.
[38] Vangeel L, Houf K, Chiers K, et al. Molecular-based identification ofSarcocystishominisin Belgian minced beef[J]. J Food Protect, 2007, 70(6): 1523-1526.
[39] Hornok S, Mester A, Takács N, et al.Sarcocystis-infection of cattle in Hungary[J]. Parasit Vectors, 2015, 8(1): 1-6. DOI: 10.1186/s13071-015-0685-9
[40] Bräunig P, Portella LP, Cezar AS, et al. DNA extraction methods and multiple sampling to improve molecular diagnosis ofSarcocystis, spp. in cattle hearts[J]. Parasitol Res, 2016, 115(10): 3913-3921. DOI: 10.1007/s00436-016-5158-3
[41] Jehle C, Dinkel A, Sander A, et al. Diagnosis ofSarcocystis, spp. in cattle (Bostaurus) and water buffalo (Bubalusbubalis) in Northern Vietnam[J]. Vet Parasitol, 2009, 166(3/4): 314-320. DOI: 10.1016/j.vetpar.2009.08.024
[42] Pritt B, Trainer T, Simmonsarnold L, et al. Detection ofSarcocystisparasites in retail beef: a regional survey combining histological and genetic detection methods[J]. J Food Protect, 2008, 71(10): 2144-2147.
[43] Hu JJ,Huang S,Wen T,et al.Morphology,molecular characteristics and demonstration of a defifitive host forSarcocystisrommeli from cattle (BOS trunis) in China[J].J of Parasit,2017.
Yang Yu-rong, Email: yangyu7712@sina.com
SpeciesandhazardofSarcocystisinbeef
DONG Hui, LU Yao-yao, YANG Yu-rong
(CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China)
Sarcocystispose harm on human and domestic animal. The acute infection ofSarcocystiscould cause abortion, death and caused huge economic losses for farms. Cattle were intermediate host ofSarcocystis. Consumption beef containingSarcocystiscysts endanger human health, causing abdominal pain and diarrhea. The positive rate was 42.44%-98.72% globally, and it was reported 3.64%-98.1% in China. FiveSarcocystisspecies were confirmed in cattle,S.cruzi,S.hirsuta,S.hominis,S.rommeli, andS.heydorni. Three species have been reported in cattle from China:S.cruzi,S.hominis, andS.heydorni. It had been verified thatS.cruziandS.hominishad strong pathogenicity to cattle and human. This paper reviews the life cycle, epidemiology, classification, pathogenicity and diagnosis of cattleSarcocystis, providing reference for supervisory and controlSarcocystisin beef.
cattle; beef;Sarcocystis; strains; pathogenesis; diagnosis
10.3969/j.issn.1002-2694.2017.08.014
,杨玉荣,Email: yangyu7712@sina.com
河南农业大学牧医工程学院, 郑州 450002
Supported by the Program for Science&Technology Innovation Talents in Universities of Henan Province (Grant No. 17HASTIT038)
R382.3
:A
:1002-2694(2017)08-0734-07
2016-12-28编辑:张智芳
