猪肉中常见致病菌的多重直接PCR法的建立与应用
2017-09-03黄秀梅盖文燕赵建梅曲志娜李月华张林波王君玮
宋 雪,赵 格,王 娟,黄秀梅,盖文燕,赵建梅,曲志娜,李月华,张林波,王君玮
猪肉中常见致病菌的多重直接PCR法的建立与应用
宋 雪1,2,赵 格1,王 娟1,黄秀梅1,盖文燕1,赵建梅1,曲志娜1,李月华1,张林波2,王君玮1
目的建立检测大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌和小肠耶尔森氏菌5种致病菌的多重直接PCR方法。方法根据大肠杆菌phoA、沙门氏菌invA、金黄色葡萄球菌nuc、李斯特菌hly、小肠耶尔森氏菌ail的基因序列,设计多重直接PCR引物,建立并优化多重直接PCR反应条件,检测引物的扩增特异性和灵敏性,并将所建立的方法应用于实际采集猪肉样本的检测,与金标培养法相比较,计算多重直接PCR检测法的敏感性、准确性以及阳性预测值。结果所设计的多重直接PCR引物对5种菌都有特异扩增,最低检出限量大肠杆菌为10 CFU,金黄色葡萄球菌敏感性为100 CFU,沙门氏菌、李斯特菌、小肠耶尔森氏菌敏感性可达1 CFU。60份猪肉样本中检出大肠杆菌15份、沙门氏菌6份、金黄色葡萄球菌21份、李斯特菌20份、小肠耶尔森氏菌35份,阳性检出率均高于金标培养法,总体检测敏感性为100%,准确性为94%,阳性预测值为81.44%。结论多重直接PCR法实现了同时对各食源性致病菌敏感特异的检测,并且省去了提取模板的步骤,将检测时间缩短至3 h左右,便于食品安全风险监测中常见食源性致病菌的通量检测。
多重直接PCR;猪肉;食源性致病菌
食源性疾病大部分是由食品中污染的致病菌引起的[1]。大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌和小肠耶尔森氏菌都是食品污染的常见致病菌,可导致细菌性食物中毒,引发多种疾病,甚至死亡。有文献显示,在我国致病菌引起的食物中毒事件中,70%~80%是由沙门氏菌引起的[2]。全球每年大约9 380万胃肠炎病例为沙门氏菌感染引起[3-4]。大肠杆菌分为致病性大肠杆菌和非致病性大肠杆菌。在致病性大肠杆菌中O157∶H7以其高致病性引起了国内外的广泛关注。根据前人的研究统计,O157∶H7在畜禽类产品中的污染率最高可达到43.8%,并且在猪肉、鸡肉、牛肉、羊肉、鸡蛋中均分离得到了O157∶H7[5]。李斯特菌在自然界分布极其广泛。李斯特菌虽然发病率不高,但是死亡率可达到30%左右[6]。美国每年约有2 600人感染单增李斯特菌,其中约1 500人罹患李斯特菌病住院治疗,约260人死亡。在我国李斯特菌在畜禽产品中的检出率为1.5%~21.1%,屠宰环节猪胴体中的检出率高达40%[7-8]。我国相关调查显示在生鲜肉中金黄色葡萄球菌的污染率为7.7%~32.9%[9],在生鲜奶中其污染率高达11.5%~40.9%[10-11]。小肠耶尔森氏菌是少数几种可以在冷藏温度下继续生长的致病菌之一。近几年来,国内外均有报道人类感染小肠耶尔森氏菌死亡的事件。近年来越来越多的人关注食品安全问题,特别是关于动物产品质量安全的检测。所以如何快速灵敏的检测出这些食源性致病菌的存在已经成为了越来越多的人关心的话题。
目前,对这些致病微生物的检测,更多的是用细菌分离培养方法,即从样品中先进行细菌的分离培养,再用生化方法鉴定。但细菌培养法存在了很多弊端,检测周期长,一般需要4~7 d;操作繁琐;灵敏度低;一次只能检测一种病原菌等[12]。因此,建立一种方便快速、灵敏度高、特异性强的检测方法刻不容缓,这对预防和控制食源性疾病的发生和流行至关重要。由于PCR方法特异性强、灵敏度高、操作简单,所以采用在常规PCR基础上改进并发展起来的多重直接PCR技术,利用一种特殊的聚合酶开发的直接PCR反应酶,在同一反应体系中加入多对引物进行扩增,可以扩增出多个目的条带,这一技术建立一种不经过细菌培养、DNA提取的快速准确检测大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特氏菌、小肠耶尔森氏菌方法,并成功应用于实际样品的检测。
1 材料与方法
1.1 材料
1.1.1 实验材料 大肠埃希菌标准株、肠炎沙门氏菌标准株、金黄色葡萄球菌标准株、单增李斯特氏菌、小肠耶尔森氏菌、志贺氏菌、空肠弯曲杆菌、肠球菌保存于中国动物卫生与流行病学实验室。60份猪肉样本采集于A市各大超市。
1.1.2 主要试剂与仪器 生物安全柜(万心顺昌科技有限公司)、电热恒温培养箱(上海爱朗仪器有限公司)、快速涡匀器(中外合资深圳天南海北有限责任公司)、PCR仪(美国BIO-RAD公司)、电泳仪(北京六一仪器厂)、Gel Doc XR凝胶成像分析仪(美国BIO-RAD公司)。
胰蛋白大豆栋、细菌琼脂粉购于北京陆桥技术有限公司。DNA Marker DL2000、GoTaq○RGreen Master Mix、MightyAmp○RDNA Polymerase Ver.2购于TaKaRa公司。
1.2 方法
1.2.1 引物设计及合成 分别下载20个GenBank收录的不同分离株的大肠杆菌phoA、沙门氏菌invA、金黄色葡萄球菌nuc、李斯特菌hly、小肠耶尔森氏菌ail的基因序列,利用DNAman软件进行同源性分析,选取同源性较高的区域,利用PrimerPlex 2软件设计多重直接PCR引物(表1)。
1.2.2 多重直接PCR条件反应优化 对实验菌株进行DNA提取,设置不同的退火温度和模板浓度,PCR反应结束后进行琼脂糖凝胶电泳,寻找最适的反应条件。然后确定多重直接PCR反应条件。
1.2.3 特异性扩增检测 根据1.2.2的反应体系及优化的反应条件,分别以大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌、小肠耶尔森氏菌、志贺氏菌、空弯菌和肠球菌为模板进行多重直接PCR验证。对引物进行特异性扩增。

表1 多重直接PCR引物序列和扩增长度Tab.1 Sequences and amplification length of multi-plex direct PCR primers
1.2.4 最低检出限量检测 将大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌和小肠耶尔森氏菌分别调至108CFU,依次十倍稀释至103、102、101、100CFU。分别以103、102、101、100CFU菌液为模板,进行多重直接PCR扩增,对引物进行最低检出限量检测。
1.2.5 多重直接PCR应用于临床采集猪肉样本检测 在A市10个超市采集60份猪肉样本,用匀浆机破碎,取破碎组织液5 μL为模板,利用直接PCR试剂盒进行直接PCR方法的临床检测。同时利用细菌培养法对5种食源性致病菌进行分离鉴定,并与多重直接PCR检测方法结果相比较。计算检测的敏感性、准确性,以及阳性预测值(敏感性=真阳性值/(真阳性值+假阴性值)×100%;准确性=(真阳性值+真阴性值)/总数×100%;阳性预测值=真阳性值/(真阳性值+假阳性值)×100%)。
1.2.6 细菌分离培养法
1)大肠杆菌:将样品按照GB 4789.3-2010《食品安全国家标准 食品微生物学检验》进行分离鉴定。
2)沙门氏菌:将样品按照GB 4789.4-2010《食品安全国家标准 食品微生物学检验》进行分离鉴定。
3)金黄色葡萄球菌:将样品按照GB 4789.10-2010《食品安全国家标准 食品微生物学检验》进行分离鉴定。
4)单增李斯特氏菌:将样品按照GB 4789.30-2010《食品安全国家标准 食品微生物学检验》进行分离鉴定。
5)小肠结肠炎耶尔森菌:将样品按照 GB/T 4789.8-2008《食品安全国家标准 食品微生物学检验》进行分离鉴定。
2 结 果
2.1 多重直接PCR反应条件的优化 多重直接PCR反应体系:Buffer:12.5 μL;模板DNA:5 μL;25 μmol/L上、下游引物5 μL(5对引物各1 μL);MightyAmp○RDNA Polymerase Ver.2酶1 μL;用无菌超纯水补充至体积为25 μL。
多重直接PCR反应条件:98 ℃预变性2 min,98 ℃变性10 s,60 ℃退火15 s,68 ℃延伸1 min,共30个循环,最后68 ℃延伸10 min,4 ℃保存。
2.2 特异性扩增检测 分别以大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌、小肠耶尔森氏菌、志贺氏菌、空弯菌和肠球菌为模板用混合的多重引物与其进行多重直接PCR扩增,观察各对引物的特异性。电泳结果显示在大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌、小肠耶尔森氏菌为模板的甬道处出现明显的目的条带,且与其目的基因片段大小一致,而在志贺氏菌、空弯菌、肠球菌泳道处没有出现任何条带,说明特异性的扩增出了目的基因(图1)。根据摸索出最佳的多重直接PCR反应条件,进行验证,电泳结果显示出在泳道内出现5条明亮且单一的条带,片段大小与目的基因片段大小一致(图2)。
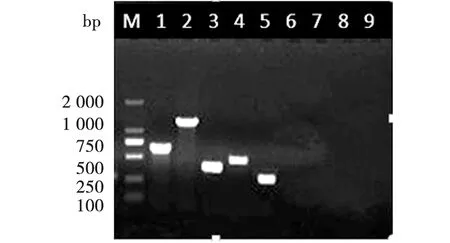
M:Marker DL2000;1:大肠杆菌;2:沙门氏菌;3:金黄色葡萄球菌;4:李斯特菌;5:小肠耶尔森氏菌;6:阴性对照;7:志贺菌模板;8:空弯菌模板:9:肠球菌M: Marker DL 2000; 1: E.coli; 2: Salmonella; 3: Staphylococcus aureus; 4: Listeria;5: Yersinia enterocolits; 6: negative control; 7: Shigella; 8: Campylobacter jejuni: 9: Enterococcus图1 多重直接PCR扩增常见食源性致病菌的特异性检测Fig.1 The specificity of multi-plex direct PCR for amplification of common food-borne pathogens
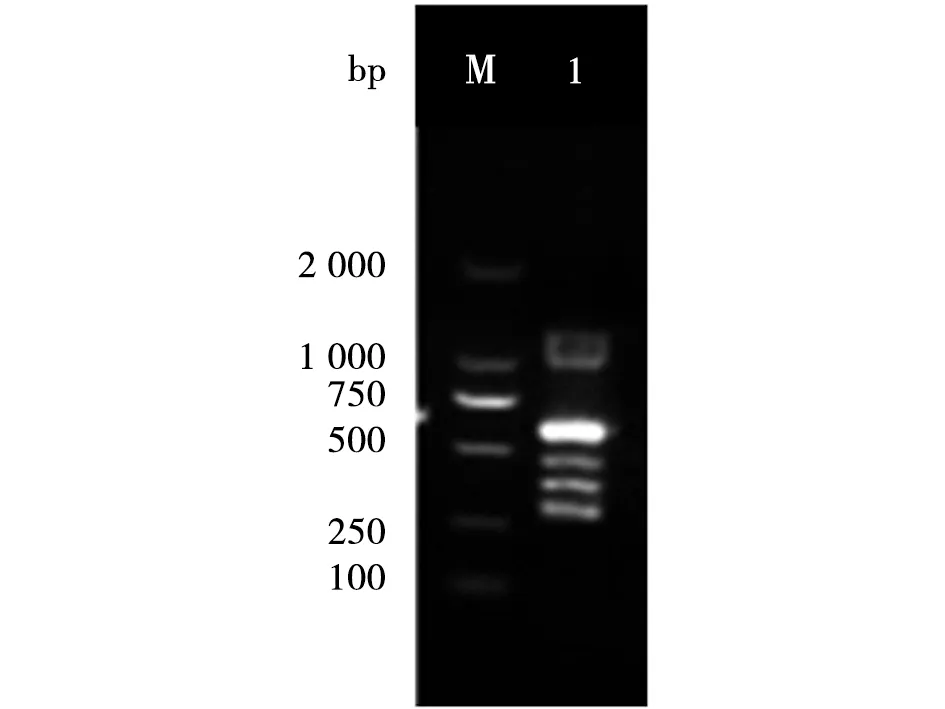
M:Marker DL2000;1:大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌、小肠耶尔森氏菌混合模板M: Marker DL 2000; 1: Mixing template for 5 kinds of bacteria图2 多重直接PCR同时检测5种食源性致病菌的扩增结果Fig.2 Simultaneous detection of five food-borne pathogens using multi-plex direct PCR
2.3 最低检出限量检测 分别以5种病原菌的103、102、101、100CFU菌液为模板,用引物与其进行多重直接PCR扩增,测定最低检出限量。电泳结果显示出,大肠杆菌的最低检出限量为10 CFU,金黄色葡萄球菌的最低检出限量为100 CFU,沙门氏菌、李斯特菌、小肠耶尔森氏菌的最低检出限量可达1 CFU(图3)。
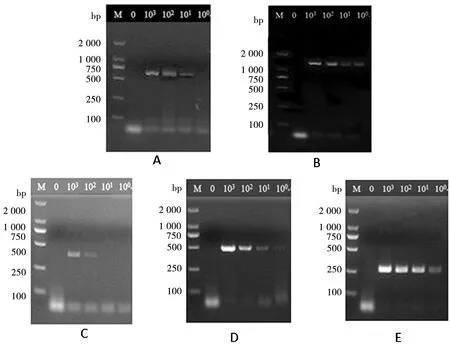
M:Marker 2000;A:大肠杆菌;B:沙门氏菌;C:金黄色葡萄球菌;D:李斯特菌;E:小肠耶尔森氏菌103 cfu、102 cfu、101 cfu、100 cfu多重直接PCR结果M: Marker DL 2000; A~E: Multiple PCR results of five bacteria图3 多重直接PCR对5种食源性致病菌最低检出限量检测Fig.3 Minimal detectable limit of multi-plex direct PCR for five food-borne pathogens
2.4 多重直接PCR应用于临床采集猪肉样本检测
采集的60份临床猪肉样本,同时进行细菌分离培养方法和多重直接PCR方法检测,并以细菌分离培养方法结果为标准(图4)。根据2种方法的检测结果进行统计学分析,计算出多重直接PCR方法对5种病原菌检测的敏感性、准确性,以及阳性预测值(表2)。并对结果进行分析。

图4 多重直接PCR法、细菌培养法对猪肉样品的检测结果Fig.4 Results of multi-plex direct PCR and culture method for detection of pathogens in swine products
3 讨 论
大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌和小肠耶尔森氏菌均是引起食物污染、导致食物中毒的重要病原菌[13]。近年来人们对食品质量安全的关注度逐渐升高,其中肉类食用产品的安全尤为重要。由于肉类产品饲养环境较开放,易受到外界污染;生产加工环节较复杂、小厂房作业较多,所以食品质量难以保障。而且肉类产品食用范围较广,一旦引起食品安全事件,危害范围大、易引起民众恐慌、危害国家和人民切身利益和安全。所以如何快速准确的检测食品中存在的各种致病菌成为了越来越多人研究的重点。
目前,对于食源性病原菌的检测有多种方法,包括传统的细菌培养法、酶联免疫吸附法(ELISA)、免疫胶体金法等[14-15]。这些方法优点各异,但大部分方法都存在以下几个问题:1)操作繁琐、复杂,所需周期较长;2)每次只能检测一种致病菌,对临床上混合污染的情况不能通量快速检测;3)灵敏度一般,对于感染初期的食品阳性检出率差。基于以上3点,建立一种快速简便、特异性强、灵敏度高的可靠检测方法,对食品中常见致病原的临床快速诊断,具有重要意义。
随着分子生物学技术的发展,PCR方法由于其特异、快速、敏感的特点已经成为了临床上鉴定病原微生物、基因分型的重要方法[16]。但普通的PCR方法需要先用细菌培养方法特异性的培养目的菌,并对样本模板进行DNA提取后进行PCR检测。
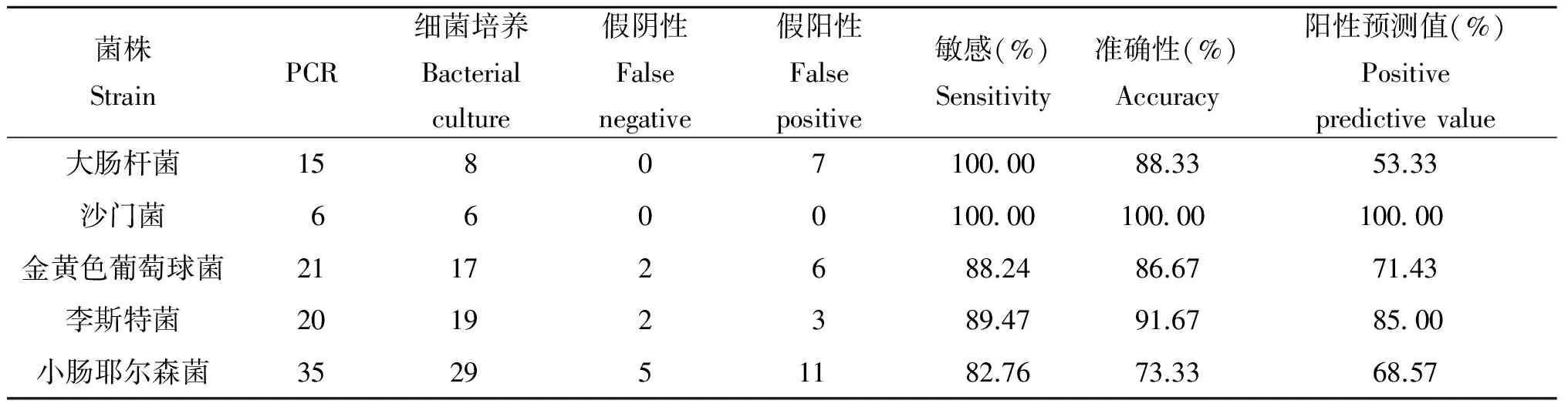
表2 多重直接PCR法、细菌培养法检测结果分析Tab.2 Analysis of the examination results of multi-plex direct PCR and culture method
这个过程耗时较长,也会造成样本的损失。所以本实验选用了在普通PCR技术基础上改进发展起来的多重直接PCR技术。与其他检测方法相比,多重直接PCR方法有以下2个优点:1)在同一体系中加入多对引物,扩增出多条目的基因条带,可一次性检出多种病原菌,与其他检测方法相比可以减少重复性工作,大大的提高检测效率;2)省去了样品前处理及提取DNA的繁琐步骤,使得检测更加快速,可在3 h内对原始样品完成检测,同时样品前处理的简化也降低了PCR模板的污染,降低了假阳性[17]。多重直接PCR采用 MightyAmp Buffer Ver.2独特的缓冲裂解液体系,可以直接裂解动物组织及其中的微生物并且在短时间内释放基因组DNA用于PCR扩增[18]。MightyAmp DNA Polymerase能直接以待测样品裂解液为模板,进行高效特异性扩增[19]。多重直接PCR方法不仅特异性强,又方便灵敏,节约了时间和成本,也减少了操作所带来的污染[19]。
通过本实验的结果可以看出,多重直接PCR方法对食品中常见的致病菌进行检测,目的条带明亮清晰且无杂带。大肠杆菌敏感性可达到10 CFU,金黄色葡萄球菌敏感性可达到100 CFU,沙门氏菌、李斯特菌、小肠耶尔森氏菌敏感性均可达到1 CFU。这个结果比王慧[20]、刘继超[21]、许一平[22]等人用的多重PCR、免疫胶体金技术等的敏感性要好。与姜侃等[23]人用三重LAMP法检测食品中的常见致病菌的敏感性相一致。这说明多重直接PCR方法的特异性强,敏感性高,可以满足临床上对食源性病原菌的快速诊断。而通过多重直接PCR方法与细菌培养法相对比的结果可以看出,多重直接PCR法的阳性检出率比培养法要高,敏感性、准确性都在80%~100%之间,在不经过样品前处理和提取DNA的前提下,多重直接PCR方法比培养法更敏感,可以检测出样品中含有的微量病原菌。
综上所述,多重直接PCR法是实验室检测食源性致病菌的一项实用性的新技术,且具有操作简单、耗时较短、准确性较高的优点[21],同时也为食品中病原菌的风险评估和流行病学调查提供了可靠方法。
[1] Gao YS, Yang F, Wang KM. Analysis of the detection results of pathogens for bacterial foodborne illnesses between 2007 and 2014[J]. Modern Preventive Medicine, 2015,44(22):4074-4076.(in Chinese)
高亚色,杨帆,王坤明. 2007-2014年细菌性食源性疾病病原菌检测结果分析[J]. 现代预防医学,2015,44(22):4074-4076.
[2] Majowicz SE, Musto J, Scallan E, et al. The global burden of nontyphoidalSalmonellagastroenteritis[J]. Clin Infect Dis, 2010, 50(6): 882-889.
[3] Li JY, Zhao Z, Jia XC, et al. Advance on detection of foodborne pathogenic bacteria[J]. Food Res Development, 2013,34(18):110-115.(in Chinese)
栗建永, 赵琢, 贾晓川,等. 食源性致病菌检测分析技术的研究进展[J]. 食品研究与开发, 2013, 34(18):110-115.
[4] Sanaa M, Coroller L, Cerf O. Risk assessment of listeriosis linked to the consumption of two soft cheeses made from raw milk: Camembert of Normandy and Brie of Meaux[J]. Risk Anal, 2004, 24(2): 389-399.
[5] Schaffner E, Muhlemann M, Spahr U, et al. Quantification of the probability of milk contamination byListeriamonocytogenesduring manufacture of hard cheese[J]. Revue d’epidemiologie et de sante publique, 2003, 51(5): 493-503.
[6] Lindqvist R, Sylven S, Vagsholm I. Quantitative microbial risk assessment exemplified byStaphylococcusaureusin unripened cheese made from raw milk[J]. Intl J Food Microbiol, 2002, 78(1-2): 155-170.
[7] Heidinger JC, Winter CK, Cullor JS. Quantitative microbial risk assessment forStaphylococcusaureusandStaphylococcusenterotoxinA in raw milk[J]. J Food Protection, 2009, 72(8): 1641-1653.
[8] Lee H, Kim K, Choi KH, et al. Quantitative microbial risk assessment forStaphylococcusaureusin natural and processed cheese in Korea[J]. J Dairy Sci, 2015, 98(9): 5931-5945.
[9] Song LP, Jiang J, Li W, et al. Research progress on rapid detection of foodborne bacterial pathogens[J]. Food Sci, 2015, 33(21):332-339.(in Chinese)
宋丽萍, 姜洁, 李玮,等. 食源性致病菌快速检测技术研究进展[J]. 食品安全质量检测学报, 2015(9):3441-3446.
[10] Huang Y, Hui Z, Chen X, et al. A multicolor time-resolved fluorescence aptasensor for the simultaneous detection of multiplexStaphylococcusaureus, enterotoxins in the milk[J]. Biosensors Bioelectronics, 2015, 74: 170-176.
[11] Mei MZ, Yan YX, Lu CP, et al. Rapid detection ofE.coliO157 by the multiplex PCR[J]. Chin J Zoonoses, 2007(4):351-354.(in Chinese)
梅明珠,严亚贤,陆承平,等. 多重PCR快速鉴定大肠杆菌O157[J]. 中国人兽共患病学报,2007,(04):351-354.
[12] Zhang GG, Lai WH. Research progress of immunological detection methods of foodborne pathogen[J]. J Food Safety Quality, 2015,9:3414-3419.(in Chinese)
章钢刚,赖卫华. 食源性致病菌免疫学检测方法研究进展[J]. 食品安全质量检测学报,2015,09:3414-3419.
[13] Zheng MQ, Jin DZ, Liu QQ, et al. Study on detection of food-borne pathogenic bacterias by the multiplex PCR[J]. J Prac Med Techniq, 2007.
[14] Li XJ, Xu BH, Tian HF, et al. Accurate detection of Staphylococcus aureus based on PCR assay[J]. Chin J Zoonoses, 2009, 25(05):442-445.(in Chinese)
李秀娟, 徐保红, 田会方,等. 基于PCR的金葡菌准确检测方法的建立及应用[J]. 中国人兽共患病学报, 2009, 25(5):442-445.
[15] Hou JJ, Zhu JG, Hua XG, et al. PCR assay for the detection ofCampylobacterjejuniin animal organs and animal products[J]. Chin J Zoonoses, 2008,24(2):128-131.(in Chinese)
侯建军, 朱建国, 华修国,等. 动物及其产品中空肠弯曲菌PCR检测方法的建立[J]. 中国人兽共患病学报, 2008, 24(2):128-131.
[16] Chao GX, Qin XU, Zhou XH, et al. Rapid detection ofListeriamonocytogenes by PCR[J]. Chin J Zoonoses, 2004,20(9):797-800.(in Chinese)
巢国祥, 徐勤, 周晓辉,等. 单核细胞增生性李斯特菌PCR快速检测方法建立及应用[J]. 中国人兽共患病学报, 2004, 20(9):797-800.
[17] Ma BC, Qin ZM, Cai YM, et al. Development of mutiplex PCR forSimultaneousdetection ofStaphycococcusaureus,Streptococcusagalactiae,Streptococcusdysgalactiae andYeastsin bovine mastitis milk samples[J]. Acta Veterinaria Et Zootechnica Sinica, 2006, 37(11):1202-1208.(in Chinese)
马保臣, 秦卓明,蔡玉梅,等. 多重PCR检测奶牛乳腺炎金黄色葡萄球菌、无乳链球菌、停乳链球菌和酵母菌方法的建立与应用[J]. 畜牧兽医学报,2006,37(11):1202-1208.
[18] Zhao G, Zhai H, Yuan Q, et al. Rapid and sensitive diagnosis of fungal keratitis with direct PCR without template DNA extraction[J]. Clin Microbiol Infect, 2014, 20(10): 776-782.
[19] Cruz MLDL, Pérez A, Domínguez M, et al. Assessment of the sensitivity and specificity of serological(IFAT) and molecular (direct-PCR) techniques for diagnosis of leishmaniasis in lagomorphs using a Bayesian approach[J]. Vet Med Sci, 2016,2(3):211-220.
[20] Wang H, Zhu RL, Tan YL, et al. Establishment and application of multiple PCR for diagnosing proteus mirabilis,SalmonellaandListeriamonocytogenes[J]. Scientia Agricultura Sinica, 2011, 44(11):2334-2340.(in Chinese)
王慧, 朱瑞良, 谭燕玲,等. 多重PCR检测三种重要食源性致病菌方法的建立及应用[J]. 国农业科学, 2011, 44(11):2334-2340.
[21] Liu JC,Jiang TM,Chen LJ,et al.Study on the detection ofSalmonella,StreptococcusagalactiaeandStaphylococcusaureusin raw milk by multiplex PCR[J]. Chin Food Acta,2010,10(6):173-179.(in Chinese)
刘继超, 姜铁民, 陈历俊,等. 多重PCR检测原料乳中沙门氏菌、无乳链球菌和金黄色葡萄球菌的研究[J]. 中国食品学报, 2010, 10(6):173-179.
[22] Xu YP, Cheng W, Shao YC, et al. Detection ofSalmonellaspp.EscherichiacoliandStaphylococcusaureusby multinlex PCR[J]. Microbiology, 2006, 33(6):89-94.(in Chinese)
许一平,成炜,邵彦春,等. 多重PCR检测沙门菌、大肠杆菌和金黄色葡萄球菌的研究[D]. 华中农业大学,2006,33(6):89-94.
[23] Jiang K, Lv QF, Wang X, et al. Development of multiplex LAMP method for the detection ofSalmonellaspp.StaphylococcusaureusandListeriamonocytogenes in foods[J]. Food Sci, 2013, 34(24):182-187.(in Chinese)
姜侃, 吕沁风, 汪新,等. 三重LAMP法检测食品中沙门氏菌、单增李斯特菌和金黄色葡球菌[J]. 食品科学, 2013, 34(24):182-187.
EstablishmentandapplicationofmultiplexdirectPCRforrapiddetectionofcommonfoodbornepathogensinswineproducts
SONG Xue1,2, ZHAO Ge1, WANG Juan1, HUANG Xiu-mei1, GAI Wen-yan1, ZHAO Jian-mei1, QU Zhi-na1, LI Yue-hua1, ZHANG Lin-bo2, WANG Jun-wei1
(1.DepartmentforSafetySupervisionofAnimalProducts,ChinaAnimalHealthandEpidemiologyCenter/LaboratoryofQualityandSafetyRiskAssessmentforLivestockandPoultryproducts(Qingdao),MinistryofAgriculture,Qingdao266032,China; 2.CollegeofLifeScience,JilinAgriculturalUniversity,Changchun130118,China)
We established a multiplex direct PCR for rapid detection ofE.coli,Salmonella,Staphylococcusaureus,ListeriaandYersiniaenterocoliticabacteria. Multiplex direct PCR primers were designed according to gene sequences ofphoA (E.coli),invA (Salmonella),nuc(S.aureus),hly(Listeria), andail(Y.enterocolitica). After the multiplex direct PCR were established, the specificity and sensitivity of primers were detected. Then, multiplex direct PCR was applied to examine 60 swine product samples, the detection specificity, accuracy and positive predictive value were calculated compared with the gold standard culture method. Results showed that multiplex direct PCR primers could be used for specific detection ofE.coli,Salmonella,S.aureus,ListeriaandY.enterocolitica, with the minimal detectable limit of 10, 1, 100, 1 and 1 CFU, respectively. For the examination of 60 swine product samples using multiplex direct PCR, 15 were positive forE.coli, 6 positive forSalmonella, 21 positive forS.aureus, 20 positive forListeria, and 35 positive forY.enterocolitica, with all positive detection rates higher than that of culture. The total detection sensitivity was 100%, accuracy was 94%, and positive predictive value was 81.44%. Multiplex direct PCR could be used for specific and sensitive detection of common food-borne pathogens, and the testing time was shorten to be 3 hours because of saving time for template extraction. Multiplex direct PCR might serve the detection of food-borne pathogens in food safety risk monitoring much better.
multiplex direct PCR; food-borne pathogens; rapid; sensitive
s: Wang Jun-wei, Email:yffs2000@sina.com
10.3969/j.issn.1002-2694.2017.08.009
农业部“国家农产品质量安全风险评估重大专项”(No.GJFP 2016007)资助、留学人员科技活动项目择优资助
王君玮,Email:yffs2000@sina.com
1.中国动物卫生与流行病学中心 农业部畜禽产品质量安全风险评估实验室(青岛),青岛 266032; 2.吉林农业大学生命科学学院,长春 130118
Supported by the Risk Assessment Major Project of National Agricultural Product Quality Safety, MOA(No.GJFP2016007) and the Technology Foundation for Selected Overseas Chinese Scholar, MOP, China
R378
:A
:1002-2694(2017)08-0710-06
2016-11-24编辑:李友松
