沙门菌基质辅助激光解吸电离飞行时间质谱方法研究
2017-09-03赵剑虹李书明张士尧王恒伟韩庆华
赵剑虹,高 艳,李书明,张士尧,王恒伟,顾 琳,韩庆华,焦 洋,陈 倩
沙门菌基质辅助激光解吸电离飞行时间质谱方法研究
赵剑虹1,高 艳1,李书明1,张士尧1,王恒伟1,顾 琳1,韩庆华1,焦 洋1,陈 倩2
目的优化基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)法对沙门菌鉴定的条件,研究不同前处理方法对MALDI靶板污染情况,建立安全高效的检测沙门菌的方法。方法应用MALDI-TOF-MS 法对4株沙门菌标准菌株进行不同培养条件、样品前处理方式检验,确立优化的鉴定程序,对不同处理方式下MALDI靶板进行检测,采用优化的前处理方法对33株腹泻病人粪便标本中分离的沙门菌进行数据采集和图谱比对,所得鉴定结果与常规血清学分型结果比较。结果不同前处理方法、不同的培养基上沙门菌标准菌株均准确鉴定为沙门菌。 33株沙门菌用MALDI-TOF-MS方法全部准确鉴定为沙门菌属,19株沙门菌在种的鉴定水平上与血清分型结果完全一致,14株沙门菌在种的鉴定水平上与血清分型结果不一致。不同前处理方法的MALDI靶板上均未发现细菌生长。结论MALDI-TOF-MS方法能快速、简便、安全、准确鉴定属水平沙门菌,是一种有效的沙门菌检测鉴定的手段。
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS);沙门菌;鉴定
沙门菌(Salmonella)种类繁多且结构复杂,现已发现超过2 500个沙门菌血清型,我国已发现血清型超过290个。沙门菌是常见的肠道致病菌之一,不仅可以引起家禽及动物发生感染,还能通过污染的食物导致人的食物中毒。在世界各国的各类细菌性食物中毒中,沙门菌引起的食物中毒常居榜首;我国内陆地区以沙门菌为首位[1]。因此,建立一种快速而准确的沙门菌检测鉴定及分型方法具有重要意义。
目前,沙门菌的检测和分型方法很多,主要包括传统生化实验、血清学分型、脉冲场凝胶电泳 (Pulsed Field Gel Electrophoresis,PFGE)分型和耐药谱分型等。以细菌表面蛋白为检测对象的基质辅助激光解吸飞行时间质谱(Matrix-assisted laser desorption ionization-time of light mass spectrometry,MALDI-TOF-MS)是近年来发展起来的一种新的微生物检测技术,它是通过检测未知微生物的蛋白质指纹图谱并与质谱图数据库中特征性谱图进行对比,从而对待测微生物进行快速鉴定[2]。它所具有的灵敏、准确、自动化以及高通量等优势弥补了传统检测鉴定方法的缺陷,对致病菌的检测与鉴定、分型及溯源有十分重要的意义。目前MALDI-TOF MS技术已经成为商业的微生物鉴定技术[3],但不同的培养基和样品的前处理方式会影响MADLI—TOF MS鉴定细菌的结果[4-5]。本研究通过采用MALDI-TOF-MS对4株沙门菌标准菌株在不同培养基和不同前处理方式下进行鉴定,并对结果进行分析,寻找简便、准确的鉴定方式,并将血清学分型和MALDI-TOF-MS分型方法进行比较,探讨分型方法的可比性。
MALDI-TOF-MS在微生物鉴定领域应用时间较短,对于MADLI靶板在使用过程中是否会污染外环境国内尚未见报道,本研究对沙门菌鉴定的靶板进行细菌培养,初步探讨该技术方法的安全性。
1 材料与方法
1.1 菌株 4株沙门菌标准菌株(鼠伤寒沙门菌CMCC50013、乙型副伤寒沙门菌CMCC50004、伤寒沙门菌CMCC50071和鼠伤寒沙门菌ATCC14028)购置于中国工业菌种保藏中心、33株北京市朝阳区腹泻病人粪便中分离的沙门菌。
1.2 培养基 营养琼脂培养基、XLD培养基、SS培养基、麦康凯培养基、哥伦比亚血琼脂培养基(成品),赛默飞世尔生物化学制品(北京)有限公司;沙门菌增菌液;沙门诱导培养基,北京陆桥技术有限公司。
1.3MALDI-TOF-MS基质和溶液系统 甲酸(formic acid,FA),Sigma,Germany;乙醇,Sigma,USA;三氟乙酸(trifluoracetic acid,TFA),Sigma,Germany;乙腈(acetonitrile,CAN),Dikmapure,USA;去离子水:通过Milipore过滤;基质2-氰基-4-羟基肉桂酸( α-cyano-4-hydroxycinnamic acid,HCCA)、标准品和标准溶剂(德国布鲁克公司)。(BrukerDaltonics);沙门菌A~F多价、O、H血清(Statens serum institut,Danmark和宁波天润生物药业有限公司);BD鉴定卡(Becton,Dickinson and Company)。
1.4 仪器 基质辅助激光解吸电离飞行时间质谱(MicroflexTMMALDI-TOF)和配套分析软件(德国布鲁克公司),仪器参数为:氮气激光光源,线性正离子(LP-BioTyper)采样模式,质量范围2 000-20 000 D,激光随机机打40/次,打5个点,激光频率为60 Hz,每次实验前用校准品进行质量校正;全自动细菌生化鉴定仪(PhoenixTM100)(美国BD公司)。
1.5 菌株鉴定 33株受试菌株均按照《感染性腹泻诊断标准WS271—2007》和《伤寒、副伤寒诊断标准及处理原则WS280—2008》中的检测方法进行生化反应和血清学检测鉴定为沙门菌。
1.6 鉴定条件的优化
1.6.1 前处理条件的选择
1.6.1.1 甲酸提取法:参考文献[6]样本制备的方法进行MALDI-TOF MS检测。
1.6.1.2 直接转移法:参考文献[7]对沙门菌鉴定的方法进行MALDI-TOF MS检测。
1.6.1.3 加热提取法:向EP管中加入300 μL去离子水,取4株沙门菌标准菌株单一菌落至离心管中,充分混匀,在沸水浴中加热 30 min,13 000 r/min离心2 min,弃上清。取沉淀均匀涂在靶板上,干燥后,在上述样品上覆盖1 μL HCCA基质溶液,晾干后进行检测。
1.6.1.4 乙醇提取法 向EP管中加入300 μL75%乙醇,取4株沙门菌标准菌株单一菌落至离心管中,充分混匀,反应 30 min后13 000 r/min离心2 min,弃上清。取沉淀均匀涂在靶板上,干燥后,在上述样品上覆盖1 μLHCCA基质溶液,晾干后进行检测。
1.6.2 MALDI靶板污染情况比较 实验完成后,将甲酸提取法、直接转移法、加热灭菌提取法、乙醇灭菌提取法点在MALDI靶板上的靶点用1 μL 生理盐水溶解后,分别接种营养琼脂和血平板,放置于37 ℃恒温培养箱中培养48 h,观察有无菌落生长,并进行分纯鉴定。
1.6.3 培养基的选择 将4株沙门菌标准菌株复苏后分别接种营养琼脂培养基、哥伦比亚血琼脂培养基、XLD培养基、SS培养基、麦康凯培养基37 ℃培养18~24 h,用甲酸提取法上样,每种菌株上3个靶点,MALDI-TOF-MS对每个靶点进行5次鉴定和图谱匹配性分析,重复实验3次,得到每个标准菌株的平均匹配分数。
1.7 菌株的鉴定 将33株北京市朝阳区腹泻病患者粪便中分离的沙门菌菌株接种营养琼脂培养基于37 ℃培养18~24 h,用直接转移法进行质谱鉴定。
2 结 果
2.1 条件优化的结果
2.1.1 前处理方法
2.1.1.1 匹配分值 采用甲酸处理法、直接转移法、加热提取法和乙醇提取法鉴定沙门菌的匹配分值均>2.0,说明可以保守鉴定到菌属,其中甲酸提取法和直接转移法的分值均>2.3,说明鉴定到菌种的可信度高,见表1。
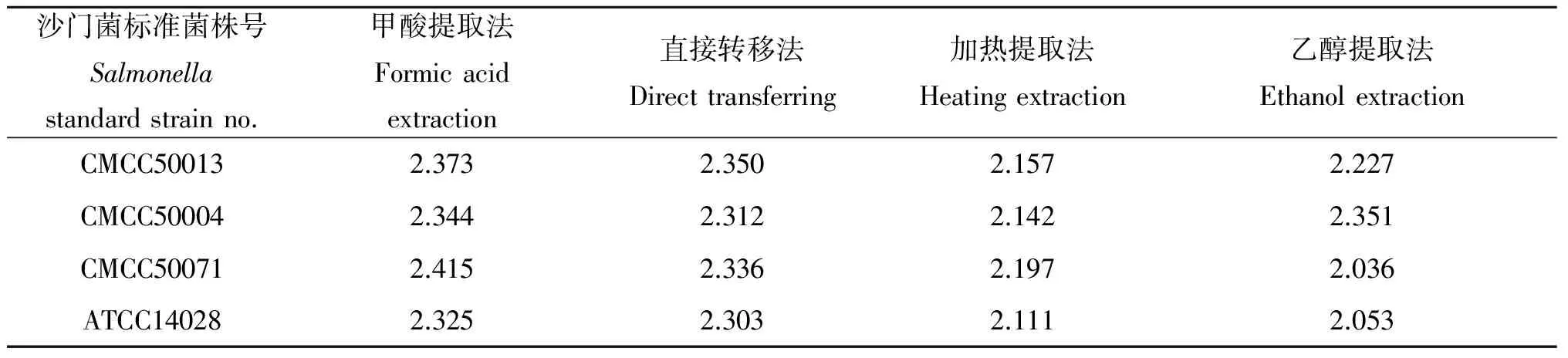
表1 不同前处理方式的鉴定分值Tab.1 Identification score value of different sample preparation methods
2.1.1.2 质谱图质量 比较甲酸提取法、直接转移法、加热提取法和乙醇提取法这4种方法的图谱发现峰形基本一致,但甲酸处理法的图谱基线平稳,杂峰相对较少(见图1)。
2.1.2 培养基的选择 5种培养基上培养的沙门菌在MALDI-TOF-MS检测的匹配分值均>2.0说明可以保守鉴定到菌属,其中营养琼脂和XLD培养基上的各标准菌株在 MALDI-TOF-MS上的匹配分数在>2.300,说明可准确鉴定到种。具体数值见表2。结果表明:不同培养基上的沙门菌的指纹图谱峰值强度有所差别,但是所获取的图谱均可以得到正确的鉴定结果。
2.2 沙门菌分离株鉴定结果 33株沙门菌均能鉴定到种属水平。MALD-TOF-MS鉴定结果型别与血清型结果比较结果见表3。33株不同血清型的沙门菌中,用MALDI-TOF-MS鉴定结果为:19株鉴定结果与血清凝集结果一致,14株鉴定结果与血清凝集结果不一致。
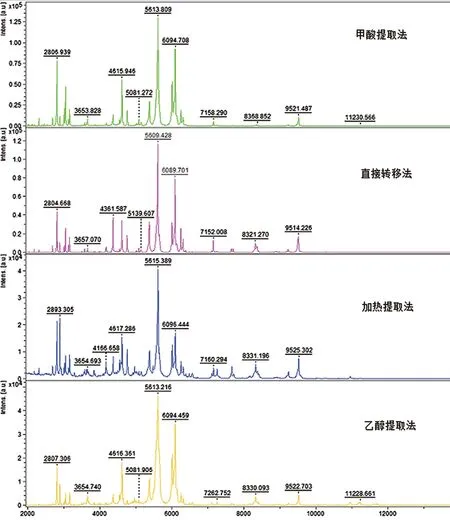
图1 不同处理方法的质谱图比较Fig.1 Mass spectra comparing of different pretreatment methods
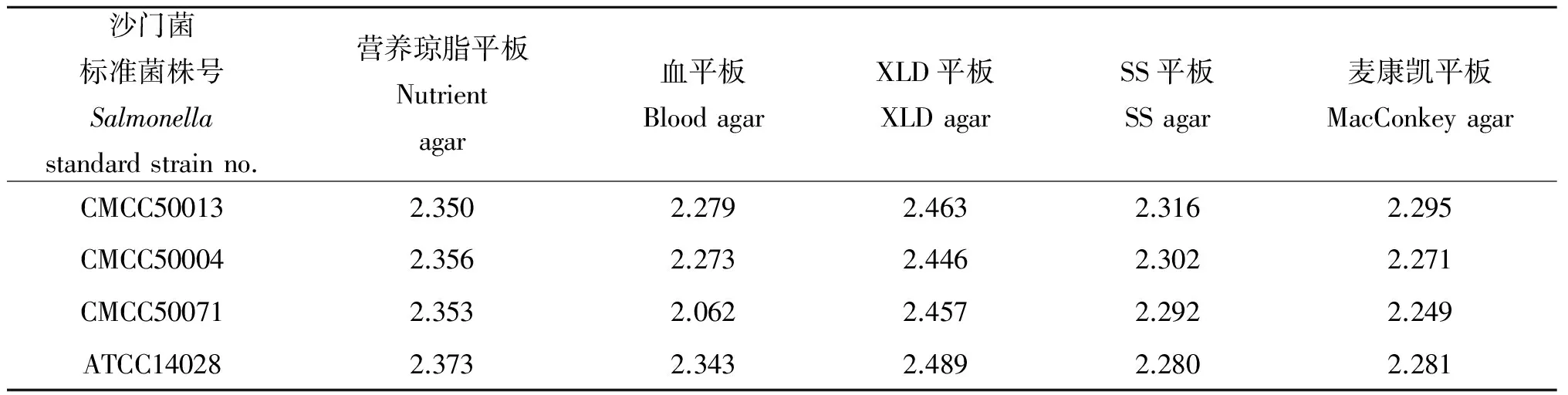
表2 5种培养基上的菌株鉴定分值Tab.2 Identification score value in 5 kinds of culture medium
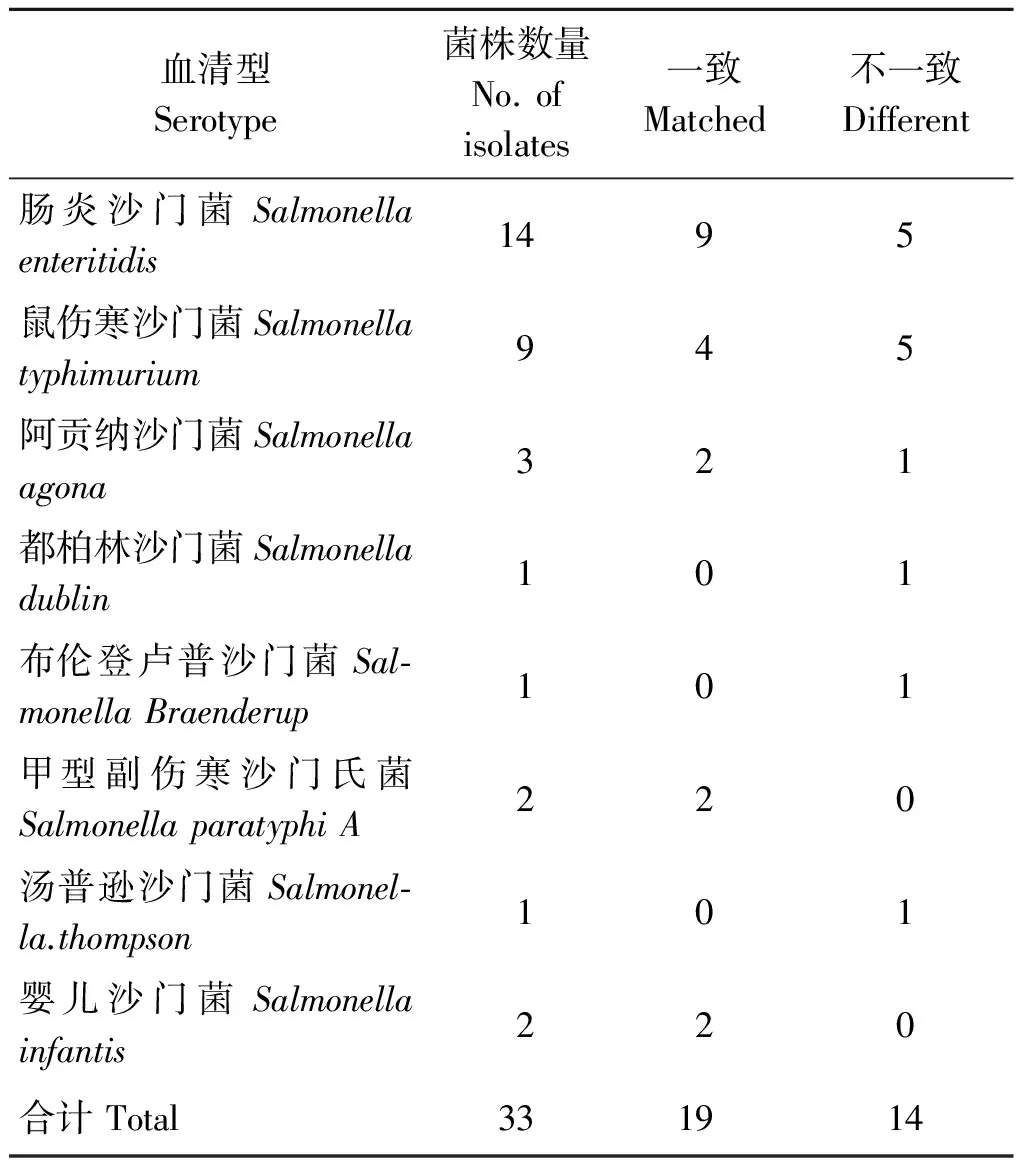
表3 沙门菌MALDI-TOF-MS鉴定结果与菌株的血清型结果比较Tab.3 Comparison of MALDI-TOF-MS and the serotype of Salmonella strains
3 讨 论
MALDI-TOF-MS法作为一种快速鉴定微生物的方法得到广泛应用[8],本文针对多种样本前处理方法和5种常用培养基培养的沙门菌采用MALDI-TOF-MS进行检测鉴定,得到的结果与梁达炜等[7]研究结果基本一致,说明MALDI-TOF-MS可直接使用选择性平板上沙门菌进行鉴定,节省了检测时间。
通过对不同血清型沙门菌的分析,本文研究结果表明使用MALDI-TOF-MS法进行沙门菌血清分型鉴定与常规血清学凝集分型方法具有一定的相关性,但不能达到完全一致,与郑秋月等[9]研究的结果一致,其主要原因其一是二者原理有所差异:常规血清学检测是针对细菌细胞膜表面的抗原蛋白,而MALDI-TOF-MS检测则针对的是细菌体内所有的生物大分子,包括核糖体蛋白等。其二与MALDI-TOF数据库容量有关,提示继续补充沙门菌鉴定数据库,对菌株进行溯源分析,进一步分析不同来源的沙门菌对MALDI-TOF-MS检测分型的影响因素[10],以及不同耐药谱对MALDI-TOF-MS的鉴定分型的影响[11]是今后的研究方向。
国内尚没有文献报道MALDI-TOF-MS样品前处理方法对MALDI靶板污染情况,使该方法的应用存在一定生物安全隐患,本文初步探讨了沙门菌不同前处理方法对MALDI靶板污染,说明使用不同的常规前处理方法均不会导致MALDI靶板污染,但因各种细菌对外界抵抗力的不同,其他非沙门菌是否会造成MALDI靶板污染尚需进一步研究。
[1] Zhu Q,Lu BX,Tan YQ,et al. Research progress on biologicalSalmonellaenteric[J]. J Dis Monitor Control,2015,9(7):474-478.(in Chinese)
朱奇,陆斌兴,覃有泉,等.沙门氏菌生物学研究进展[J]. 疾病监测与控制,2015,9(7):474-478.
[2] Wieser A, Schneider L, Jung J, et al. MALDI-TOF MS in microbiological diagnostics-identification of microorganisms and beyond (mini review)[J]. Appl Microbiol Biotechnol, 2012, 93(3): 965-974.DOI: 10.1007/s00253-011-3783-4
[3] Wu A,Zhang LJ. Application of mass spectrometry technology in the diagnosis of pathogenic microorganism[J]. Chin J Zoonoses,2016,32(9): 838-842,849. DOI:10 3969/j.issn.1002—2694.2016.09014 (in Chinese)
吴傲,张丽军.质谱技术在病原微生物诊断中的应用[J].中国人兽共患病学报,2016,32(9): 838-842,849.
[4] Valentine N, Wunschel S, Wunschel D, et al. Effect of culture conditions on microorganism identification by matrix-assisted laser desorption ionization mass spectrometry[J]. Appl Environ Microbiol, 2005, 71(1): 58-64. DOI: 10.1128/AEM.71.1.58-64.2005
[5] Martiny D, Visscher A, Catry B, et al. Optimization ofCampy-lobactergrowth conditions for further identification by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF MS)[J]. J Micro Methods, 2013, 94(3): 221-223. DOI: 10.1016/j.mimet.2013.06.018
[6] Hu X,Lin XH,Tong W,et al. Study on establishment of mass spectrometry database ofSalmonellaspecies by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. J Hygiene Res, 2014,43(1):40-46. (in Chineses)
胡骁,林肖惠,佟巍,等.沙门菌MALDI-TOF-MS 标准菌库的建立及应用研究[J]. 卫生研究,2014,43(1):40-46.
[7] Liang DW,Liang QH,Fang YP,et al. Rapid identification onSalmonellaisolated from clinical specimens by matrix-assisted laser desorption ionization time of flight mass spectrometry[J]. Chin J Zoonoses, 2016,32 (7):600-603. DOl:10.3969/j.issn.1002—2694.2016.07.002(in Chinese)
梁达炜,梁权辉,方艳平,等.基质辅助激光解析电离飞行时间质谱快速鉴定沙门菌临床分离株[J]. 中国人兽共患病学报, 2016,32 (7):600-603.
[8] Sauer S, Kliem M. Mass spectrometry tools for the classification and identification of bacteria[J]. Nat Rev Microbiol, 2010, 8(1): 74-82. DOI: 10.1038/nrmicro2243
[9] Zheng QY,Zhan XW,Xiao SS,et al. Establishment of MALDI-TOF-MS typing forSalmonella[J]. Chin J Public Health, 2014, 30(10): 1344-1347. DOI:10.11847/zgggws2014-30-10-0(in Chinese)
郑秋月,战晓薇,肖珊珊,等.沙门氏菌MALDI-TOF-MS分型方法建立[J].中国公共卫生,2014,30(10):1344-1347.
[10] Carbonnelle E, Grohs P, Jacquier H, et al. Robustness of two MALDI-TOF mass spectrometry systems for bacterial identification[J]. J Microbiol Methods, 2012, 89(2): 133-136.DOI: 10.1016/j.mimet.2012.03.003
[11] Wolters M, Rohde H, Maier T. MALDI-TOF MS fingerprinting allows for discrimination of major methicillin-resistantStaphylococcusaureuslineages[J]. Int J Med Microbiol, 2011, 301(1): 64-68.DOI: 10.1016/j.ijmm.2010.06.002
DetectingSalmonellawithmatrixassistedlaserdesorptionionizationtimeofflightmassspectrometry
ZHAO Jian-hong1, GAO Yan1, LI Shu-ming1, ZHANG Shi-yao1, WANG Heng-wei1, GU Lin1, HAN Qing-hua1, JIAO Yang1, CHEN Qian2
(1.ChaoyangCenterforDiseaseControlandPrevention,Beijing100021,China;2.BeijingCenterforDiseaseControlandPrevention,BeijingCenterforPreventiveMedicalResearch,Beijing100013,China)
In order to optimize the matrix-assisted laser desorption ionization time of flight mass spectrometry (MALDI-TOF-MS) method forSalmonellaidentification, study the target board pollution situation of different pretreatment methods, and establish a safe and effective method for detection ofSalmonella, we applied MALDI-TOF-MS technique to detect 4 standard strains ofSalmonellaunder different culture conditions and sample preparation method, and established optimization program. MALDI target board was detected under different preparation treatments. The optimization method was used to detect 33 strainsSalmonellawhich isolated from diarrhea patients’ stool. Identification results were compared with serological results. The study found that MALDI-TOF-MS method could accurate identify ofSalmonellain different pretreatment methods and culture medium. Thirty-three strains ofSalmonellaidentified by MALDI-TOF-MS method were all accurate appraisal in genus level, 19 strains of them were completely consistent with the serotyping identification results, 14 strains of them were not consistent with the serotyping identification results. There was no bacteria growth on the target board in different pretreatment methods. MALDI-TOF-MS method can in a fast,convenient,safe and accurate way identifySalmonella, and it can become an effective means for identification ofSalmonella.

10.3969/j.issn.1002-2694.2017.08.008
北京市开放基金(No.2015BZ0063-03)
陈 倩,Email:cchenqian@263.net
1.北京市朝阳区疾病预防控制中心,北京 100021; 2.北京市疾病预防控制中心,北京市预防医学研究中心,北京 100013
R378.2
:A
:1002-2694(2017)08-0705-05
2017-01-12编辑:梁小洁
