ARIP2在小鼠肝细胞中表达与调控的实验研究
2017-09-03林瑞新武家成由广强王铁龙杨淑莉
林瑞新,武家成,由广强,王铁龙,李 欢,杨淑莉
(吉林大学第二医院 1.肝胆胰外科;2.妇产科,吉林 长春130041)
ARIP2在小鼠肝细胞中表达与调控的实验研究
林瑞新1,武家成1,由广强1,王铁龙1,李 欢1,杨淑莉2*
(吉林大学第二医院 1.肝胆胰外科;2.妇产科,吉林 长春130041)
目的 探讨激活素受体相互作用蛋白2(ARIP2)在小鼠肝细胞中的表达与调控。方法 使用RT-PCR方法对ARIP2的mRNA转录水平及调控因素进行检测。结果 Activin A能够刺激小鼠肝细胞的ARIP2表达增加,其转录水平随作用时间的增加而升高;Activin A,PMA及LPS均对小鼠肝细胞ARIP2 mRNA的转录具有促进作用,而A23187对小鼠肝细胞ARIP2 mRNA的转录具有抑制作用;ARIP2的过表达对Activin A诱导的小鼠肝细胞的ActRⅡA mRNA的转录具有抑制作用,而对ActRⅡB mRNA的转录无影响。结论 ARIP2的表达受到Activin A,A23187,PMA及LPS等多种因素的影响,ARIP2通过对小鼠肝细胞ActRⅡA表达的影响,参加激活素作用信号传导的负反馈调控。
激活素受体相互作用蛋白2;小鼠肝细胞;表达;调控
(ChinJLabDiagn,2017,21:1422)
激活素(Activin)是一种具有多种功能的细胞因子,在肝癌组织中存在异常表达且对肝癌细胞增殖及转移有重要调节作用[1,2]。激活素受体相互作用蛋白2可通过调控激活素受体Ⅱ在膜上的表达量来调节激活素的信号,进而影响激活素对肝癌细胞的调节作用[3-5]。笔者通过对ARIPS2对肝癌细胞增殖的影响研究,进一步研究ARIPS2在肝组织及肝癌组织中的分布情况,阐明激活素受体相互作用蛋白2表达水平与肝癌发生相关性,以期为治疗肝癌提供新途径。现将研究结果总结报道如下。
1 材料与方法
1.1 细胞及质粒
小鼠肝细胞株取自中国科学院上海细胞库提供的小鼠肝癌细胞系(ATCC),使用含10%胎牛血清(FCS)的DMED培养基进行培养; 质粒选择购于Invitrogen公司的pcDNA3质粒和吉林大学基础医学院构建的pcDNA3-ARIP2质粒。
1.2 试剂
脂多糖(Lipopolysaccharide,LPS)、钙离子载体A23187、佛波酯(PMA)购于美国Sigma公司;AMV逆转录酶(AMV Reverse Transcriptase)购于美国Promega公司;EX Taq 酶购于日本TaKaRa公司;DMEM高糖培养基购于美国GIBCO公司; Trizol试剂和脂质体2000(Lipofectamine 2000)购于美国Invitrogen公司;激活素A(Activin A)购于以色列ProSpec-Tany公司。
1.3 方法
取对数生长期的、培养中的小鼠肝细胞,以每孔2×105个细胞的浓度接种于12孔培养板中,置于37℃的培养箱中过夜培养。
Activin A对小鼠肝细胞ARIP2 mRNA转录的影响。取出过夜培养的细胞一份,将培养液更换为含有2%浓度的FCS的DMEM培养基,并以5 ng/ml的浓度加入Activin A,分别于培养第4 h、8 h、12 h和24 h收取细胞,然后使用Trizol试剂进行总RNA的提取。使用RT-PCR方法对ARIP2的mRNA转录水平进行检测,内参选择GAPDH。
信号传导激动剂对小鼠肝细胞ARIP2 mRNA转录的影响。取出过夜培养的细胞一份,将培养液更换为含有2%浓度的FCS的DMEM培养基,并以5 ng/ml的浓度加入Activin A,200 nmol/L的浓度加入A23187,20 nmol/L的浓度加入PMA,2.5 μg/ml的浓度加LPS,对照选择单纯使用DMEM培养的细胞,在温度37℃、含5%CO2的培养箱中培养24 h,然后收集细胞,使用Trizol试剂进行总RNA的提取,使用RT-PCR方法对ARIP2的mRNA转录水平进行检测。
ARIP2过表达对小鼠肝细胞ActR mRNA转录的影响。取出过夜培养的细胞一份,首先使用不含FBS的DMEM培养液对细胞进行1次洗涤,然后按说明书的操作要求,使用Lipofectamine 2000进行转染,分别将0.3 μg的pcDNA3空质粒,0.3 μg的pcDNA3-ARIP2表达质粒,0.1 μg的pcDNA3-ARIP2+0.2 μg的pcDNA3转染至小鼠肝细胞中,并加入终浓度为5 ng/ml的Activin A,培养24 h,然后收集细胞,使用Trizol试剂进行总RNA的提取,使用RT-PCR方法对ActRⅡA和ActRⅡB的mRNA转录水平进行检测。
PCR条件设定为:循环前于95℃进行90s的预变性; 循环为94℃进行45s变性,54℃进行30 s退火,72℃延伸1 min,共循环30次;循环结束后再于72℃进行10 min的延伸。然后使用琼脂糖凝胶电泳对PCR扩增产物进行检测,并使用凝胶成像系统进行观察和扫描。使用的引物序列具体情况见表1。

表1 PCR扩增时所用的引物序列
2 结果
2.1 Activin A对小鼠肝细胞ARIP2 mRNA转录的影响
Activin A能够刺激小肝细胞的ARIP2表达增加,在作用早期,4 h时,ARIP2 mRNA的转录水平无变化,随后ARIP2 mRNA的转录水平随时间的增加而升高。见图1。
2.2 ARIP2过表达对小鼠肝细胞ActRⅡ mRNA转录的影响
ARIP2的过表达对Activin A诱导的小鼠肝细胞的ActRⅡA mRNA的转录具有抑制作用,而对ActRⅡB mRNA的转录无影响。见图2。
3 讨论
Activin具有促进垂体细胞分泌卵泡刺激素的作用,还可以作为分泌因子作用于多种细胞,对细胞的增殖、分化、凋亡、胚胎的发育等进行调控,同时还是炎症恢复和组织修复的调节因子,属于多功能的生长、分化因子[6-9]。
近年来,许多研究发现,Activin A在肝细胞的再生修复、肝纤维的形成中具有重要的作用,对肝细胞的生长具有明显的影响作用[10-12]。ARIP是一种激活素信息传导调控蛋白,组织特异性十分明显,是Activin组织特异性的决定因子,分为ARIP1和ARIP2两种。ARIP1主要存在于大脑组织中,而ARIP2则存在于多种组织当中,在肝细胞中,ARIP2 mRNA转录水平具有很高的表达[13-15]。
本组研究结果显示,Activin A能够刺激小肝细胞的ARIP2表达增加,其转录水平随作用时间的增加而升高,说明Activin A能够促进肝细胞的生长,这与文献报道中的结果一致。ARIP2的过表达对Activin A诱导的小鼠肝细胞的ActRⅡA mRNA的转录具有抑制作用,提示ARIP2在肝细胞中,能够起到激活信号传导的负调节作用。
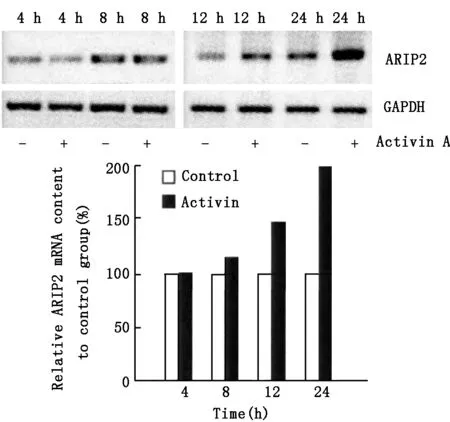
图1 Activin A对小鼠肝细胞ARIP2 mRNA转录的影响
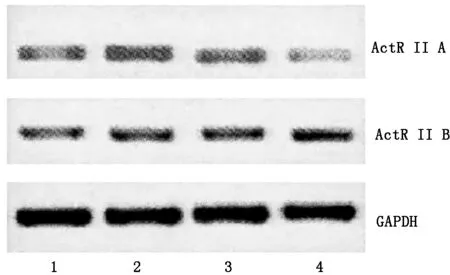
1:小鼠肝细胞+pcDNA3,2:小鼠肝细胞+Activin A+pcDNA3,3:小鼠肝细胞+Activin A+pcDNA3-ARIP2+pcDNA3,4:小鼠肝细胞+Activin A+pcDNA3-ARIP2
图2 ARIP2过表达对小鼠肝细胞ActRⅡ mRNA转录的影响
因此,根据本组研究结果提示,如果能够将肝细胞内的ARIP2的表达水平进行上调,则可以通过其对激活信号传导的负调节作用,抑制Activin在肝细胞中的诱导作用,对Activin诱导的肝病的进程进行阻断,从而起到治疗肝病的目的。
综上所述,ARIP2的表达受到多种因素的影响,ARIP2通过对小鼠肝细胞ActRⅡA表达的影响,参加激活素作用信号传导的负反馈调控,通过上调ARIP2在肝细胞上的表达,可能达到治疗肝病的目的。
[1]崔雪玲,葛敬岩,李晨光,等.激活素受体相互作用蛋白1及2在小鼠巨噬细胞中的表达[J].中国生物制品学杂志,2012,25(2):161.
[2]Liu ZH,Tsuchida K,Matsuzaki T,et al.Characterization of isoforms of activin receptor-interacting protein 2 that augment activin signaling [J].J Endocrinol,2006,189(2):409.
[3]谢佳男,刘 妍,赵 阳,等.激活互受体相互作用蛋白1,2在小鼠脑神经细胞中的共表达[J].中国生物制品学杂志,2013,26(7):912.
[4]宁亚媛,宁 静,张 敏,等.激活素受体相互作用蛋白2在ApoE-/-小鼠动脉粥样硬化斑块中表达的研究[J].临床荟萃,2011,26(7):594.
[5]Qi Y,Ge JY,Wang YN, et al.Co-expression of activin receptor-interacting protein 1 and 2 in mouse nerve cells[J].Neurosci Lett,2013,(10):542.
[6]Liu HY,Wang YN,Ge JY,et al.Localisation and role of activin receptor-interacting protein 1 in mouse brain[J].J Neuroendocrinol,2013,25(1):87.
[7]Liu HY,Chen FF,Ge JY,et al.Expression and localization of activin receptor-interacting protein 2 in mouse tissues[J].Gen Comp Endocrinol,2009,161(2):276.
[8]Zhang HJ,Tai GX,Zhou J,et al.Regulation of activin receptor-interacting protein 2 expression in mouse hepatoma Hepa1-6 cells and its relationship with collagen type IV[J].World J Gastroenterol,2007,13(41):5501.
[9]Gao RF,Li ZD,Jiang J,et al.hARIP2 is a putative growth-promoting factor involved in human colon tumorigenesis[J].Asian Pac J Cancer Prev,2014,15(20):8581.
[10]Jin Q,Zhong Y,Mulder KM.Requirement for protein kinase A in the phosphorylation of the TGFβ receptor-interacting protein km23-1 as a component of TGFβ downstream effects[J].Exp Cell Res,2013,319(6):897.
[11]Nagashima S,Kodaka M,Iwasw H,et al.MAGI2/S-SCAM outside brain[J].J Biochem,2015,157(4):177.
[12]Li ZD,Wu Y,Bao YL,et al.Identification and characterization of human ARIP2 and its relation to breast cancer[J].Cytokine,2009,46(2):251.
[13]Mahmoudabady M,Mathieu M,Dewachter L,et al.Activin-A,transforming growth factor-beta,and myostatin signaling pathway in experimental dilated cardiomyopathy[J].J Card Fail,2008,14(8):703.
[14]Kurisaki A,Inoue I,Kurisaki K,et al.Activin induces long-lasting N-methyl-D-aspartate receptor activation via scaffolding PDZ protein activin receptor interacting protein 1[J].Neuroscience,2008,151(4):1225.
[15]Adams S,Pankow S,Werner S,et al.Regulation of NF-kappaB activity and keratinocyte differentiation by the RIP4 protein:implications for cutaneous wound repair[J].J Invest Dermatol,2007,127(3):538.
Investigate the expression and regulation of Activin Receptor-interacting Protein 2 in mouse hepatic cells
LINRui-xin,WUJia-cheng,YOUGuang-qiang,etal.
(DepartmentofH.B.P,theSecondHospitalofJilinUniverrsity,Changchun130041,China)
Objective To investigate the expression and regulation of Activin Receptor-interacting Protein 2 in mouse hepatic cells.Methods The transcription level of ARIP2 mRNA in mouse hepatic cells was tested by RT-PCR and the factors regulating the expression were explored.Results Time-dependent increase of transcription level of ARIP2 in mouse hepatic cells was stimulated by Activin A.The transcription level of ARIP2 was increased significantly by the stimulation of Activin A,PMA and LPS,was decreased significantly by the stimulation of A23187.The transcription level of ActRⅡA was inhibited by the over expression of ARIP2,and the transcription level of ActRⅡB was not influenced.Conclusion The expression ARIP2 can be influenced by various factors,like Activin A,A23187,PMA and LPS.ARIP2 can participate in the negative feedback regulation of signal transduction by affecting the expression of ActRⅡA.
Activin Receptor-interacting Protein 2; mouse hepatic cells; expression; regulation
吉林省卫生厅项目(2011Z087)
1007-4287(2017)08-1422-03
Q786
A
2017-04-12)
*通讯作者
