美国《植物药指南》和植物药发展简介*
2017-08-31窦金辉
窦金辉
美国《植物药指南》和植物药发展简介*
窦金辉**
(密西西比大学牛津38677)
药物的定义在中美之间有很大差别。众多中药产品用来治病救人在中国早已习以为常,但美国则把中药当食品或膳食补充剂来监管,且在销售时不能标明有任何药用作用。美国食品药品监督管理局FDA的《植物药指南》为中药和其他草药未经纯化就能进入临床试验成为处方新药铺平了道路。《植物药指南》中允许推迟减免一些毒理实验以及让相对安全的中药直接进入二期临床试验。通过原药材种植采收及加工工艺来保证药品批次间的一致性也是《指南》的基本精神之一。2016年,修改版的《指南》还增加了用生物活性检测及多批次多剂量的临床试验来验证或保证质量控制的合理性等内容。借用中药的使用经验来研究中药或其有效组分之间的协同或加作用,有望成为中药以植物处方药走向世界的突破口。同时,数百获批进行临床试验的植物药品种只有Veregen和Fylyzaq(Mytesi)两个植物药上市,也说明把中药开发成为与新分子实体(New Molecule Entity)和新化学实体(New Chemical Entity)一样在多国上市的植物新药面临挑战。可以说,中药产品成为植物新药会是持久战,不宜急功近利。青蒿片剂能否经得起进一步的临床验证而与复方蒿甲醚”(Coartem)媲美,还需拭目以待。
中药植物药美国FDA《植物药指南》临床试验申请新药上市申请批次间一致性协同作用
人类应用植物药有着悠久的历史,植物中含有能治病的物质(Plants that Heal)。2007年,美国NIH两位天然药物专家曾做过统计,发现美国的处方药大类的25%以上是由植物天然物衍生而来。据报道,现有治疗用药物的90%以上来源于天然物模型[1]。从植物中提取的药物多数是提纯或衍生的药物(Plant-derived Single Molecule Drugs),如紫衫醇类(Paclitaxel and An⁃alogs)和青蒿素类素(Artemisinin and Analogs),也有一部分是混合成分(Plant-derived Mixtures as Drugs),如OTC药物欧车前子(Psyllium)和除虫菊素(Pyre⁃thrins)。用于治疗尖锐湿疣的绿茶提取物—茶多酚软膏(Veregen)和用于治疗艾滋病腹泻的南美巴豆龙血树的树脂花青素—止痢胶囊(Fulyzaq)为FDA批准的两个植物药。
1 美国《植物药指南》
2004年,美国公布了《植物药指南(Guidance for Industry Botanical Drug Products)》(以下简称“《指南》”),并于2015年进行了修订[2-3]。《指南》中对植物药(Botanical Drug Products)的定义为:含有植物材料中的成份,如植物、藻类、大型真菌或以上几种组成的复合成份,其剂型可以是溶液(如茶等)、粉末、片、胶囊、酏剂、皮肤局部制剂或者注射剂的医药产品。不包括发酵产品(如酵母、细菌或其它微生物的发酵产品)、高度纯化的物质或来源于植物但经化学修饰的物质、经重组DNA技术或克隆技术等基因修饰的植物材料、含有植物成份的变应原浸出物和疫苗等。
《指南》的基本要点包括:(1)化学工艺质量控制照顾植物复合物的特点:①不要求鉴定出活性成份;②不一定要求进一步纯化,但强调原药材的质量控制(批号间一致性的可控源头)。(2)草药或补充剂的使用者用经验可替代动物毒理研究用来支持Ⅰ期或Ⅱ期临床:非临床研究可以减免或者延迟进行。(3)临床试验的要求和其他药物无异:设计充分和有良好对照的临床试验对批准植物药在美国上市是必须的。(4)整体的临床的安全性和有效性要求及评价方式和其他药物(即非植物药,如小分子化药)一致。(5)修订的《指南》(已定稿)强调多批号和多剂量的临床试验用于支持“疗效一贯性”。
《指南》修订版的基本要点:①对Ⅰ、Ⅱ期临床要求,两版指南中保持不变;②增加了关于开展Ⅲ期临床的要求的内容;③Ⅲ期和NDA批号一贯性;④复方的临床拆方要求(Fixed-dose Combination Proposed Final Rule已公布)。
2 美国植物药审评审批情况
2.1 植物药生药学审评内容
植物药生药学审评的主要内容(Pharmacognosy Review of Botanical Drugs)包括:①原植物和原药材鉴定是安全和质量控制的一个重要部分;②是否有相关现代药理药效数据及传统医药理论为选择的临床适应症提供佐证;③是否有人类传统医药使用经验(如替代医学、中药产品等)来支持用药安全;④如何保证质量和批号间临床效果的一致性。
2.2 植物药临床申报概况
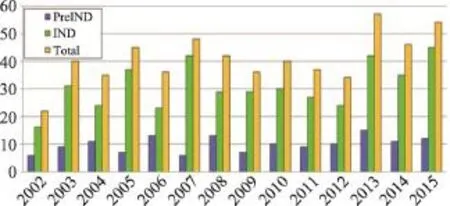
图1 美国近年来植物药临床申报情况
截止到2015年底,美国FDA收到超过600个植物药申请(INDs)和临床前咨询(pre-INDs),大约三分之一是复方制剂,三分之二是单味制剂。大部分IND进入Ⅱ期临床,少数已进入到Ⅲ期临床阶段(图1)。
2.3 获批准上市的植物药NDA(Veregen和Fulyzaq)2.3.1植物药Veregen审评概况[4]
Vergen是商品名,其通用名为Sinecatechins,药物成份为部分纯化的绿茶提取物,儿茶素按重量约占90%,日本生产。植物原料为绿茶,来源于中国野茶树的干叶子,制剂为15%浓度的软膏,适应症为外生殖器疣(尖锐湿疣)或肛疣。申请人为德国的MediGene, Inc.公司,该产品于2006年10月31日获批,其Ⅲ期临床疗效见下表1。
2.3.2 植物Fulyzaq审评概况[5]
Fulyzaq是商品名(现名Mytesi),其通用名为Cro⁃felemer,植物原料为南美巴豆龙血树树脂,制剂为125 mg口服片剂,适应症为HIV相关的腹泻,申请人为Sa⁃lix Pharmaceuticals,该产品于2012年12月31日获批。其Ⅲ期临床疗效见如表2所示。
①临床治疗反应的定义为在服用安慰剂治疗阶段,至少2-4周出现每周≤2次水样便。②a.采用Posch and Bauer(2005)计算P值和CI值。b.一周内少于5天无数据,该受试者该周的治疗视为无治疗反应。受试者在4周治疗期间提前结束,视为无治疗反应。在有效性评价期间,受试者使用ADM或阿片类止痛药>3天,视为无治疗反应。

表1 VeregenⅢ期临床试验主要指标有效性结果(ITT-LOCF)N/%

表2 FulyzaqⅢ期临床试验主要指标有效性结果(ITT)

表3 Veregen与Fulyzaq原料药/活性物质对比
图2 Veregen和Fulyzaq主要成份比较
2.3.3 Veregen与Fulyzaq比较
其“原料药/活性物质”对比见下表3,主要成份比较见图2。
2.3.4 Fulyzaq(NDA)保证批号间疗效
Fulyzaq(NDA)保证批号间疗效的一贯性的措施:①加强原药材鉴定和质控(Extend CMC Control to Raw Material),包括规范化采植GACP和限定采收区域(Eco-geographic Regions Established);②常规的工艺质量控制手段(Conventional CMC):Crofelemer是复杂植物混合物,其鉴定和检测应达到与其属性相应的标准;同时承认并允许由于植物药本身的复杂和分析手段的局限而造成的非精准定量,故而,FDA没有要求申办方去做更多的化学试验,解析结构细节,和更精准定量;③其他手段和信息来支持保证批号间疗效的一贯性:临床效果和剂量及批号间没有明显关联;增加生物活性检测(Bioassay)作用机理研究显示临床剂量可以饱和肠系膜上的靶点(与离子通道开合有关);原药材是秘鲁的最常用止泻草药(充分的人用经验)。
2.4 NDA植物药审评经验小结
综合评价和各方把关,要求控制原药材产地并有相应质量标准。中间体,原料药及药品的多种检测质控手段及相应的标准作为批号间一贯性的基础,综合传统CMC方法(conventional CMC approaches)监测中间体、原料药及药品的后续过程和生理化学特点,确保化学一致性。如果需要,可增加non-CMC数据,如生物活性检测以确保批号间的一致性。临床安全性和有效性评价与非植物药要求一致。临床试验可以用来支持批号间疗效或质量的一贯性,多个批号的临床使用数据分析可以作为制定质控标准的基础,多剂量组的临床结果可能显示药品和原料药的一些化合物的含量在一定范围的波动不影响治疗效果,这些在可允许范围内。
3 小结
与提纯或合成的单分子化药不同,中药植物药的成分复杂多样,给质量控制带来挑战。但是植物中成分多样化也成为传统中药继续开发成为植物药的一个有利条件。药材或者复方中的不同活性成分可能具有协同(synergy)或加和作用(additive effects)优势[6-8]。比如,美国的土黄连(Goldenseal)中的黄酮成分和有抑菌活性的生物碱有协同抗菌作用,而协同抗菌的机理在于黄酮抑制细胞膜上耐药通路蛋白的作用。屠呦呦教授获诺贝尔奖的抗疟药物青蒿素纯品也很快会产生耐药,需要和其他抗疟药联合用药,比如中国科学家周义清教授发明的“复方蒿甲醚”(Coartem)就是蒿甲醚与苯芴醇的联合用药。复方蒿甲醚是目前世界上常用的抗疟一线药。耐人寻味的是,用青蒿叶抗疟则不易产生耐药性,且防止疟原虫产生耐药性至少也部分得力于黄酮类成分和青蒿素的协同作用[9-11]。现代数据和含青蒿的古方的记载,预示着开发青蒿或含青蒿的复方植物抗疟新药是有前途的。
中药的安全有效使用,药材的质量是一个基本保证。随着中药制剂技术的现代化和药材市场需求日益增加,栽培采收和资源保护需要引起高度的重视。研究中药或其有效组分之间的协同或加和作用,有望成为把中药转化为植物药的一个突破口。数百获批进行临床试验的植物药品种只有两个植物药上市,说明中药成为NME/NCE的处方新药是持久战。青蒿片剂或中医含青蒿的处方,仍有望经大样本临床试验而和复方蒿甲醚”(Coartem)一样安全有效而成为世界公认的药物。
1Newman D J,Cragg G M.Natural products as sources of new drugs over the last 25 years.J Nat Prod,2007,70(3):461-477.
2U.S.Department of Health and Human Services,Food and Drug Admin⁃istration,Center for Drug Evaluation and Research.Guidance for Indus⁃try Botanical Drug Products,2004.https://www.fda.gov/downloads/aboutfda/ centersoffices/centerfordrugevaluationandresearch/ucm106136.pdf
3U.S.Department of Health and Human Services,Food and Drug Admin⁃istration,Center for Drug Evaluation and Research.Botanical Drug Develop⁃ment Guidance for Industry,2016.https://www.fda.gov/downloads/drugs/ guidancecomplianceregulatoryinformation/guidances/ucm458484.pdf
4Chen S T,Dou J,Temple R,et al.New therapies from old medicines. Nat Biotechnol,2008,26(10):1077-1083.
5Lee A L,Dou J H,Agarwal R,et al.Evolution of traditional medicines to botanical drugs.Science,2015,347(6219Suppl):S32-S34.
6Fu H,He J,Mei F,et al.Lung cancer inhibitory effect of epigallocate⁃chin-3-gallate is dependent on its presence in a complex mixture(poly⁃ phenon E).Cancer Prev Res(Phila),2009,2(6):531-537.
7Bode A M,Dong Z.Epigallocatechin 3-gallate and green tea catechins: United they work,divided they fail.Cancer Prev Res(Phila),2009,2(6): 514-517.
8Junio H A,Sy-Cordero A A,Ettefagh K A,et al.Synergy-directed frac⁃tionation of botanical medicines:a case study with goldenseal(Hydrasti⁃scanadensis).J Nat Prod,2011,74(7):1621-1629.
9Weathers PJ,Towler M,Hassanali A,et al.Dried-leaf Artemisia annua: A practical malaria therapeutic for developing countries?World J Phar⁃macol,2014,3(4):39-55.
10 Ferreira J F,Luthria D L,Sasaki T,et al.Flavonoids from Artemisia an⁃nua L.as antioxidants and their potential synergism with artemisinin against malaria and cancer.Molecules.2010,15(5):3135-70.
11 Daddy N B,Kalisya L M,Baire P G,et al.Artemisia annua dried leaf tablets treated malaria resistant to ACT and i.v.artesunate:Case re⁃ports.Phytomedicine,2017,32:37-40.
Botanical Drug Development-Guidance for Industry and Expert Views on Botanical Drug Development in the US
Dou Jinhui
(The University of Mississippi,Oxford,MS 38677,USA)
The definition of new drugs in China and the US has no major differences on chemical drugs and biologics. However,Chinese medicines,which are regulated as over-the-counter(OTC)or prescription drugs in China,are mostly regulated as food and/or dietary supplements without FDA approved medicinal use for marketing.The FDA Guidance for Industry-Botanical Drug Products(2004)and the recently revised Guidance for Botanical Drug Development(2016) paved the way for Chinese herbal medicine and other botanical mixtures to be further developed as new drugs through clinical trials and other nonclinical studies.FDA recognizes the value of traditional medicines as part of the previous human experiences to support the safety and speed up early phase clinical trials of botanical products under investigational new drug(INDs)applications.The revised Guidance included addition recommendations for late phase development,like phase 2 trials and new drug applications(NDA),to resolve some of the unique challenges on batch-tobatch consistency(e.g.,a totality of evidence approach,including raw material control,bioassays,multiple-batch and multiple-dose clinical trials,and etc.).The approval of Veregen and Fulyzaq(now Mytesi)are new molecular entity/new chemical entity type of new drugs,treasured fruits from several hundred INDs studying botanicals.With those NDA examples,it is expected that further study of Chinese herbal medicines as new botanical drugs through further clinical and nonclinical development will be fruitful.On the other hand,long-term commitments are universal for new drug development.And it will also be true for bringing Chinese herbal medicines as botanical new drugs to international markets.It still takes time to see whether artesunate tablets can be verified through further clinical trials and achieve the same level of Coartem.
Chinese herbal medicine,botanical drugs,US FDA Guidance for Industry-Botanical Drug Development,in⁃vestigational new drug application,new drug application,batch-to-batch consistency,synergism
10.11842/wst.2017.06.008
R281.2
A
(责任编辑:张娜娜,责任译审:王晶)
2017-05-22
修回日期:2017-06-17
*本文根据窦金辉博士在国家食品药品监督管理局药品审评中心“思与行”系列讲坛上的专题报告整理。
**通讯作者:窦金辉,博士,美国FDA植物药审评专家,主要研究方向:生药学。
