丙泊酚对心肌梗死大鼠冠状动脉结扎术中心肌的影响研究
2017-08-30王志杰
王志杰
·论著·
丙泊酚对心肌梗死大鼠冠状动脉结扎术中心肌的影响研究
王志杰
目的 探讨丙泊酚对心肌梗死大鼠冠状动脉结扎术中心肌的影响。方法 2016年4月,选取50只雄性SD大鼠并随机分为对照组和丙泊酚组,每组25只。两组大鼠均于麻醉满意后开胸,结扎左冠状动脉前降支,制备心肌梗死模型。对照组大鼠给予0.9%氯化钠溶液持续静脉泵注,丙泊酚组大鼠给予丙泊酚持续静脉泵注;建模后1周处死大鼠。记录两组大鼠建模前和结扎冠状动脉后10 min肢体六导联心电图,采用酶联免疫吸附试验检测两组大鼠建模前及建模后1周血清超敏C反应蛋白(hs-CRP)水平,采用TTC染色法检测心肌梗死面积,计算两组大鼠建模后1周心肌梗死面积所占比例;采用TUNEL法检测心肌细胞凋亡情况,计算两组大鼠建模后1周心肌细胞凋亡指数。结果 实验过程中对照组5只大鼠死亡,丙泊酚组7只大鼠死亡。两组大鼠建模前心电图正常,两组大鼠结扎冠状动脉后10 min心电图示Ⅰ、Ⅱ、aVL导联ST段抬高、T波高耸或T波与QRS波融合。两组大鼠建模前和建模后1周血清hs-CRP水平比较,差异均无统计学意义(P>0.05);两组大鼠建模后1周血清hs-CRP水平均高于建模前(P<0.05)。建模后1周丙泊酚组大鼠心肌梗死面积所占比例小于对照组(P<0.05)。生物素化dUTP标记阳性的细胞核呈棕褐色,细胞核呈碎点状,不规整,大小不一。建模后1周丙泊酚组大鼠心肌细胞凋亡指数低于对照组(P<0.05)。结论 丙泊酚能有效缩小心肌梗死大鼠冠状动脉结扎术中心肌梗死面积、减少心肌细胞凋亡。
心肌梗死;丙泊酚;冠状动脉;结扎术;大鼠
王志杰.丙泊酚对心肌梗死大鼠冠状动脉结扎术中心肌的影响研究[J].实用心脑肺血管病杂志,2017,25(6):38-41.[www.syxnf.net]
WANG Z J.Impact of propofol on myocardium in myocardial infarction rats undergoing coronary artery ligation[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2017,25(6):38-41.
近年来,随着溶栓药物应用增多及冠状动脉介入技术发展,急性心肌梗死病死率明显降低,但存活的心肌梗死患者因心肌坏死而导致心脏不可逆损伤,易并发心力衰竭、心律失常、心脏破裂等,严重影响患者的生存质量。目前,有效挽救心肌梗死患者梗死心肌、改善患者预后仍是全球性难题之一[1]。丙泊酚(propofol)是近年来临床应用较广泛的静脉麻醉剂,其可在心肌缺血/再灌注损伤过程中发挥心肌细胞保护作用[2-3],但丙泊酚对梗死心肌影响的在体研究报道较少。本研究采用传统心肌梗死大鼠模型制备方法,旨在探讨冠状动脉结扎术中应用丙泊酚对心肌梗死大鼠心肌的影响,现报道如下。
1 材料与方法
1.1 实验动物 2016年4月选取50只雄性SD大鼠,SPF级,体质量250~300 g,由广州医科大学实验动物中心提供。将50只大鼠随机分为对照组和丙泊酚组,每组25只。
1.2 主要试剂及仪器 丙泊酚(四川蜀乐药业股份有限公司),超敏C反应蛋白(hs-CRP)检测试剂盒(美国RD公司),2,3,5-氯化三苯基四氮唑(TTC)(美国Sigma公司),DNA原位末端缺口标记试剂盒(TUNEL)(德国宝灵曼公司),小动物呼吸机(上海奥尔科特生物有限公司,型号:ALC-V9)、12导联心电图机(日本光电公司,型号:ECG-9130P)、显微镜(正置)(日本奥林巴斯公司,型号:BX51)、轮转组织切片机(德国Leica公司,型号:RM2165)、病理组织漂烘仪(中国华利电子公司,型号:ZMN-6802)、自动组织包埋机(中国华利电子公司,型号:ZMN-7803)。
1.3 建模方法 建模前1周将大鼠置于实验室,正常饮食、饮水;建模前8 h所有大鼠停止进食、饮水。采用水合氯醛3 ml/kg腹腔注射进行麻醉,麻醉满意后称重,并将大鼠仰卧位固定至鼠板。连接12导联心电图机,记录建模前10 min肢体六导联心电图。丙泊酚组大鼠给予丙泊酚6 mg·kg-1·h-1持续静脉泵注,对照组大鼠给予等容量0.9%氯化钠溶液持续静脉泵注,之后切开、分离颈部正中皮肤、皮下组织,在第3、4气管软骨间隙切口并插入简易气管导管,连接小动物呼吸机进行辅助呼吸。沿左侧第4肋间开胸,钝性分离肌肉及肋骨,小心挑开心包膜,参考文献[4]中的方法结扎左冠状动脉前降支。结扎冠状动脉后10 min连接12导联心电图机,记录肢体六导联心电图,以心电图显示Ⅰ、Ⅱ、aVL导联ST段抬高提示冠状动脉结扎心肌梗死模型制备成功[5]。建模当日禁食禁水,次日大鼠可以正常进食、饮水,室内饲养1周。
1.4 方法
1.4.1 心电图 12导联心电图机电极采用细针电极,刺入大鼠四肢皮下,心电图机参数设置:纸速25 mm/s,电压10 mV。分别在建模前和结扎冠状动脉后10 min记录两组大鼠肢体六导联心电图。
1.4.2 血清hs-CRP水平检测方法 建模前及建模后1周采取两组大鼠尾静脉血2 ml,于室温静置30 min后置于离心机,3 000 r/min离心15 min,留取血清,置于-20 ℃环境下保存待测。采用酶联免疫吸附试验(ELISA)检测血清hs-CRP水平,并严格按照试剂盒说明书进行操作。
1.4.3 TTC染色法检测心肌梗死面积 建模后1周,在大鼠心脏注射10%氯化钾处死大鼠,之后快速开胸,剪下心脏,剪除心底部血管及心房组织,4 ℃ 0.9%氯化钠溶液冲洗心脏及心腔,横切部分心室组织置于37 ℃恒温箱中,于1% TTC磷酸盐缓冲液(pH值=7.4)10 ml中孵育10 min后取出,观察心脏切面,砖红色区域为存活心肌、灰白色区域为梗死心肌。拍照记录,并采用Image J图形分析软件计算大鼠心肌梗死面积所占比例。
1.4.4 TUNEL法检测心肌细胞凋亡情况 将远离梗死区的非梗死区心肌组织置于4%多聚甲醛固定后石蜡包埋、进行切片,厚度为3 μm。参照文献[6]中TUNEL法,采用末端脱氧核苷酸转移酶(TdT)将生物素化dUTP标记到脱氧核糖核酸的3′-羟基端,加入过氧化物酶对底物采用二氨基联苯氨(DAB)进行显色,如在原位则出现棕色沉淀,在显微镜下凋亡心肌细胞核呈棕色[7]。在200倍光学显微镜下随机选取5个视野,每个视野分别计数100个细胞,计算心肌细胞凋亡指数,心肌细胞凋亡指数=凋亡心肌细胞数/正常心肌细胞数×100%。
2 结果
2.1 大鼠死亡情况 实验过程中对照组5只大鼠死亡,丙泊酚组7只大鼠死亡。
2.2 心电图结果 两组大鼠建模前心电图正常,结扎冠状动脉后10 min心电图示Ⅰ、Ⅱ、aVL导联ST段抬高、T波高耸或T波与QRS波融合,提示冠状动脉结扎成功,见图1。

注:图1A为丙泊酚组大鼠建模前肢体六导联心电图,图1B为丙泊酚组大鼠结扎冠状动脉后10 min肢体六导联心电图,图1C为对照组大鼠建模前肢体六导联心电图,图1D为对照组大鼠结扎冠状动脉后10 min肢体六导联心电图
图1 两组大鼠建模前和结扎冠状动脉后10 min肢体六导联心电图
Figure 1 Six-limb leads electrocardiogram of the two groups before modeling and after 10 minutes of coronary artery ligation
2.3 血清hs-CRP水平 两组大鼠建模前和建模后1周血清hs-CRP水平比较,差异均无统计学意义(P>0.05);两组大鼠建模后1周血清hs-CRP水平均高于建模前,差异均有统计学意义(P<0.05,见表1)。
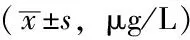
Table 1 Comparison of serum hs-CRP level between the two groups before and after modeling

组别例数建模前建模后1周t值P值对照组206 8±0 511 1±1 610 18<0 01丙泊酚组187 0±1 110 3±0 914 92<0 01t值4 332 65P值>0 05>0 05
2.4 心肌梗死面积 建模后1周对照组大鼠心肌梗死面积所占比例为(17.07±0.75)%,丙泊酚组大鼠为(14.77±0.51)%;丙泊酚组大鼠心肌梗死面积所占比例低于对照组,差异有统计学意义(t=2.58,P<0.05)。
2.5 心肌细胞凋亡指数 生物素化dUTP标记阳性的凋亡心肌细胞核呈棕褐色,细胞核呈碎点状,不规整,大小不一(见图2)。建模后1周对照组大鼠心肌细胞凋亡指数为(31.22±1.00)%,丙泊酚组大鼠为(27.78±0.80)%;丙泊酚组大鼠心肌细胞凋亡指数低于对照组,差异有统计学意义(t=11.77,P<0.05)。

注:A为对照组,箭头指向被生物素化dUTP标记的凋亡心肌细胞;B为丙泊酚组,箭头指向被生物素化dUTP标记的凋亡心肌细胞
图2 两组大鼠心室肌非梗死区心肌细胞凋亡情况(TUNEL染色,×200)
Figure 2 Myocardial apoptosis in non-infarcted ventricular myocardium of the two groups
3 讨论
目前,尽早挽救梗死心肌、改善心肌梗死患者预后是临床和基础医学研究的重点内容[8-9]。丙泊酚是一种新型短速静脉麻醉剂,具有麻醉后苏醒迅速且完全、持续静脉给药后无蓄积等优点[10-12]。既往研究表明,丙泊酚可通过抑制细胞凋亡、减轻缺血/再灌注损伤而发挥心肌细胞保护作用,常规剂量丙泊酚能有效改善缺血/再灌注损伤患者心肌舒张、收缩功能[13-14];除此之外,丙泊酚还具有抗心律失常作用。病理学研究表明,细胞坏死、凋亡是心肌缺血/再灌注损伤发病过程中的重要环节,也是心肌梗死后心室重塑的重要病理学基础[15],故丙泊酚可能对心肌梗死患者梗死心肌具有保护作用。
本研究采用的传统心肌梗死大鼠模型制备方法可以较好地模拟心肌梗死过程,且操作简单、经济实用并可稳定复制[16]。hs-CRP是反映心肌梗死程度及预后的常用临床指标。本研究结果显示,两组大鼠建模后1周血清hs-CRP水平均高于建模前,符合心肌梗死急性期特点;但两组大鼠血清hs-CRP水平间无差异,提示冠状动脉结扎术中应用丙泊酚可能对心肌梗死程度无影响。TTC是一种对光敏感的脂溶性复合物,多用于检测哺乳动物内脏组织缺血或梗死范围,其通过与组织中脱氢酶反应而产生一种砖红色脂溶性物质,但梗死组织由于脱氢酶活力降低而不能与TTC发生反应,故呈现灰白色。本研究结果显示,建模后1周丙泊酚组大鼠心肌梗死面积所占比例低于对照组,提示冠状动脉结扎术中应用丙泊酚能有效缩小心肌梗死大鼠心肌梗死面积;但TTC染色法不能很好地区分梗死交界区心肌,故存在一定混杂因素。心肌细胞在凋亡过程中产生内切核酸酶并被激活后将DNA链从核小体之间进行切断,可形成180~200碱基倍数的DNA片段,由于多DNA片段断端的存在而使生物素化dUTP末端标记呈阳性结果。TUNEL法是由DNA末端转移酶介导的dUTP缺口末端标记的染色方式[17]。本研究结果显示,丙泊酚组大鼠心肌细胞凋亡指数低于对照组,提示冠状动脉结扎术中应用丙泊酚可减少心肌梗死大鼠心肌细胞凋亡。
综上所述,丙泊酚能有效缩小心肌梗死大鼠冠状动脉结扎术中心肌梗死面积、减少心肌细胞凋亡,这为深入研究丙泊酚对心肌细胞的保护作用及其作用机制等提供了实验依据。
本文无利益冲突。
[1]MOZAFFARIAN D,BENJAMIN E J,GO A S,et al.Heart Disease and Stroke Statistics—2016 Update:A Report From the American Heart Association[J].Circulation,2015,31(4):29-322.
[2]YAO X,LI Y,TAO M,et al.Effects of Glucose Concentration on Propofol Cardioprotection against Myocardial Ischemia Reperfusion Injury in Isolated Rat Hearts[J].J Diabetes Res,2015,2015:592028.DOI:10.1155/2015/592028.
[3]RUGGIERI F,CAPPELLERI G,CORNAGGIA G.Letter by Ruggieri et al regarding article,"Randomized comparison of sevoflurane versus propofol to reduce perioperative myocardial ischemia in patients undergoing noncardiac surgery"[J].Circulation,2013,127(25):e877.
[4]STUCKEY D J,CARR C A,MEADER S J,et al.First-pass perfusion CMR two days after infarction predicts severity of functional impairment six weeks later in the rat heart[J].J Cardiovasc Magn Reson,2011,13:38.DOI:10.1186/1532-429X-13-38.
[5]李军,吕双红,薛剑,等.大鼠心肌梗死后心力衰竭模型的建立及评价[J].标记免疫分析与临床,2015,22(10):1037-1041.DOI:10.11748/bjmy.issn.1006-1703.2015.10.026.
[6]GAVRIELI Y,SHERMAN Y,BEN-SASSON S A.Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J].J Cell Biol,1992,119(3):493-501.
[7]周锦,张铁铮,王凤学,等.丙泊酚对大鼠全心缺血-再灌注损伤后心肌细胞凋亡的影响[J].临床麻醉学杂志,2003,19(6):350-352.DOI:10.3969/j.issn.1004-5805.2003.06.009.
[8]BRAUNWALD E.The war against heart failure:the Lancet lecture[J].Lancet,2015,385(9970):812-824.
[9]WHITE H D,CROSS D B,ELLIOTT J M,et al.Long-term prognostic importance of patency of the infarct-related coronary artery after thrombolytic therapy for acute myocardial infarction[J].Circulation,1994,89(1):61-67.
[10]龙海林,徐昆.丙泊酚对心肌细胞凋亡的影响[J].医学综述,2008,14(22):3480-3482.DOI:10.3969/j.issn.1006-2084.2008.22.041.
[11]陈军,罗自立,李建芬,等.丙泊酚联合舒芬太尼与丙泊酚单独用于胃肠镜检查有效性及安全性的比较研究[J].实用心脑肺血管病杂志,2016,24(4):67-69.DOI:10.3969/j.issn.1008-5971.2016.04.018.
[12]杜娟,朱学芳,陈高梅,等.按峰效应分布容积及预期血药浓度设置芬太尼负荷剂量复合丙泊酚全麻诱导的可行性临床观察[J].疑难病杂志,2015,14(5):526-528,531.DOI:10.3969/j.issn.1671-6450.2015.05.026.
[13]KO S H,YU C W,LEE S K,et al.Propofol attenuates ischemia-reperfusion injury in the isolated rat heart[J].Anesth Analg,1997,85(4):719-724.
[14]HEUSCH G,LIBBY P,GERSH B,et al.Cardiovascular remodelling in coronary artery disease and heart failure[J].Lancet,2014,383(9932):1933-1943.DOI:10.1016/S0140-6736(14)60107-0.
[15]JAVADOV S A,LIM K H,KERR P M,et al.Protection of hearts from reperfusion injury by propofol is associated with inhibition of the mitochondrial permeability transition[J].Cardiovasc Res,2000,45(2):360-369.
[16]高琴,关瑞锦.充血性心力衰竭大鼠模型的制作及意义[J].心血管康复医学杂志,2004,13(1):27-30.
[17]张翠香,刘建勋,董小霞,等.对凋亡细胞TUNEL染色操作中的体会[J].实验动物科学,2014,31(4):46-48.DOI:10.3969/j.issn.1006-6179.2014.04.012.
(本文编辑:谢武英)
Impact of Propofol on Myocardium in Myocardial Infarction Rats Undergoing Coronary Artery Ligation
WANGZhi-jie
DepartmentofAnesthesiology,HuiaiHospitalofGuangzhou(theAffiliatedBrainHospitalofGuangzhouMedicalUniversity),Guangzhou510370,China
Objective To investigate the impact of propofol on myocardium in myocardial infarction rats undergoing coronary artery ligation.Methods In April 2016,a total of 50 male SD rats were randomly divided into control group and test group,each of 25 rats.All of the rats
thoracotomy after successful anesthesia,then left anterior descending coronary artery was ligated to prepare myocardial infarction model.Rats of control group received continuous intravenous pumping of 0.9% sodium chloride injection,while rats of test group received continuous intravenous pumping of propofol;all of the rats were killed after 1 week of modeling.Six-limb leads electrocardiogram was recorded before modeling and after 10 minutes of coronary artery ligation,enzyme-linked immunosorbent assay was used to detect the serum hs-CRP level before modeling and after 1 week of modeling,TTC staining method was used to detect and calculate the proportion of myocardial infarction area after 1 week of modeling,TUNEL staining method was used to detect and calculate the myocardial apoptosis index after 1 week of modeling.Results During the experiment,5 rats of control group and 7 rats of test group were dead.Electrocardiogram of the two groups was normal before modeling;after 10 minutes of coronary artery ligation,electrocardiogram of the two groups showed ST-segment elevation in Ⅰ-,Ⅱ- and aVL-lead,towering T-wave or integration of T-wave and QRS-wave.No statistically significant differences of serum hs-CRP level was found between the two groups before modeling or after 1 week of modeling(P>0.05);after 1 week of modeling,serum hs-CRP level of the two groups was statistically significantly higher than that before modeling,respectively(P<0.05).Proportion of myocardial infarction area of test group was statistically significantly lower than that of control group after 1 week of modeling(P<0.05).Biotinylated dUTP-marked positive cell nucleus were reddish brown,performed as breaking points with irregular uneven size.Myocardial apoptosis index of test group was statistically significantly lower than that of control group after 1 week of modeling(P<0.05).Conclusion Propofol can effectively shrink the myocardial infarction area and reduce the myocardial apoptosis in myocardial infarction rats undergoing coronary artery ligation.
Myocardial infarction;Propofol;Coronary arteries;Ligation;Rat
R 542.22
A
10.3969/j.issn.1008-5971.2017.06.009
2017-03-12;
2017-06-15)
510370广东省广州市惠爱医院(广州医科大学附属脑科医院)麻醉科
