低温胁迫下短枝木麻黄耐寒相关基因的差异表达分析*
2017-08-30郑勇奇丁红梅柳新红盛炜彤李海波
李 楠 郑勇奇 丁红梅 柳新红 盛炜彤 江 波 李海波
(1.中国林业科学研究院林业研究所 国家林业局林木培育重点实验室 北京 100091;2.浙江省林业科学研究院 杭州310023; 3.浙江中医药大学 杭州 310053)
低温胁迫下短枝木麻黄耐寒相关基因的差异表达分析*
李 楠1,2郑勇奇1丁红梅3柳新红2盛炜彤1江 波2李海波2
(1.中国林业科学研究院林业研究所 国家林业局林木培育重点实验室 北京 100091;2.浙江省林业科学研究院 杭州310023; 3.浙江中医药大学 杭州 310053)
【目的】 对6个耐寒相关调控基因(RAP2.7,ABR1,AtHSFA6B,AtbZIP44,GRXC6和HSP18.2)在耐寒和不耐寒木麻黄种质中精细表达模式进行分析,为深入解析木麻黄耐寒的分子机制提供理论基础。【方法】 测定耐寒(ZS7)和不耐寒(HN1)2种短枝木麻黄无性系在-2 ~-11 ℃低温胁迫下的相对电导率,基于Logistic方程对处理温度和对应的相对电导率进行拟合,计算低温半致死温度(LT50)。根据前期转录组测序得到的6个耐寒相关调控基因的EST序列设计特异引物,利用逆转录实时荧光定量PCR分析6个基因在-2,-5,-8 ℃连续3个温度梯度胁迫下的表达差异,以及在-5 ℃低温下连续胁迫1,2,5,8,16,24,48,72 h后,在耐寒和不耐寒短枝木麻黄无性系中的精细表达模式。基因相对表达量的计算采用2-ΔΔCT法。【结果】 在低温胁迫下,耐寒和不耐寒短枝木麻黄无性系的相对电导率存在极显著差异(P<0.01),低温半致死温度分别为-5.92 ℃和-2.87 ℃。在常温条件下,6个基因在耐寒和不耐寒种质中的相对表达量皆无明显差异。在临近不耐寒种质半致死温度的-2 ℃下持续2 h后,6个耐寒相关基因在不耐寒种质中的表达被强烈抑制,而在耐寒种质中的表达被激活; 在临近耐寒种质半致死温度的-5 ℃下持续2 h后,不耐寒种质中的各基因被进一步抑制,同时在耐寒种质中的表达亦被强烈抑制; 在低于半致死温度的-8 ℃下持续2 h后,各基因的表达继续受到抑制。对在临近耐寒种质半致死温度的-5 ℃胁迫下,耐寒种质和不耐寒种质的精细表达模式分析表明,在-5 ℃低温胁迫下,耐寒种质中6个基因的表达在8 h后开始呈现极显著上调,表达量最高值集中在低温胁迫后的第8,24,48 h; 不耐寒种质中6个基因的表达在1~16 h内皆呈现极显著下调,表达量最低值集中在1~5 h内。【结论】 在耐寒相关调控基因的表达水平上,耐寒和不耐寒短枝木麻黄对低温的应答机制明显不同。低温激活了耐寒种质中转录因子、ROS家族基因、ROS应答因子等调控基因的增强表达以抵御和适应逆境胁迫,但抑制了在不耐寒种质中的表达,显著降低了不耐寒种质对低温逆境的耐受能力。该研究在一定程度上对于丰富木麻黄适应低温的分子机制,以及耐寒无性系的分子选育都具有一定的参考价值。
短枝木麻黄; 低温冻害; 耐寒性; 基因表达; 分子选育
木麻黄科 (Casuarinaceae) 植物包含了4个属96个种(Wilsonetal.,1989),为常绿乔木或灌木,该科植物常被统称为木麻黄,天然分布于东南亚地区、太平洋西南群岛和澳大利亚地区。我国自20世纪50年代从国外引进木麻黄,目前已拥有人工林30万hm2(仲崇禄等, 2005)。短枝木麻黄(Casuarinaequisetifolia)、细枝木麻黄(C.cunninghamiana)、粗枝木麻黄(C.glauca)和山地木麻黄(C.junghuhniana)是我国人工栽培面积最广泛的4个种(Zhongetal., 2010)。木麻黄植物对我国沿海陆地生态系统的恢复、沿海自然灾害的防御、贫瘠沿海沙地和严重退化的南方山区丘陵地区的土壤改良等均有重要作用,特别在沿海前沿沙质地带仍是无可替代的树种(陈彦等, 2005; 张云生等, 2002; 仲崇禄等, 2005)。浙江省自20世纪60年代开始向台州、宁波、舟山沿海地区引种,短枝木麻黄已经成为浙江省海岸线的重要防护林树种(何贵平等, 2011; 张昕等, 2011)。然而,木麻黄生长适温在22.1~26.9 ℃,耐寒性较差(Duke, 1983)。引种的木麻黄常遭受较严重冻害,给沿海防护林建设造成较大损失。低温冻害已成为了扩大木麻黄种植范围和推进沿海防护林建设的主要制约因素。因此,研究木麻黄的耐寒机制和性能,提高木麻黄的耐寒适应性,推进木麻黄耐寒品种的选育,是当前沿海防护林工程建设中迫切需要解决的瓶颈问题。
迄今为止,国内外对木麻黄树种耐寒性的研究基本上还停留在抗性生理指标的测定分析以及对耐寒无性系或实生苗田间选育的阶段,从分子水平上对木麻黄耐寒机制的研究非常匮乏(仲崇禄等, 1998; 柯玉铸等, 2000; 叶功富等, 2004; 2008; 王泳等, 2005; 薛扬等, 2008; 2012; 何贵平等, 2011; 张勇等, 2011; 武冲等, 2012; 邬金等, 2013)。第2代高通量测序技术研究转录组具有快速得到基因表达谱变化、精确分析转录本的SSR、SNP位点和可变剪接变异,以及发现低丰度转录本和新转录本的独特优势,被广泛应用于植物冷适应和低温响应机制的研究(Marionietal., 2008; Lietal., 2012; Toralesetal., 2013; Tianetal., 2013; Wangetal., 2014)。鉴于这一优势,为了从低温应答基因的表达水平上全面解析木麻黄的耐寒机制,在前期研究中对从浙江省舟山选育出的短枝木麻黄耐寒无性系(ZS7)在低温胁迫过程中的转录组测序,鉴定出了一批与信号转导、碳水化合物合成、次生代谢以及抗氧化酶等代谢途径相关的差异表达基因,其中包括64个与耐寒相关的转录因子家族基因、20个与耐寒相关的ROS家族基因成员和24个在低温胁迫下的ROS应答基因(Lietal., 2017)。为了进一步了解这些差异表达基因在低温胁迫过程中的精细表达规律,在本研究中,选用短枝木麻黄耐寒无性系ZS7和不耐寒无性系HN1为种质材料,通过电导率和致死温度来反映不同耐寒种质在生理水平上的差异,并进一步从分子水平上,利用实时荧光定量 PCR(quantitative Real-Time PCR,qPCR)研究不同耐寒种质在低温胁迫过程中的基因表达规律及表达差异,以期为深入解析木麻黄的耐寒机制提供参考,为推进木麻黄耐寒品种分子选育提供有价值的候选基因。
1 材料与方法
1.1 试验材料
以来自舟山的短枝木麻黄耐寒无性系ZS7和海南的不耐寒无性系HN1为供试材料。用于生理测试的供试材料种植于浙江省林业科学研究院苗圃,各取5株1年生无性系正常生长的枝条(包括叶和小枝)用于低温梯度胁迫试验(王泳等, 2005; 何贵平等, 2011)。低温胁迫试验模拟自然界降温过程,先将供试材料在低温人工气候箱(PRXD-300,上海乔跃)中从常温(RT)预冷至10 ℃左右,之后逐步降温至-2,-5,-8,-11 ℃,在降至每个低温节点持续2 h后,各取出12个枝条测定电导率和致死温度。12个枝条等分为3份作为3个重复。
用于分子试验的供试材料采用盆栽方式,在浙江省林业科学研究院温室进行扦插繁殖。塑料盆尺寸为13 cm(高)×20 cm(直径)。盆栽基质为泥炭和蛭石混合物(4∶1),装盆前进行灭菌处理。培养条件为: 光照16 h,温度25 ℃,光强180 μmoL·m-2s-1,相对湿度60%~70%。在温室中培养2个月后,扦插苗高度达到15~20 cm时,选取生长良好、长势较一致的植株,开始低温处理。Ⅰ)低温梯度处理设计: 参照上述用于电导率测定的低温梯度胁迫试验。将ZS7和HN1无性系置于低温人工气候箱中,从常温(RT)预冷至10 ℃左右,之后逐步降温至-2,-5,-8 ℃,在降至每个低温节点持续2 h后,各取出5株,取幼嫩枝条用锡箔纸包裹后迅速放入液氮中,置于-80 ℃超低温冰箱中保存、备用。以在常温25 ℃下同步培养的ZS7和HN1无性系作为2种低温处理的对照,取样方法同上。将每次取样的5株幼嫩枝条剪碎后混合,等分为3份作为3个重复,用于RNA的提取、qPCR试验。Ⅱ)连续低温处理设计: 将ZS7和HN1无性系各40株移入低温人工气候箱内,在-5 ℃下连续处理1,2,5,8,16,24,48,72 h,并于每个时间点分别取ZS7和HN1的5株幼嫩枝条,用锡箔纸包裹后迅速放入液氮中,置于-80 ℃超低温冰箱中保存、备用。
1.2 试验方法
1.2.1 电导率、致死温度测定 细胞膜透性测定采用电导法(刘会超等, 2008; 李迎春等, 2012)。应用Logistic方程y=k/(1+ae-bx)对处理温度和对应的相对电导率进行拟合,并得出低温半致死温度LT50(朱根海等, 1986)。式中:y为低温处理下的相对电导率;x为处理温度;k、a和b均为方程的参数,k为y的最大极限值,b反映了x和y之间的对应关系,a表示曲线对原点的相对位置。推导 Logistic 方程的二阶导数并令其为零,计算方程的拐点温度 LT50。
1.2.2 总RNA提取与cDNA合成 采用离心柱型RNA Prep Pure Plant Kit试剂盒(TIANGE,北京天根)提取短枝木麻黄幼嫩枝条的总RNA,提取方法参照试剂盒的操作说明。总RNA样品经NanoDrop 2000超微量分光光度计(Thermo Scientific,美国热电)测定浓度及纯度。将质量检测合格的总RNA样品用于qPCR反应合成cDNA。cDNA合成采用进行qPCR反应的专用逆转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)(TAKARA,大连宝生),逆转录方法参照试剂盒的操作说明。
1.2.3 qPCR候选基因与引物设计 用于qPCR分析的6个差异表达基因及特异引物见表1。选择组成型表达的UBCE(ubiquitin-conjugating enzyme)作为内参基因。特异引物的设计利用Oligo 6.54软件(MBI,USA)。引物合成由北京擎科新业生物技术(TSINGKE)有限公司完成。
1.2.4 qPCR qPCR分析在ABI ViiA7实时荧光定量PCR仪(ABI ViiA 7 Real Time PCR System,Applied Biosystems,USA)上进行,采用ABI SYBR® Select Master Mix试剂盒,方法参照试剂盒的操作说明。具体为,在20 μL的反应体系中,包含2×SYBR® Select Master Mix 10 μL、Forward Primer (10 pmol·μL-1) 1 μL、Reverse Primer (10 pmol·μL-1) 1 μL、cDNA模板1 μL、RNase Free ddH2O 7 μL。扩增程序为: 95 ℃预变性2 min; 95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸各40 s,共50个循环。每个扩增反应重复3次。扩增反应结束后利用熔解曲线检测产物特异性: 将该反应体系从60 ℃缓慢升温至95 ℃,每升高1 ℃采集5次荧光信号。
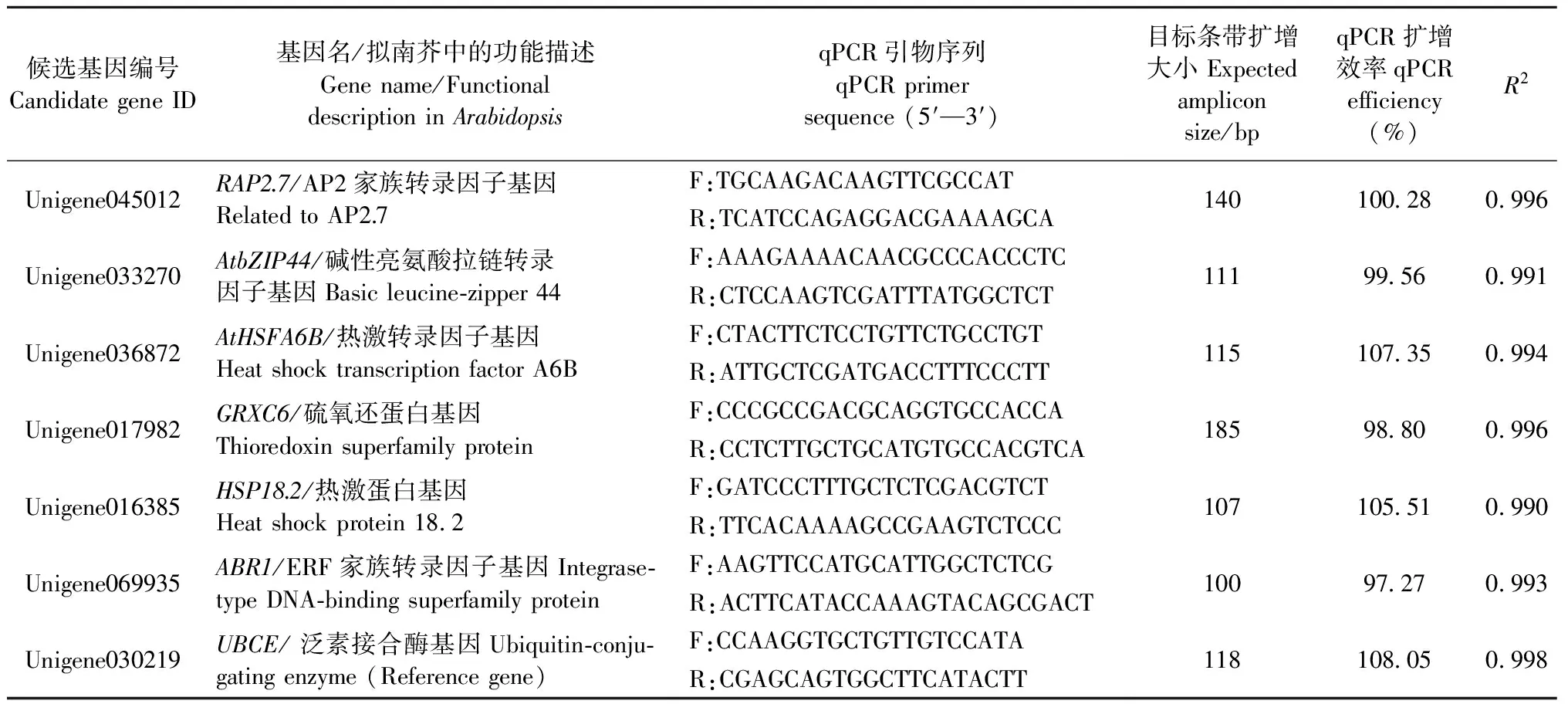
表1 用于本研究的短枝木麻黄候选基因及qPCR引物①
①R2表示标准曲线(cDNA模板浓度与CT值)的相关系数。R2represent the correlation coefficient of standard curve (cDNA templet concentration and circulated threshold).
1.3 数据分析
采用2-ΔΔCT法计算qPCR试验中的基因相对表达量,计算公式为: 基因相对表达量=2-ΔΔCT。其中,ΔΔCT计算公式为: ΔΔCT=ΔCT(试验组)-ΔCT(对照组); 试验组或对照组的ΔCT计算公式为: ΔCT=CT(目的基因)-CT(内参基因)。为了验证qPCR反应的扩增效率,将cDNA模板浓度经5倍梯度稀释,用目的基因与内参基因的qPCR引物进行扩增得到CT值,每个模板重复3次,得到标准曲线。根据标准曲线的相关系数(R2)和斜率(slope),计算得到扩增效率E=10-1-slope-1。利用Excel 2010、Origin 7.5和SPSS 18.0统计分析软件进行数据分析。
2 结果与分析
2.1 不同耐寒型短枝木麻黄无性系在低温胁迫下的相对电导率变化
低温引起的细胞膜结构破坏是导致植物低温损伤和死亡的根本原因。相对电导率可作为鉴定植物耐寒性的指标。在低温胁迫下,2种供试材料的相对电导率变化见图1。短枝木麻黄耐寒无性系ZS7和不耐寒无性系HN1叶片的相对电导率均随温度的降低而升高,总体呈S型曲线的变化趋势。在每个胁迫温度下,ZS7和HN1的相对电导率均存在极显著差异(P<0.01)。在-2 ℃到-8 ℃胁迫期间,耐寒ZS7的相对电导率上升幅度较大,在-8 ℃到-11 ℃趋于缓慢。不耐寒HN1在-2 ℃到-5 ℃相对电导率迅速升高,在-5 ℃到-11 ℃趋于缓慢。该结果表明,HN1在-5 ℃下细胞膜透性已经遭到破坏,呈不可逆的状态,而耐寒ZS7相对电导率的变化从-8 ℃才开始趋缓,表明耐寒ZS7叶片的质膜稳定性比不耐寒HN1高,受低温伤害程度较轻,体现出了较强的耐寒性。

图1 低温胁迫下2种短枝木麻黄无性系叶片的相对电导率变化Fig.1 Changes of relative electric conductivity in leaves of two Casuarina equisetifolia clones under low temperature stress同一曲线不同小写字母和大写字母分别表示该无性系叶片在不同温度下相对电导率之间差异显著(P<0.05)、极显著(P< 0.01)。Different small and capital letters in the same curve represent significant (P<0.05) and highly significant (P<0.01) difference between relative electric conductivity in leaves of the clone at various temperatures, respectively.
2.2 不同耐寒性短枝木麻黄无性系的低温半致死温度
低温半致死温度(half-lethal temperature,LT50)是指电解质渗出率达到50%时的温度,可用于评价一个物种的耐寒性强弱。表 2 所示为2种短枝木麻黄无性系的Logistic方程及低温半致死温度。耐寒无性系ZS7和不耐寒无性系HN1的拟合度分别为0.998和0.997,都达到极显著水平(P< 0.01),说明拟合的Logistic方程可靠性强。根据Logistic方程进一步计算得到ZS7和HN1的低温半致死温度(LT50)分别为-5.92 ℃和-2.87 ℃,由此进一步证明了ZS7比HN1具有更强的耐寒能力,也为后续进一步开展耐寒相关调控基因的表达模式分析提供了参考温度。

表2 低温胁迫下2种短枝木麻黄无性系相对电导率回归方程及半致死温度①
①**: 极显著差异 Highly significant (P< 0.01).
2.3 低温胁迫下各耐寒相关基因的表达分析
2.3.1 低温梯度胁迫下耐寒相关基因的表达 为了进一步了解木麻黄应答低温胁迫的分子机制,选取了在前期转录组研究中鉴定出的6个耐寒相关调控基因(Lietal., 2017),分别代表了转录因子(transcription factor)家族基因成员(包括RAP2.7,ABR1,AtHSFA6B,AtbZIP44)、ROS家族基因成员(GRXC6)和ROS应答基因(HSP18.2),基于qPCR分析耐寒相关基因的精细表达规律(表1)。本研究以ZS7和HN1的LT50(-5.92 ℃和-2.87 ℃)为参考,设置在达到LT50前的-2 ℃、-5 ℃以及降至LT50后的-8 ℃共3个低温梯度来分析各个基因表达模式。
在qPCR试验中,6个耐寒相关调控基因和1个内参基因的溶解曲线均呈单一峰值扩增。根据浓度梯度稀释扩增得出的标准曲线相关系数(R2)均大于0.99,扩增效率介于97.27%~108.05%,表明所有qPCR引物的扩增具有高特异性,且扩增效率一致,满足利用2-ΔΔCt法进行相对定量分析。
图2所示为在常温下和连续低温梯度-2,-5,-8 ℃胁迫下,6个耐寒相关基因RAP2.7,ABR1,GRXC6,AtbZIP44,AtHSFA6B和HSP18.2在耐寒无性系ZS7和不耐寒无性系HN1中的表达情况。从总体上来看,耐寒无性系ZS7中各基因(除RAP2.7基因外)在低温梯度胁迫下的表达呈现先升高后下降的变化趋势,而不耐寒无性系HN1的表达呈下降趋势。在常温条件下,这6个基因在ZS7和HN1无性系中的相对表达量皆无明显差异。在降至-2 ℃后,5个基因(ABR1,AtHSFA6B,AtbZIP44,GRXC6,HSP18.2)在ZS7中的表达量均极显著高于常温,而RAP2.7基因的表达显著降低; 6个基因在HN1的表达量均极显著低于常温; 各基因的表达量在ZS7中均极显著高于在HN1中。这表明在HN1临近半致死状态下,这6个耐寒相关基因在不耐寒种质HN1中的表达被强烈抑制,而在耐寒种质ZS7中的表达被激活,说明当外界环境从常温降到-2 ℃时,短枝木麻黄为了抵御和适应低温胁迫造成的伤害,快速启动低温应答机制,激活了耐寒相关基因的增强表达。
在降至-5 ℃后,各基因在2种无性系中的表达均被抑制,且除RAP2.7和AtbZIP44基因在ZS7和HN1中的表达量无明显差异外,其余4个基因在ZS7中的表达量均极显著高于HN1。这表明当降至临近ZS7的半致死温度下,不耐寒种质HN1中的各基因被进一步抑制,同时在耐寒种质ZS7中的表达亦被强烈抑制,这也许表明当温度继续下降至临近LT50的-5 ℃时,即短枝木麻黄处于组织所受伤害不可逆转的温度节点,低温胁迫导致细胞质膜的结构和功能受到破坏,细胞内电解质的外渗量增多,相对电导率迅速升高(图1),使其对低温胁迫的应答调控机制受到影响,导致短时间内耐寒调控基因的表达受到抑制,因而有必要对在该温度胁迫下的精细表达模式进一步研究。在降至低于半致死温度的-8 ℃后,伴随着明显冻害症状的出现,叶片严重萎蔫,各基因的表达继续受到抑制。

图2 短枝木麻黄耐寒相关基因在常温(RT)和低温梯度胁迫下的表达Fig.2 The expression of cold resistance related genes in Casuarina equisetifolia under normal(RT) and successive low temperatures**代表基因的表达在无性系ZS7和HN1之间达极显著差异(P<0.01)。** represent highly significant (P<0.01) difference between genes in two clones.

图3 短枝木麻黄耐寒相关基因在常温(RT)和连续低温(-5 ℃)胁迫下的表达模式Fig.3 The expression of cold resistance related genes in Casuarina equisetifolia under normal(RT) and low temperature (-5 ℃) conditions for 1~72 h
2.3.2 连续低温胁迫下耐寒相关基因的表达 为了进一步明确短枝木麻黄在临近半致死温度时6个耐寒相关基因的精细表达模式,对2种无性系在-5 ℃低温胁迫下持续1,2,5,8,16,24,48,72 h的表达进行比较分析。图3所示为在连续-5 ℃低温胁迫下,RAP2.7,ABR1,AtHSFA6B,AtbZIP44,GRXC6和HSP18.2基因在耐寒无性系ZS7和不耐寒无性系HN1中的表达模式。在常温条件下,各基因在ZS7和HN1无性系中的相对表达量皆无明显差异,但在-5 ℃低温胁迫下存在显著不同。在ZS7中,6个基因的表达在1~5 h内与常温没有明显差异,8 h后开始呈现极显著上调,表达量最高值集中在低温胁迫后的第8,24,48 h(图3)。而在HN1中,6个基因的表达在1~16 h内皆呈现极显著下调,表达量最低值集中在1~5 h内(图3)。就6个基因在ZS7与HN1无性系间的表达量差异而言,ABR1,GRXC6,AtHSFA6B和HSP18.2这4个基因在2 h内出现,而RAP2.7和AtbZIP44这2个基因在8 h出现。此外,6个基因的表达量最高值依次为ABR1(168)>AtbZIP44(57)>GRXC6(56)>HSP18.2(54)>AtHSFA6B(33)>RAP2.7(7),可见,ABR1基因的表达量最高,是AtbZIP44,GRXC6,HSP18.2,AtHSFA6B基因的3~5倍,RAP2.7基因的24倍(图3)。这一表达模式表明对于耐寒种质,一定时间的半致死温度胁迫激活了耐寒相关调控基因的增强表达以应对逆境; 但对于不耐寒种质,低温胁迫短时间内即抑制了耐寒相关调控基因的表达,导致其耐寒性显著降低。
3 讨论
低温半致死温度(LT50)能较准确地反映植物所能耐受的最低温度,在植物抗寒研究领域得到了广泛应用(许瑛等, 2008; 孙海伟等, 2012; 任俊杰等, 2014; Suetal., 2015)。当温度继续下降至低于LT50时,组织中液态水将迅速结冰,导致冻害发生(Rajashekaretal., 1979),植物组织所受的伤害也将不能恢复(任俊杰等, 2014)。因此LT50可以认为是植物组织所受伤害不可逆转时的转折温度,研究在LT50温度前后耐寒相关基因的表达对于探究木麻黄应对低温胁迫的分子机制具有重要意义。本研究基于LT50反映了2种不同短枝木麻黄种质在耐受低温程度上的差异,并进一步从分子水平上研究了在LT50温度胁迫前后,2种耐寒性不同的种质在6个耐寒相关基因表达上差异。在2种低温胁迫方式下,耐寒和不耐寒种质对低温的应答机制明显不同,在LT50前后,6个耐寒相关基因在不耐寒短枝木麻黄种质中的表达一直被强烈抑制,而在耐寒种质中,5个基因(除RAP2.7外)的表达都呈现先升高后下降的变化趋势。此外,当临近LT50的-5 ℃时,尽管短时间的低温胁迫暂时抑制了耐寒种质中5个基因(除RAP2.7外)的表达,但在胁迫达到8 h后再次增强表达,并一直持续至48 h。这表明未经过耐寒锻炼的短枝木麻黄种质,缺乏抵御低温胁迫的内在调控机制,而耐寒短枝木麻黄种质经过长期的低温适应,形成了一系列由调控基因介导的耐寒调节机制,尤其在组织受到不可逆转伤害的温度节点,该机制被充分调动,以提高自身的抗逆性。
为了适应各种生物与非生物逆境胁迫,植物启动了多种防御性机制。由转录因子介导的信号传导是最为快速有效的防御应答反应之一,构成了植物复杂调控网络的重要组成部分(Leeetal., 2005; Ashraf, 2010)。在本研究中,-5 ℃持续低温胁迫显著诱导了耐寒短枝木麻黄ZS7中ABR1、AtbZIP44和AtHSFA6B这3个转录因子基因的增强表达,其中AtHSFA6B基因的表达量在8 h达到最高,ABR1和AtbZIP44基因则在24 h之后。这表明不同转录因子响应低温的速度与强度不同,且发挥最大调节作用的时间也不一致。此外,这3个基因的表达量均呈现先升高后下降的变化规律,这可能是由于它们被诱导表达后激活了下游一系列抗逆相关基因的表达,调节植物体内各种生理生化反应,从而提高木麻黄对低温胁迫的抗性。而后期表达量下降的原因,可能与已经对胁迫环境适应有关,也可能体现了转录因子基因的诱导受胁迫时间的限制,超过一定的时间,表达逐渐受到抑制,对低温的耐受能力也逐渐降低(杨帆等, 2010)。这种随逆境胁迫时间的持续,转录因子基因先升高后下降的表达模式也在对构树(Broussonetiapapyrifera)耐盐(杨帆等, 2010)、水稻(Oryzasativa)耐低温(Liuetal., 2012)和胡杨(Populuseuphratica)耐盐(Shenetal., 2013)等的研究上得到了相似结果。
AP2/ERF家族的转录因子处于调控网络的节点(Xuetal., 2011; Zhuangetal., 2011),主要通过激活冷诱导基因(cold regulated,COR)、应答脱水基因(responsive to dehydration,RD)等一系列下游冷调节基因的表达来增强对低温逆境的适应。不同于AP2/ERF家族中的大多数成员,AP2型基因RAP2.7隶属该家族中DREB亚家族转录因子A-5亚组基因,为EAR(ERF-associated amphiphilic repression)型转录抑制子(Dongetal., 2010),其过量表达会导致植物耐受性降低,而缺失突变体植株则会对逆境的耐受性增强(Tsutsuietal., 2009; Yaishetal., 2009)。在本研究中,-2 ℃的低温对耐寒相关基因RAP2.7具有负调控作用,在-5 ℃持续低温胁迫下,其表达量也远远低于其他5个基因。RAP2.7基因在耐寒短枝木麻黄中的这一低温应答模式表明,在低温逆境的应答上,一些AP2型基因成员的转录调控机制不同于ABR1、AtHSFA6B和AtbZIP44,耐寒短枝木麻黄是通过这些AP2型转录因子在低温胁迫下的负调控作用来增强其对低温的耐受性。AP2/ERF 类转录因子基因家族成员在不同植物中存在的数量及类型不同(Velascoetal., 2010)。在前期对耐寒型短枝木麻黄的转录组研究中,初步鉴定出了18个在低温胁迫下差异表达的AP2/ERF类转录因子成员,其中11个上调、7个下调(Lietal., 2017)。因此为了全面了解AP2型转录因子在低温逆境下的转录调控机制,有必要对这些AP2型成员的精细表达模式进一步研究。
低温诱导了植物体内活性氧(reactive oxygen species, ROS)的大量产生,进而从根本上导致氧化胁迫,对植物组织内的蛋白、脂类、碳水化合物和核酸造成巨大伤害。在氧化胁迫下,植物细胞的抗氧化防御系统随之被激活,通过清除ROS以抵御氧化胁迫导致的伤害(Gilletal., 2010)。硫氧还蛋白GRXC6属于抗氧化酶类ROS家族的成员,热激蛋白基因HSP18.2是ROS应答基因(Lietal., 2017)。本研究显示在-5 ℃的低温诱导下,GRXC6在48 h达到最高表达量,HSP18.2在8~48 h一直维持较高的表达量,这表明在低温胁迫下,耐寒短枝木麻黄种质通过诱导ROS家族基因和ROS应答基因的上调表达来调整增强ROS清除能力,进而减轻氧化胁迫导致的伤害,提高其抗氧化能力以适应逆境。植物参与不同逆境胁迫响应的基因之间存在复杂的互作关系(Huangetal., 2012)。热激转录因子HSF是植物热激响应的主要控调因子,在逆境胁迫下与热激元件(heat shock element,HSE)识别并特异结合,从而激活下游基因HSP的转录和表达(Pelham, 1982),对植物抵抗逆境伤害和其他生命活动具有关键作用(Baniwaletal., 2004)。在本研究中,HSP18.2和AtHSFA6B具有同步一致的表达模式,均在8~48 h持续高表达,这可能预示了在低温胁迫早期,AtHSFA6B基因的高表达迅速启动了对下游HSP18.2的调控机制,以增强短枝木麻黄低温逆境的耐受能力。
4 结论
在耐寒相关调控基因的表达水平上,耐寒和不耐寒短枝木麻黄种质对低温的应答机制明显不同。低温激活了耐寒种质中转录因子、ROS家族基因、ROS应答因子等调控基因的增强表达以抵御和适应逆境胁迫,但抑制了在不耐寒种质中的表达,显著降低了不耐寒种质对低温逆境的耐受能力。这在一定程度上对于丰富木麻黄适应低温的分子机制,以及耐寒无性系的分子选育都具有一定的参考价值。显然,要全面深入解析木麻黄耐寒的分子机制,还需要增加更多耐寒相关候选基因的表达模式研究,并进一步开展功能分析研究。为此,克隆基因全长、构建木麻黄功能基因超表达载体、建立遗传转化体系等,将是在本研究基础上继续跟进的工作。
陈 彦,王国明,周 坚.2005.木麻黄抗逆性研究进展.植物学通报,22(6): 746-752.
(Chen Y, Wang G M, Zhou J. 2005. Advances in the study of stress resistance ofCasuarinaequisetifolia. Chinese Bulletin of Botany, 22(6): 746-752. [in Chinese])
何贵平,卓仁英,陈雨春,等.2011.低温处理对耐寒粗枝木麻黄无性系生理指标的影响. 林业科学研究,24 (4): 523-526.
(He G P, Zhuo R Y, Chen Y C,etal. 2011. Effect of low temperature on physiological index of cold-tolerantCasuarinaglaucaclones. Forest Research, 24 (4): 523-526. [in Chinese])
柯玉铸,黄金水,蔡美仁,等. 2000.木麻黄小枝水培容器苗培育技术总结.浙江林业科技, 20(6): 39-42.
(Ke Y Z, Huang J S, Can M R,etal. 2000. Report of technology of water planting of branchlet container seedling ofCasuarinaequisetifolia. Journal of Zhejiang Forestry Science and Technology, 20(6): 39-42. [in Chinese])
李迎春,陈双林,郭子武,等. 2012.模拟低温或自然低温条件下牡竹属3种类抗寒性及生理指标的比较.植物资源与环境学报,21 (3): 13-19.
(Li Y C, Chen S L, Guo Z W,etal. 2012. Comparison of cold resistance and physiological indexes of three species inDendrocalamusNees under simulated or natural low temperature conditions. Journal of Plant Resources and Environment, 21(3): 13-19.[in Chinese])
刘会超,贾文庆. 2008.盐胁迫对白三叶幼苗叶片叶绿素含量和细胞膜透性的影响.广东农业科学,(12): 58-60.
(Liu H C, Jia W Q.2008. Study on some physiological characteristics ofTrifoliumrepensleaves under salt stress. Guangdong Agricultural Sciences, (12): 58-60. [in Chinese])
任俊杰,赵 爽,李美美,等. 2014. 不同核桃品种抗霜冻能力的评价.林业科学,50 (9): 67- 72.
(Ren J J, Zhao S, Li M M,etal. 2014. Evaluation of frost resistance ability of different Walnut cultivars. Scientia Silvae Sinicae, 50(9): 67-72. [in Chinese])
孙海伟,刘 静,宋 健,等. 2012. 转AmGS基因红叶石楠的分子检测及抗寒性分析. 林业科学,48(7): 30-38.
(Sun H W, Liu J, Song J,etal. 2012. Molecular identification and cold-resistance analysis of theAmGStransgenicPhotinia×fraseri‘Red Robin’ plants. Scientia Silvae Sinicae, 48(7):30-38. [in Chinese])
王 泳,高智慧,彭华正,等. 2005.几种按树、木麻黄苗期耐寒性研究初报.防护林科技,(增刊): 1-3.
(Wang Y, Gao Z H, Peng H Z,etal. 2005. Preliminary report on cold resistance of several species ofEucalyptusandCasuarinaequisetifoliain their seedling stages. Protection Forest Science and Technology, (Suppl.): 1-3. [in Chinese])
武 冲,张 勇,马 妮,等.2012. 接种菌根菌短枝木麻黄对低温胁迫的响应特征.西北植物学报,32 (10): 2068-2074.
(Wu C, Zhang Y, Ma N,etal. 2012. Response characteristics ofCasuarinaequisetifoliainoculated with mycorrhizal fungi under low temperature stress. Acta Botanica Boreali-Occidentalia Sinica, 32 (10): 2068-2074. [in Chinese])
邬 金,温国胜,王电杰,等. 2013. 低温胁迫下7种木麻黄变异类型抗寒性的比较. 福建林学院学报,33 (1): 34-37.
(Wu J, Wen G S, Wang D J,etal. 2013.Comparison of cold resistance characteristics in 7 variations ofCasuarinaequisetifolia. Journal of Fujian College of Forestry, 33 (1): 34-37. [in Chinese])
z′x′=S51x2+S52xy+S53y2+S54yz+S55z2+(1+S56)zx+S57x+S58y+S59z+S60+o(h2)
许 瑛,陈发棣. 2008. 菊花8个品种的低温半致死温度及其抗寒适应性. 园艺学报,35 (4): 559-564.
(Xu Y, Chen F D. 2008. The LT50and cold tolerance adaptability of Chrysanthemum during a natural drop in temperature. Acta Horticulturae Sinica, 35(4): 559-564. [in Chinese])
薛 扬,王小燕,韩成吉,等.2012.木麻黄育苗技术与早期生长效果研究. 热带林业,40 (3): 28-31.
(Xue Y, Wang X Y, Han C J,etal. 2012. Research ofCasuarinaseedling technique and early growth effect. Tropical Forestry, 40 (3):8-31. [in Chinese])
薛 扬,仲崇禄,方发之,等.2008.海南木麻黄无性系选择研究.热带林业,36 (1): 21-24.
(Xue Y, Zhong C L, Fang F Z,etal. 2008. Selection ofCasuarinaclones in Hainan. Tropical Forestry, 36 (1): 21-24. [in Chinese])
杨 帆,丁 菲,杜天真.2010. 盐胁迫下构树DREB转录因子基因表达的实时荧光定量PCR分析.林业科学,46(4): 146-150.
(Yang F, Ding F, Du T Z. 2010. DREB gene expression in leaves ofBroussonetiapapyriferaseedlings under salt stress detected by real-time fluorescent quantitative PCR. Scientia Silvae Sinicae, 46(4): 146-150. [in Chinese])
叶功富,罗美娟,林金木.2004.短枝木麻黄在福建东山试点的种源试验结果分析与选择.北京林业大学学报,26 (6): 6-11.
(Ye G F, Luo M J, Lin J M. 2004. Analysis and selection on provenance trials ofCasuarinaequisetifoliaat Dongshan, Fujian Province. Journal of Beijing Forestry University, 26 (6): 6-11. [in Chinese])
叶功富,郑 锟,徐俊森,等. 2008.沿海木麻黄防护林不同配置模式的防护效应. 海峡科学,(10): 93-95.
(Ye G F, Zheng K, Xu J S,etal. 2008. Protective effect of different configuration patterns of coastalCasuarinaequisetifoliashelter forest. Straits Science, (10): 93-95. [in Chinese])
张 昕,马新颖,王秋芹,等.2011.木麻黄共生固氮菌Frankia的分离鉴定及固氮效应.生态学杂志,30 (9): 1975-1981.
(Zhang X, Ma X Y, Wang Q Q,etal. 2011. Identification and nitrogen fixation effect of symbioticFrankiaspp. isolated fromCasuarinaspp. Chinese Journal of Ecology, 30 (9): 1975-1981. [in Chinese])
张 勇,仲崇禄,陈 羽,等.2011.海南5年生木麻黄优良无性系的选择与评价.南京林业大学学报: 自然科学版,35 (5): 25-30.
(Zhang Y, Zhong C L, Chen Y,etal. 2011. Evaluation and selection of superiorCasuarinaclones in Hainan. Journal of Nanjing Forestry University: Natural Sciences, 35(5):25-30. [in Chinese])
张云生,陆云妹. 2002.木麻黄北移引种驯化技术.林业实用技术,(7): 25.
(Zhang Y S, Lu Y M. 2002. Domestication technology ofCasuarina. Practical Forestry Technology, (7): 25. [in Chinese])
仲崇禄,白嘉雨. 1998.山地木麻黄家系遗传参数估算与家系选择.林业科学研究,11 (4): 361-369.
(Zhong C L, Bai J Y. 1998. Estimation of genetic parameters and screening of families forCasuarinajunghuhniana. Forest Research, 11 (4): 361-369. [in Chinese])
仲崇禄,白嘉雨,张 勇.2005.我国木麻黄种质资源引种与保存. 林业科学研究,18 (3): 345-350.
(Zhong C L, Bai J Y, Zhang Y. 2005. Introduction and conservation ofCasuarinatrees in China. Forest Research, 18 (3): 345-350. [in Chinese])
朱根海,刘祖祺,朱培仁.1986.应用Logistic方程确定植物组织低温半致死温度的研究.南京农业大学学报,9 (3): 11-16.
(Zhu G H, Liu Z Q, Zhu P R.1986. Measurement of coldness by electrical conductivity method in associated with the Logistic equation in plant tissue. Journal of Nanjing Agricultural University, 9 (3):11-16. [in Chinese])
Ashraf M. 2010. Inducing drought tolerance in plants: recent advances. Biotechnology Advances, 28: 169-183.
Baniwal S K, Bharti K, Chan K Y,etal. 2004. A heat stress response in plants: a complex game with chaperones and more than twenty heat stress transcription factors. Journal of Biosciences, 29(4): 471-487.
Dong C J, Liu J Y. 2010.TheArabidopsisEAR-motif-containing proteinRAP2.1 functions as an active transcriptional repressor to keep stress responses under tight control. BMC Plant Biology, 10(1): 47.
Duke J A.1983.CasuarinaequisetifoliaJ. R. and G. Forst. Center for New Crops and Plant Products, Purdue University.
Gill S, Tuteja N. 2010. Reactive oxygen species and antioxidant machinery in abiotic stress. Plant Physiology and Biochemistry, 48: 909-930.
Huang G T,Ma S L,Bai L P,etal. 2012. Signal transduction during cold, salt, and drought stresses in plants. Molecular Biology Reports, 39(2): 969-987.
Lee B, Henderson D, Zhu J. 2005. TheArabidopsiscold-responsive transcriptome and its regulation by ICE1. Plant Cell, 17: 3155-3175.
Li H, Li N, Yang S,etal. 2017. Transcriptomic analysis ofCasuarinaequisetifoliaL. in responses to cold stress. Tree Genetics & Genomes, 13(1): 7.
Li D, Deng Z, Qin B,etal. 2012. De novo assembly and characterization of bark transcriptome using Illumina sequencing and development of EST-SSR markers in rubber tree (HeveabrasiliensisMuell. Arg.). BMC Genomics, 13:192. doi: 10.1186/1471-2164-13-192.
Liu C, Wu T, Wang Y B. 2012.XPbZIPtranscription factorOsbZIP52/RISBZ5: a potential negative regulator of cold and drought stress response in rice. Planta, 235(6):1157-1169.
Marioni J C, Mason C E, Mane S M,etal. 2008. RNA-Seq: an assessment of technical reproducibility and comparison with gene expression arrays. Genome Research, 18:1509-1517.
Pelham H R B. 1982. A regulatory upstream promoter element in theDrosophilaHsp70 heat-shock gene. Cell, 30(2): 517-528.
Rajashekar C, Gusta L, Burke M.1979. Membrane structural transitions: probable relation to frost damage in hardy herbaceous species. Low Temperature Stress in Crop Plants, 255-274.
Shen Z D, Ding M Q, Sun J,etal. 2013. Overexpression of PeHSF mediates leaf ROS homeostasis in transgenic tobacco lines grown under salt stress conditions. Plant Cell, Tissue and Organ Culture, 115(3):299-308.
Su L Y, Dai Z W, Li S H,etal. 2015. A novel system for evaluating drought-cold tolerance of grapevines using chlorophyll fluorescence. BMC Plant Biology, 15(1): 82. doi: 10.1186/s12870-015-0459-8.
Tian D Q, Pan X Y, Yu Y M,etal. 2013. De novo characterization of theAnthuriumtranscriptome and analysis of its digital gene expression under cold stress. BMC Genomics, 14(1): 827. doi: 10.1186/1471-2164-14-827.
Torales S L, Rivarola M, Pomponio M F,etal. 2013. De novo assembly and characterization of leaf transcriptome for the development of functional molecular markers of the extremophile multipurpose tree speciesProsopisalba. BMC Genomics, 14(1): 705. doi: 10.1186/1471-2164-14-705.
Tsutsui T, Kato W, Asada Y,etal. 2009. DEAR1, a transcriptional repressor of DREB protein that mediates plant defense and freezing stress responses inArabidopsis. Journal of Plant Research, 122(6): 633-643.
Velasco R, Zharkikh A, Affourtit J,etal. 2010. The genome of the domesticated apple (Malus×domesticaBorkh.). Nature Genetics, 42(10): 833-839.
Wang J M, Wang Q, Yang Y,etal. 2014. De novo assembly and characterization of stress transcriptome and regulatory networks under temperature, salt and hormone stresses inLiliumlancifolium. Molecular Biology Reports, 41(12): 8231-8245.
Wilson J L, Johnson L A S. 1989. Casuarinaceae∥Flora of Australia, Hamamelidales to Casuarinales. Canberra: Australian Government Publishing Service, 100-203.
Xu Z, Chen M, Li L,etal. 2011. Functions and application of the AP2/ERF transcription factor family in crop improvement. Journal of Integrative Plant Biology, 53(7): 570-585.
Yaish M W, Elkereamy A, Zhu T,etal. 2009. The APETALA-2-like transcription factor OsAP2-39 controls key interactions between abscisic acid and gibberellin in rice. PLoS Genetics, 6(9): e1001098.
Zhong C L, Zhang Y, Chen Y,etal. 2010.Casuarinaresearch and applications in China. Symbiosis, 50(1):107-114.
Zhuang J, Yao Q, Xiong A,etal. 2011. Isolation, phylogeny and expression patterns of AP2-like genes in apple (Malus×domesticaBorkh). Plant Molecular Biology Reporter, 29(1): 209-216.
(责任编辑 徐 红)
Analysis on Differential Expression of Cold Resistance Related Genes ofCasuarinaequisetifoliaunder Low Temperature Stress
Li Nan1,2Zheng Yongqi1Ding Hongmei3Liu Xinhong2Sheng Weitong1Jiang Bo2Li Haibo2
(1.KeyLaboratoryofTreeBreedingandCultivationofStateForestryAdministrationResearchInstituteofForestry,ChineseAcademyofForestryBeijing100091; 2.ZhejiangAcademyofForestryHangzhou310023; 3.ZhejiangChineseMedicalUniversityHangzhou310053)
【Objective】 The expression patterns of 6 cold resistance related genes (RAP2.7,ABR1,AtHSFA6B,AtbZIP44,GRXC6 andHSP18.2) in cold-tolerant and cold-intolerantCasuarinaequisetifoliawere analyzed in order to provide a theoretical basis for elucidating the molecular mechanism ofCasuarinatrees in response to cold stress.【Method】 The relative conductivity in cold-tolerant (ZS7) and cold-intolerant (HN1) clones ofC.equisetifoliawere measured under low temperature stresses at -2--11 ℃. The low half-lethal temperature (LT50) were calculated by fitting the temperature with the relative conductivity based on the logistic equation. Quantitative Real-Time PCR (qPCR) was employed to investigate the differential expression of the 6 cold resistance related genes in cold-tolerant and cold-intolerant clones under successive low temperature stresses at -2, -5 and -8 ℃, as well as precise expression patterns under low temperature stresses at -5 ℃ for 1, 2, 5, 8, 16, 24, 48 and 72 h. The specific primers for qPCR were designed based on the EST sequences of 6 cold resistance related genes identified from previous transcriptome analysis. Analysis of relative gene expression data was performed using 2-ΔΔCTmethod.【Result】 Under low temperature stresses, relative conductivity in cold-tolerant and cold-intolerant clones had a very highly significant difference (P<0.01), LT50was -5.92 ℃ and -2.87 ℃, respectively. Under normal temperature condition, the relative expression of all the 6 genes in 2 clones had no significant differences. However, under low temperature stress at -2 ℃ for 2 h, which was close to the LT50of cold-intolerant clone, expression of these genes in the cold-intolerant clone were strongly inhibited, while in the cold-tolerant clone were activated. Under low temperature stress at -5 ℃ for 2 h, which was close to the LT50of the cold-tolerant clone, expression of these genes were further inhibited in the cold-intolerant clone, also in the cold-tolerant clone. Under low temperature stress at -8 ℃ for 2 h, which was lower than the LT50, the expression of all 6 genes in 2 clones were inhibited continuously. The precise expression patterns analysis revealed that the expression of all 6 genes were significantly up-regulated in the cold-tolerant clone under low temperature stress at -5 ℃ for 8 h, reaching the maximum at 8 h, 24 h and 48 h, and significantly down-regulated in the cold-intolerant clone at 1-16 h, reaching the minimum at 1-5 h.【Conclusion】 On the expression level of cold resistance related genes, different clones showed significantly different responding mechanisms to low temperature stress. Low temperature induces the expression of genes belonging to transcription factors and ROS family, and genes related with the response to ROS in cold-tolerantC.equisetifoliato resist or adapt to cold stress, instead it was inhibited in the cold-intolerantC.equisetifolia, thus significantly decreased its adaptation to cold stress. This study provided a useful basis for enriching the molecular mechanism ofCasuarinatrees in coping with cold stress, and for molecular selection and breeding of cold-tolerantCasuarinaclones.
Casuarinaequisetifolia; low temperature stress; cold tolerance; gene expression; molecular breeding
10.11707/j.1001-7488.20170707
2017-03-10;
2017-06-01。
浙江省农业(林木)新品种选育重大科技专项(2016C02056-9)。
S718.46
A
1001-7488(2017)07-0062-10
*李海波为通讯作者。
