119例艾滋病患者并发药物性肝损伤的临床特点及预后分析
2017-08-30杨君洋齐唐凯张仁芳沈银忠纪永佳卢洪洲
杨君洋, 齐唐凯, 张仁芳, 刘 莉, 沈银忠, 纪永佳, 卢洪洲
(1 温州医科大学, 浙江 温州 325000; 2 复旦大学附属上海市公共卫生临床中心, 上海 201508)
119例艾滋病患者并发药物性肝损伤的临床特点及预后分析
杨君洋1,2, 齐唐凯2, 张仁芳2, 刘 莉2, 沈银忠2, 纪永佳2, 卢洪洲1,2
(1 温州医科大学, 浙江 温州 325000; 2 复旦大学附属上海市公共卫生临床中心, 上海 201508)
目的 探讨AIDS患者发生药物性肝损伤(DILI)的临床特点及预后。方法 收集2014年1月-2015年12月在上海市公共卫生临床中心感染一科确诊为AIDS并符合DILI诊断的患者119例。分析患者用药情况、CD4+T淋巴细胞计数、临床表现、肝脏生化指标、治疗方法、肝损伤持续时间及预后,并对患者DILI进行分型及分级,观察不同药物导致的DILI对肝生化指标的影响。计量资料2组间比较采用Wilcoxon秩和检验,多组间比较采用Kruskal-WallisH检验;计数资料组间比较采用χ2检验。结果 58例已接受高效抗逆转录病毒治疗患者的肝损伤分级(χ2=15.756,P<0.001)、TBil水平(Z=-3.466,P=0.010)及Alb水平(Z=-1.968,P=0.049)明显高于61例未接受高效抗逆转录病毒治疗的患者;已明确导致患者DILI的药物种类中8例为抗真菌药物、41例为抗细菌药物、18例为抗结核药物、24例为抗病毒药物,抗结核药物较其他3种药物所致DILI患者的TBil水平更高(H=12.804,P=0.005),抗细菌药物及抗结核药物所致DILI的Alb水平低于其他2组(H=14.236,P=0.003),抗结核药物及抗病毒药物造成的肝损伤等级明显高于抗细菌药物和抗真菌药物(χ2=16.373,P=0.008)。肝细胞损伤型患者住院治疗时间较短(χ2=8.046,P=0.045);高水平ALP、低水平ALT提示需较长时间住院治疗(Z值分别为-2.943、-2.592,P值均<0.05)。结论 AIDS患者用药复杂,易并发DILI,高效抗逆转录病毒治疗可在一定程度上加重肝损伤,但对患者预后影响不明显。临床用药过程中应定期检查肝功能,实时了解肝脏炎症活动状态,有助于减少AIDS患者的DILI发生率。
获得性免疫缺陷综合征; 药物性肝损伤; 预后
药物性肝损伤(DILI)是指由各类处方或非处方的化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物乃至辅料等所诱发的肝损伤[1]。AIDS患者除需接受高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART)外,还常因各种并发症使用其他治疗药物,用药复杂。据世界卫生组织统计,截至2015年底全球大约有36 700 000例AIDS患者,其中17 000 000例AIDS患者接受HAART。约14%~20%的AIDS患者在接受HAART后可出现转氨酶升高,其中2%~10%的AIDS患者因严重的肝功能异常而需暂停HAART[2-3]。掌握AIDS患者发生DILI的临床表现、导致肝损伤的常见药物以及肝损伤的临床转归,对于临床医生具有较强的指导意义。
1 资料与方法
1.1 研究对象 回顾性收集2014年1月-2015年12月入住上海市公共卫生临床中心感染一科的确诊为AIDS并符合DILI诊断的患者。
1.2 DILI的诊断、分型与分级
1.2.1 DILI诊断 (1)发病前药物使用史;(2)ALT≥3倍正常值上限(ULN)或ALP≥2×ULN,且RUCAM因果关系评估表总分≥6分;(3)排除甲、乙、丙、丁、戊型肝炎病毒感染;(4)排除胆道梗阻性疾病及自身免疫性肝炎;(5)排除酒精中毒史;(6)排除近期有低血压、休克或肝脏缺血史[1]。
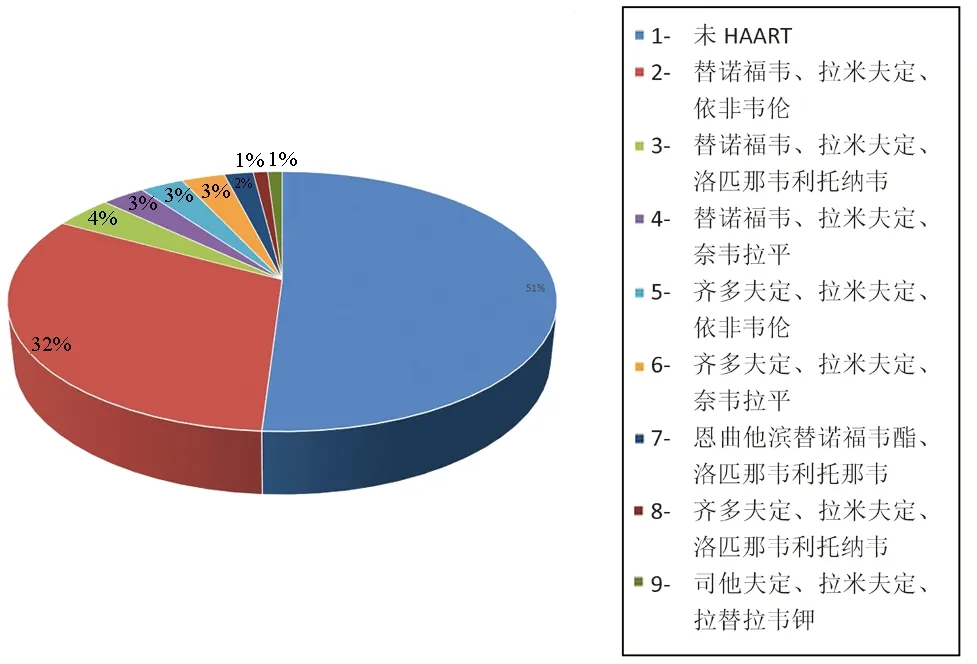
1.2.2 DILI临床分型及分级 根据国际医学组织理事会[4]推荐的DILI分型标准分为3型:(1)肝细胞损伤型:ALT≥3×ULN,且R[R=(ALT实测值/ALT ULN)/(ALP实测值/ALP ULN)]≥5分;(2)胆汁淤积型:ALP≥2×ULN,且R≤2;(3)混合型:ALT≥3×ULN,ALP≥2×ULN,且2 根据2015年版《药物性肝损伤诊治指南》[1]的分级标准将急性DILI分为5级:(1)0级(无肝损伤):患者对暴露药物可耐受,无肝毒性反应;(2)1级(轻度肝损伤):血清ALT和(或)ALP呈可恢复性升高,TBil<2.5×ULN(2.5 mg/dl或42.75 μmol/L),且INR<1.5。多数患者可适应。可有或无乏力、虚弱、恶心、厌食、右上腹痛、黄疸、瘙痒、皮疹或体质量减轻等症状;(3)2级(中度肝损伤):血清ALT和(或)ALP升高,TBil≥2.5×ULN,或虽无TBil升高但INR≥1.5,上述症状可有加重;(4)3级(重度肝损伤):血清ALT和(或)ALP升高,TBil≥5×ULN(5 mg/dl或85.5 μmol/L),伴或不伴INR≥1.5。患者症状进一步加重,需要住院治疗或住院时间延长;(5)4级(急性肝衰竭):血清ALT和(或)ALP升高,TBil≥10×ULN(10 mg/dl或171 μmol/L)或每天上升≥1.0 mg/dl(17.1 μmol/L),伴或不伴INR≥2.0或PTA<40%,可同时出现腹水或肝性脑病,或与DILI相关的其他器官功能衰竭。(6)5级(致命):因DILI死亡,或需接受肝移植才能存活。 1.3 研究方法 记录所有入选患者的性别、年龄、用药情况、CD4+T淋巴细胞计数、临床表现、肝脏生化指标、治疗方法、肝损伤持续时间及预后,并对DILI进行分型及分级,观察不同药物导致的DILI对肝生化指标的影响。 1.4 统计学方法 采用SPSS24.0统计学软件进行数据处理。计数资料采用χ2检验进行比较。不符合正态分布的计量资料采用中位数和四分位数间距[M(P25~P75)]表示,采用Kruskal-WallisH检验比较不同肝损伤药物与肝生化指标的关系;Wilcoxon秩和检验比较HAART与肝生化指标、住院治疗时间的关系,以及住院治疗时间与肝生化指标、年龄、CD4水平的关系。P<0.05为差异有统计学意义。 2.1 一般资料 2460例AIDS患者中合并DILI 119例(4.84%),其中男110例,女9例,年龄18~72岁,中位年龄34岁。因DILI 2次住院的患者6例。发生DILI但尚未开始HAART的患者61例,接受HAART者58例,具体HAART方案见图1。119例患者中肝细胞损伤型51例、胆汁淤积型38例、混合型8例、无法分型22例;按照DILI分级,1级肝损伤101例、2级肝损伤9例、3级肝损7例、4级肝损2例、5级肝损0例。 图1 HAART治疗方案组成分布 2.2 患者DILI发生时间及主要临床症状 患者首次用药后至出现DILI的时间短则1 d,长则1年以上,中位时间13 d。119例患者中31例在应用可疑药物后1周内发生肝损伤,37例在用药后1~2周发生肝损伤,27例在用药后2周~1个月发生肝损伤,11例在用药后1~2个月发生肝损伤,4例在用药后2~3个月发生肝损伤,9例在用药后3个月以上发生肝损伤。 DILI的临床表现主要包括发热、皮疹、恶心、呕吐、纳差、乏力、皮肤巩膜黄染,腹泻、腹痛等全身症状,少数患者还可出现呃逆、胸闷、头痛、皮肤瘙痒、皮肤瘀点、头晕等,82例(68.91%)患者具有临床表现,另有37例(31.09%)患者未见无明显的临床症状,仅表现为肝功能异常(表1)。 表1 DILI的临床表现[例(%)] 2.3 HAART接受者和未接受者DILI分级、肝生化指标及预后 已接受HAART患者的肝损伤分级、TBil水平及Alb水平均明显高于未接受HAART患者(P值均<0.05)(表2)。 表2 HAART接受者和未接受者DILI分级、肝生化指标及预后的比较 注:预后不良包括无好转、病重自动出院及死亡 2.4 导致DILI的药物 导致患者发生DILI的药物主要分为抗细菌药物、抗病毒药物、抗结核药物、抗真菌药物、肿瘤化疗药物以及其他。涉及的药物主要包括复方磺胺甲恶唑(34/119,28.57%)、依非韦伦(20/119,16.81%)、吡嗪酰胺(16/119,13.45%)、利福布汀(15/119,12.61%)、氟康唑(13/119,10.92%)、拉米夫定(12/119,10.08%)、利福平(11/119,9.24%)、替诺福韦(11/119,9.24%)、左氧氟沙星(9/119、7.56%)、异烟肼(8/119,6.72%)、乙胺丁醇(8/119,6.72%)、奈韦拉平(7/110,5.88%)等(图2)。 图2 导致DILI的不同药物组成分布 2.5 不同药物所致DILI患者的肝生化指标及严重程度 ALT异常患者共109例,其中96例ALT≥120 U/L,最大值为1692 U/L,中位数为190 U/L;AST异常患者共109例,其中70例AST≥120 U/L,最大值为2607 U/L,中位数为137 U/L;ALP异常患者共81例,其中52例ALP≥250 U/L,最大值为863 U/L,中位数为203 U/L;TBil异常患者共40例,最大值为194 μmol/L,中位数为11.1 μmol/L;Alb异常患者共100例,最小值为14.8 g/L,平均值为31.8 g/L;CD4计数中位数为33个/μl,最大值为1579个/μl,最小值为1个/μl,其中25例患者CD4计数≤10个/μl,10个/μl<46例≤50个/μl,50个/μl<16例≤100个/μl,100个/μl<15例≤200个/μl,200个/μl<10例≤500个/μl,2例>500个/μl。 抗结核药物所致DILI较其他3种药物所致DILI的TBil水平更高(P<0.05),抗细菌药物及抗结核药物所致DILI的Alb水平低于其他2组(P<0.05),抗结核药物及抗病毒药物造成的肝损伤等级明显高于抗细菌药物和抗真菌药物(P<0.05)(表3)。 2.6 预后及不同住院时间患者各项指标的比较 嘱患者卧床休息,加用保肝药物治疗,停用可能导致肝损伤药物(少数肝功能损伤较轻的患者未停用)。119例患者中52例肝功能完全恢复正常;53例症状或肝功能有所好转;7例病情无明显好转,要求出院或转他院治疗;5例因病情危重放弃治疗,要求自动出院;2例死亡(死因为严重感染导致的多器官功能衰竭)。在院治疗肝损伤时间为3~80 d,中位治疗时间为13 d,其中34例≤7 d,7 d<42例≤15d,15 d<33例≤30 d,10例>30 d。 发生肝损伤患者的最终临床转归与导致DILI的药物种类、是否接受HAART、肝损伤类型、肝生化指标、CD4水平、年龄之间均无明显关系(P值均>0.05)。肝细胞损伤型患者住院治疗时间较短(P=0.045);高水平ALP、低水平ALT提示需较长时间住院治疗(P值均<0.05)(表4)。 表3 不同药物所致DILI患者肝生化指标及严重程度的比较 表4 不同住院时间患者各项指标的比较 AIDS患者发生DILI与患者的种族、性别、年龄、基因型、免疫功能状态、血浆Alb水平、Hb浓度、HIV RNA水平、BMI、饮酒情况以及应用的药物等有关[5-6]。一旦AIDS并发DILI,即出现与原发病治疗相矛盾的情况,严重影响AIDS患者的预后。本研究针对AIDS患者的DILI发生率及临床特征进行详细分析,结果显示DILI发生率为4.84%,,远大于正常人群的DILI发生率(19.1/1 000 000)[7],但稍低于国外的研究结果(7.8%)[8],原因可能在于该项国外研究的HAART方案中均包含依非韦伦,而本研究中部分患者使用的是肝损伤较小的整合酶抑制剂,从而使DILI发生率降低。对不同药物所致肝损伤分级和生化指标分别进行统计分析发现,抗结核药造成DILI的TBil水平明显高于其他药物,抗细菌及抗结核药物造成DILI的Alb水平明显低于其他药物,抗结核药物及抗病毒药物造成的肝损伤的分级明显高于抗细菌药物和抗真菌药物,该结果对临床医生明确DILI的病因具有一定的指导意义。 119例DILI患者中肝细胞损伤型的比例最高,与既往报道的AIDS患者DILI临床分析中所见一致[9],原因在于药物摄入体内后绝大部分经肝脏代谢,通过肝内细胞色素P450的药酶作用,使药物代谢转化成为部分毒性产物,造成肝细胞坏死或脂肪变性。同时,药物本身或其代谢产物影响肝细胞代谢和胆汁分泌的某些环节,也会引起肝细胞损伤或胆汁分泌障碍[10],因此在观察DILI分型时,肝细胞损伤型最为多见。 AIDS患者免疫功能极度低下,常因各种并发症(如结核病、肺部感染、中枢神经系统感染、肿瘤等)入院治疗,因此除需接受HAART外,AIDS患者尚需接受各种并发症的治疗。但是几乎所有的HAART药物均有潜在的肝毒性[11],与其他治疗药物合用将在一定程度上加重肝脏负担。本研究结果显示在治疗并发症的基础上应用HAART可在一定程度上加重DILI的严重程度,并使TBil水平明显升高。因此,对于尚未接受HAART,但已出现DILI的AIDS患者,临床医生需谨慎选择HAART药物及开始HAART的时机,以免加重肝损伤。由于是否接受HAART与患者预后无明显影响,同时停用HAART药物可能导致HIV耐药,因此对于已接受HAART的患者切不可盲目停用,以减轻患者肝脏负担。仅可在排除其他药物造成DILI,且更换其他肝功能损伤较轻的HAART药物后DILI仍无改善时,予以考虑停用HAART。对于除AIDS外的合并症治疗,应充分考虑药物疗效、与抗HIV药物之间的相互作用以及可能的药物副作用,尽量优化治疗方案,尽量减轻药物肝脏负担。 绝大数AIDS合并DILI患者的预后良好,预后不良包括病情危重放弃治疗、要求自动出院以及死亡,但这些不良预后均由基础疾病引起,与DILI不存在直接联系,且无统计学依据表明造成DILI药物种类、HAART、损伤类型、生化指标、CD4水平、年龄等多种因素与患者预后相关。Schutz等[12]研究表明AIDS并发DILI患者的预后较差,院内病死率达27%,3个月病死率高达35%,与本研究结果存在较大差异,可能与其以ALT≥200 U/L或TBil≥44 μmol/L作为入选标准有关,而本研究入选患者中仅有部分患者符合该标准。Treeprasertsuk等[13]研究发现患者如果出现黄疸症状,则提示预后不良。而本研究由于出现黄疸及不良预后的病例数较少,无法进行统计学分析,但本研究显示胆汁淤积性肝损伤可导致患者住院治疗时间延长,与上述研究结论近似。 本研究尚存不足之处:(1)本研究为一项回顾性研究,无法明确所有病例造成DILI的原因,缺乏DILI发生时的凝血功能及肝脏影像学检查相关资料;(2)本研究仅纳入住院患者而未纳入门诊患者,无法显示门诊患者的DILI发生率及其表现;(3)由于AIDS患者病情复杂,未纳入存在感染性、自身免疫性肝病或其他可造成肝功能异常的疾病病例;(4)目前AIDS主要在男男同性恋之间传播,患者以男性为主,造成纳入病例男女比例失调,无法分析性别与DILI的关系;(5)本研究对各项指标与预后的关系进行统计分析,均未见具备统计学意义的差异,可能与样本量偏少有关。 综上所述,笔者认为AIDS的用药复杂,需要临床医师对AIDS及其用药有充分的了解,尤其是AIDS治疗药物的药理、毒理作用的具体机制,在联合用药时掌握其基本用药原则,严格掌握用药指针,禁止滥用、多用、长期用药,并在用药过程中定期检查肝功能,实时了解肝脏炎症活动状态,有助于减少AIDS患者的DILI发生率,预防严重肝损伤所带来的卫生经济负担。 [1] Drug-induced liver Disease Study Group, Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the management of drug-induced liver injury[J]. J Clin Hepatol, 2015, 31(11): 1752-1769. (in Chinese) 中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 临床肝胆病杂志, 2015, 31(11): 1752-1769. [2] KONTORINIS N, TERICH DT. Toxicity of non-nucleoside analogue reverse transcriptase inhibitors[J]. Semin Liver Dis, 2003, 23(2): 173-182. [3] RODRIGUEZ-ROSADO R, GARCIA-SAMANIEGO J, SORIANO V. Hepatotoxicity after introduction of highly active antiretroviral therapy[J]. AIDS, 1998, 12(10): 1256. [4] CHALASANI NP, HAYASHI PH, BONKOVSKY HL, et al. ACG Clinical Guideline: the diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol, 2014, 109(7): 950-966. [5] YIMER G, UEDA N, HABTEWOLD A, et al. Pharmacogenetic & pharmacokinetic biomarker for efavirenz based ARV and rifampicin based anti-TB drug induced liver injury in TB-HIV infected patients[J]. PLoS One, 2011, 6(12): e27810. [6] JONES M, NUNEZ M. Liver toxicity of antiretroviral drugs [J]. Semin Liver Dis, 2012, 32(2): 167-176. [7] BJORNSSON ES, BERGMANN OM, BJORNSSON HK, et al. Incidence, presentation, and outcomes in patients with drug-induced liver injury in the general population of Iceland[J]. Gastroenterology, 2013, 144(7): 1419-1425. [8] MUGUSI S, NGAIMISI E, JANABI M, et al. Liver enzyme abnormalities and associated risk factors in HIV patients on efavirenz-based HAART with or without tuberculosis co-infection in Tanzania[J]. PLoS One, 2012, 7(7): e40180. [9] WANG YL, QI YW, BAI JS, et al. Clinical analysis of drug induced liver disease in AIDS/HIV patients[J]. J Kunming Med Coll, 2009, 30(3): 129-132. (in Chinese) 汪亚玲, 祁燕伟, 白劲松, 等. AIDS/HIV药物性肝损伤的临床分析[J]. 昆明医学院学报, 2009, 30(3): 129-132. [10] FERNANDEZ-VILLAR A, SOPENA B, VAZQUEZ R, et al. Isoniazid hepatotoxicity among drug users: the role of hepatitis C[J]. Clin Infect Dis, 2003, 36(3): 293-298. [11] COFFIE PA, TONWE-GOLD B, TANON AK, et al. Incidence and risk factors of severe adverse events with nevirapine-based antiretroviral therapy in HIV-infected women. MTCT-Plus program, Abidjan, Cte d′Ivoire[J]. BMC Infect Dis, 2010, 10: 188. [12] SCHUTZ C, ISMAIL Z, PROXENOS CJ, et al. Burden of antituberculosis and antiretroviral drug-induced liver injury at a secondary hospital in South Africa[J]. S Afr Med J, 2012, 102(6): 506-511. [13] TREEPRASERTSUK S, HUNTRAKUL J, RIDTITID W, et al. The predictors of complications in patients with drug-induced liver injury caused by antimicrobial agents[J]. Aliment Pharmacol Ther, 2010, 31(11): 1200-1207. 引证本文:YANG JY, QI TK, ZHANG RF, et al. Clinical features and prognosis of AIDS complicated by drug-induced liver injury: an analysis of 119 cases[J]. J Clin Hepatol, 2017, 33(8): 1537-1542. (in Chinese) 杨君洋, 齐唐凯, 张仁芳, 等. 119例艾滋病患者并发药物性肝损伤的临床特点及预后分析[J]. 临床肝胆病杂志, 2017, 33(8): 1537-1542. (本文编辑:邢翔宇) Clinical features and prognosis of AIDS complicated by drug-induced liver injury: an analysis of 119 cases YANGJunyang,QITangkai,ZHANGRenfang,etal. (WenzhouMedicalUniversity,Wenzhou,Zhejiang325000,China) Objective To investigate the clinical features and prognosis of AIDS patients complicated by drug-induced liver injury (DILI). Methods A total of 119 patients who were diagnosed with AIDS in First Department of Infectious Diseases in Shanghai Public Health Clinical Center from January 2014 to December 2015 and met the diagnostic criteria for DILI were enrolled. The clinical data including medications, CD4+T lymphocyte count, clinical manifestations, liver biochemical parameters, therapies, duration of liver injury, and prognosis were analyzed, and DILI type and classification were determined for all patients. The influence of DILI caused by different drugs on liver biochemical parameters was analyzed. The Wilcoxon rank sum test was used for comparison of continuous data between two groups and the Kruskal-WallisHtest was used for comparison between multiple groups; the chi-square test was used for comparison of categorical data between groups. Results The 58 patients who highly active antiretroviral treatment (HAART) had significantly higher grade of liver injury (χ2=15.756,P<0.001) and levels of total bilirubin (TBil) (Z=-3.466,P=0.010) and albumin (Alb) (Z=-1.968,P=0.049) than the 61 patients who did not. Among the patients who had a clear cause of DILI, 8 had DILI caused by antifungal drugs, 41 had DILI caused by antibacterial drugs, 18 had DILI caused by antitubercular agents, and 24 had DILI caused by antiviral drugs; the patients with DILI caused by antitubercular agents had a significantly higher level of TBil than those with DILI caused by other three types of drugs (H=12.804,P=0.005), the patients with DILI caused by antibacterial drugs and antitubercular agents had a significantly lower level of Alb than those with DILI caused by the other two types of drugs (H=14.236,P=0.003), and the patients with DILI caused by antitubercular agents and antiviral drugs had a significantly higher grade of liver injury than those with DILI caused by the other two types of drugs (χ2=16.373,P=0.008). The hepatocellular injury-type patients had a shorter length of hospital stay (χ2=8.046,P=0.045). A high level of alkaline phosphatase and a low level of alanine aminotransferase indicated a longer length of hospital stay (Z=-2.943 and -2.592, bothP<0.05). Conclusion AIDS patients are given various drugs and have a high incidence rate of DILI. HARRT can aggravate liver injury, but it does not significantly affect patients' prognosis. Liver function examination should be performed regularly during clinical medication to know the state of liver inflammation and reduce the incidence rate of DILI in AIDS patients. acquired immunodeficiency syndrome; drug-induced liver injury; prognosis 10.3969/j.issn.1001-5256.2017.08.026 2017-01-18; 2017-03-01。 国家自然科学基金面上项目(81571977) 杨君洋(1992-),男,主要从事艾滋病治疗方面的工作。 卢洪洲,电子信箱:luhongzhou@fudan.edu.cn。 R512.91; R575 A 1001-5256(2017)08-1537-062 结果



3 讨论
