microRNA-222在肝细胞癌组织中的表达及意义
2017-08-30张竹青卢书明王花丽徐梦杳李春艳赵俊军
张竹青, 卢书明, 王花丽, 徐梦杳, 李春艳, 辛 悦, 赵俊军
(1 大连市中心医院 病理科,辽宁 大连 116033;2 大连医科大学附属第一医院 a. 消化内科;b. 病理科,辽宁 大连 116011)
microRNA-222在肝细胞癌组织中的表达及意义
张竹青1, 卢书明2a, 王花丽2b, 徐梦杳2a, 李春艳2a, 辛 悦1, 赵俊军1
(1 大连市中心医院 病理科,辽宁 大连 116033;2 大连医科大学附属第一医院 a. 消化内科;b. 病理科,辽宁 大连 116011)
目的 检测microRNA-222(miRNA-222)在肝细胞癌(HCC)组织中的表达,并探讨其临床意义。方法 收集2012年1月-2014年12月于大连市中心医院、大连医科大学附属第一医院手术切除的HCC组织103例,采用实时定量PCR方法检测HCC、近癌旁肝硬化组织及远癌旁肝组织中miRNA-222的表达水平,分析miRNA-222表达与HCC临床病理特征之间的关系。计量资料多组间比较采用单因素方差分析,进一步两两比较采用Dunnett′s T3法;两组间比较采用t检验。结果 miRNA-222在HCC、近癌旁肝硬化组织及远癌旁肝组织中的表达差异有统计学意义(F=27.167,P<0.001),其在HCC组织中的相对表达量(4.543±2.029)明显高于在近癌旁肝硬化组织(3.072±0.844)及远癌旁肝组织(1.559±0.695)中的相对表达量(P值均<0.01);近癌旁肝硬化组织中miRNA-222的相对表达量显著高于远癌旁肝组织(P<0.01)。miRNA-222的表达与HCC的大小、分化程度、门静脉瘤栓、侵袭转移均有关联(t值分别为7.256、9.900、2.345、4.225,P值均<0.05);而与性别、年龄、合并病毒性肝炎及AFP升高无关(P值均>0.05)。结论 miRNA-222在HCC组织中异常高表达,检测miRNA-222有助于HCC临床进展及预后的判断。
癌, 肝细胞; 微RNAs
最新报道[1]显示我国肝细胞癌(HCC)的发病率在恶性肿瘤中居第4位,病死率在癌症相关死亡中居第3位,但目前HCC的具体发病机制仍不清楚。近年来研究[2]发现microRNA(miRNA)作为一类非编码单链小分子RNA,通过互补配对的方式与靶基因序列特异性结合,在细胞增殖、分化、凋亡等生理和病理过程中发挥重要作用,且与肿瘤的发生、发展密切相关,发挥类似癌基因和抑癌基因的功能。miRNA-222属于miRNA-221/222家族,定位于X染色体P11.3区约1 kb的区域内,在肿瘤细胞增殖过程中发挥重要作用,且在胃癌、结直肠癌、膀胱癌等恶性肿瘤异常表达,并与肿瘤的转移、分期关系密切[3-5]。本研究通过检测miRNA-222在HCC、近癌旁肝硬化组织及远癌旁肝组织中的表达,分析miRNA-222与HCC临床病理特征的关系,探讨其在HCC发生发展中的作用。
1 资料与方法
1.1 研究对象 收集2012年1月-2014年12月于大连市中心医院、大连医科大学附属第一医院手术切除的HCC组织103例,其中男90例,女13例,年龄39~74岁,平均(57.59±8.49)岁,年龄<60岁60例,≥60岁43例;有病毒性肝炎病史者78例,无肝炎病史者25例;肿瘤大小:<5 cm者75例,≥5 cm者28例;分化程度:高中分化66例,低分化37例;出现门静脉瘤栓者16例,未出现门静脉瘤栓者87例;发生侵袭转移39例,未见侵袭转移64例;AFP水平升高者60例,正常者43例。所有病例均经术后病理切片确诊,术前均未接受放疗和化疗。选择HCC手术切除后近癌旁肝硬化组织32例、远癌旁肝组织标本(距离肿瘤边缘至少5 cm,且病理显示无肝硬化形态表现)18例,所有组织均经病理学证实。
1.2 主要试剂 石蜡包埋组织miRNA快速提取试剂盒购自上海吉玛制药技术有限公司,TaqMan MicroRNA反转录试剂盒、TaqMan univsersal PCR Master MixⅡ、TaqMan MicroRNA分析试剂盒购自美国Life Technologies公司。目的基因序列在GenBank中查找,使用Primer-Express3.0软件设计引物,其中miRNA-222扩增片段为155 bp,上游引物为5′-CTGGGTCTCTGATGGCATCT-3′,下游引物为5′-TGTGTGTGAGTGTGTGTGTG-3′;选择U6基因作为内参,扩增长度为96 bp,其上游引物为5′-CTCGCTTCG-GCAGCACA-3′,下游引物为5′-AACGCTTCACGA-ATTTGCGT-3′。引物由大连宝生物工程有限公司合成。
1.3 实时定量PCR(real-time quantitative PCR, qRT-PCR)反应
1.3.1 RNA提取 HCC、近癌旁肝硬化及远癌旁肝组织中总RNA的提取采用石蜡包埋组织miRNA快速提取试剂盒,按照试剂盒说明书进行。采用紫外分光光度计测定RNA浓度和纯度,A260/A280比值在1.8~2.1,提示RNA纯度较好,可用于下一步PCR操作。
1.3.2 qRT-PCR反应 逆转录反应:总反应体系为15 μl,包括无RNA酶水4.16 μl,dNTP 0.15 μl,反转录酶1.0 μl,10×RT缓冲液1.5 μl,RNA酶抑制剂0.19 μl,逆转录引物(miRNA-222,U6)3 μl,RNA样本5 μl;其中总RNA为10 ng(稀释成2 ng/μl)。反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,收集cDNA产物常规置于-20 ℃保存。
PCR反应:总反应体系为20 μl,Master MixⅡ 10 μl,Small RNA Assay 1 μl,模板cDNA 1.33 μl,无RNA酶水7.67 μl。反应条件:95 ℃预变性10 min,95 ℃ 30 s,60 ℃ 1 min条件下扩增40个循环。miRNA表达水平用2-△△Ct表示,其中△△Ct=(CtmiRNA-222-CtU6)实验组-(CtmiRNA-222-CtU6)对照组,得到miRNA-222在各组中的相对表达量。
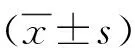
2 结果
2.1 miRNA-222在HCC、近癌旁肝硬化组织及远癌旁肝组织中的表达 qRT-PCR检测显示,miRNA-222在HCC、近癌旁肝硬化组织及远癌旁肝组织中的表达差异有统计学意义(F=27.167,P<0.001)。进一步两两比较显示,miRNA-222在HCC组织中的相对表达量(4.543±2.029)明显高于其在近癌旁肝硬化组织(3.072±0.844)及远癌旁肝组织(1.559±0.695)中的相对表达量(P值均<0.01);近癌旁肝硬化组织中miRNA-222的相对表达量显著高于远癌旁肝组织(P<0.01)(图1)。
2.2 miRNA-222的表达与HCC患者临床病理参数之间的关系 HCC肿瘤≥5 cm、低分化、有门静脉瘤栓、发生侵袭转移组中miRNA-222的相对表达量均高于相应的肿瘤<5 cm、高中分化、无门静脉瘤栓、未发生侵袭转移组中miRNA-222的相对表达量,差异均有统计学意义(P值均<0.05)(表1)。

图1 miRNA-222在HCC、近癌旁肝硬化及远癌旁肝组织中表达的比较 与近癌旁肝硬化组织比较, *P<0.01; 与远癌旁肝组织比较,#P<0.01

表1 不同HCC临床病理参数之间miRNA-222的表达差异
3 讨论
miRNAs可通过调控转录后基因表达参与肝癌细胞的增殖、凋亡、侵袭与转移[6],一些miRNAs可作为早期诊断HCC及判断预后的指标[7-8]。本研究结果显示,miRNA-222在HCC组织中的表达明显高于其在近癌旁肝硬化组织及远癌旁肝组织中的表达,且近癌旁肝硬化组织中miRNA-222的表达也显著高于远癌旁肝组织,提示在肝硬化阶段miRNA-222即表达增高,而在HCC组织中表达水平最高。研究[9]发现miRNA-222的表达从肝硬化至早期HCC及晚期HCC呈逐步增加态势,提示miRNA-222高表达与HCC的发生密切相关。而有研究[10]显示miRNA-222在HCC组织中表达明显增高,而在肝内胆管癌组织中却明显降低,这些发现提示miRNA-222在不同肿瘤中的表达具有组织特异性,未来可用于HCC的诊断。Zhang等[11]和Fiorino等[12]研究显示miRNA-222在慢性HBV感染时表达增高,在HBV和HCV相关性HCC患者血清中表达水平也显著增高,表明miRNA-222可作为诊断肝炎相关HCC可能的生物学指标。
研究[3-4]显示miRNA-222的表达与胃癌、结肠癌的临床分期、淋巴结转移显著相关,可作为肿瘤的预后指标,且miRNA-222的表达与HCC肿瘤分化程度密切有关,并与HCC患者生存期显著相关[13],miRNA-222高表达的HCC患者中位生存期明显低于低表达组[9]。也有报道[10,14]显示miRNA-222与HCC的数目、大小、分期、Child-Pugh分级及预后并无相关性。本研究发现miRNA-222的表达水平与HCC肿瘤大小、分化程度、有无门静脉瘤栓及发生侵袭转移有关联,提示miRNA-222表达越高,HCC恶性程度就越高,越易发生侵袭转移,患者预后越差。故检测miRNA-222有助于HCC临床进展及预后的判断。
研究[9,15]报道miRNA-222可下调α抑制活性多肽、激活AKT信号转导通路,影响HCC的发生与转移,在肝癌细胞系中miRNA-222可直接抑制PTEN蛋白的表达,导致PI3K/AKT/mTOR通路激活[16],而上调miRNA-222可抑制PTEN蛋白的表达,使HepG2细胞的增殖和侵袭能力大大增强[17]。抑制miRNA-222的表达可增加口腔鳞状细胞癌对顺铂的化疗敏感性[18]。最新研究[19]显示miRNA-222通过调控PTEN/AKT/FOXO1信号通路参与乳腺癌细胞的阿霉素耐药,而抑制miRNA-222能够改善乳腺癌患者的预后。此外,miRNA-222还能够调节HCC对索拉非尼的耐药性[20]。因此未来通过调控HCC细胞miRNA-222的表达可能应用于治疗HCC。
综上所述,miRNA-222在HCC组织中的表达明显增高,且与HCC肿瘤分化程度、侵袭及转移等密切相关,检测miRNA-222有助于HCC临床进展及预后的判断,其可能成为HCC重要的诊断检测指标及治疗靶点,但需要今后更深入的研究。
[1] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] BARTEL DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[3] FU Z, QIAN F, YANG X, et al. Circulating miR-222 in plasma and its potential diagnostic and prognostic value in gastric cancer[J]. Med Oncol, 2014, 31(9): 164.
[4] LIU S, SUN X, WANG M, et al. A microRNA 221- and 222-mediated feedback loop maintains constitutive activation of NF-κB and STAT3 in colorectal cancer cells[J]. Gastroenterology, 2014, 147(4): 847-859.
[5] ZHANG DQ, ZHOU CK, JIANG XW, et al. Increased expression of miR-222 is associated with poor prognosis in bladder cancer[J]. World J Surg Oncol, 2014, 12: 241.
[6] XU L, MA KX, DONG B, et al. Regulatory effect of miRNAs on apoptosis, migration, and cell cycle of hepatocellular carcinoma cells[J]. J Clin Hepatol, 2013, 29(7): 554-557. (in Chinese) 许力, 马珂歆, 董兵, 等. 肝细胞癌中microRNA对细胞凋亡、转移和周期的调控作用[J]. 临床肝胆病杂志, 2013, 29(7): 554-557.
[7] MIRZAEI HR, SAHEBKAR A, MOHAMMADI M, et al. Circulating microRNAs in hepatocellular carcinoma: potential diagnostic and prognostic biomarkers[J]. Curr Pharm Des, 2016, 22(34): 5257-5269.
[8] DENG X, WU JB. Updates in the research of relationship between MicroRNAs and hepatocellular carcinoma[J]. Chin J Dig Surg, 2015, 14(5): 431-433. (in Chinese) 邓曦, 吴敬波. 微RNAs与肝癌关系的研究进展[J]. 中华消化外科杂志, 2015, 14(5): 431-433.
[9] WONG QW, CHING AK, CHAN AW, et al. MiR-222 overexpression confers cell migratory advantages in hepatocellular carcinoma through enhancing AKT signaling[J]. Clin Cancer Res, 2010, 16(3): 867-875.
[10] KARAKATSANIS A, PAPACONSTANTINOU I, GAZOULI M, et al. Expression of microRNAs, miR-21, miR-31, miR-122, miR-145, miR-146a, miR-200c, miR-221, miR-222, and miR-223 in patients with hepatocellular carcinoma or intrahepatic cholangiocarcinoma and its prognostic significance[J]. Mol Carcinog, 2013, 52(4): 297-303.
[11] ZHANG ZZ, LIU X, WANG DQ, et al. Hepatitis B virus and hepatocellular carcinoma at the miRNA level[J]. World J Gastroenterol, 2011, 17(28): 3353-3358.
[12] FIORINO S, BACCHI-REQQIANI ML, VISANI M, et al. MicroRNAs as possible biomarkers for diagnosis and prognosis of hepatitis B- and C-related-hepatocellular-carcinoma[J]. World J Gastroenterol, 2016, 22(15): 3907-3936.
[13] MURAKAMI Y, YASUDA T, SAIGO K, et al. Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues[J]. Oncogene, 2006, 25(17): 2537-2545.
[14] QI P, CHENG SQ, WANG H, et al. Serum microRNAs as biomarkers for hepatocellular carcinoma in Chinese patients with chronic hepatitis B virus infection[J]. PLoS One, 2011, 6(12): e28486.
[15] ZHANG Y, YAO J, HUAN L, et al. GNAI3 inhibits tumor cell migration and invasion and is post-transcriptionally regulated by miR-222 in hepatocellular carcinoma[J]. Cancer Lett, 2015, 356(2 Pt B): 978-984.
[16] GAROFALO M, DI LEVA G, ROMANO G, et al. miR-221&222 regulate TRAIL resistance and enhance tumorigenicity through PTEN and TIMP3 downregulation[J]. Cancer Cell, 2009, 16(6): 498-509.
[17] TAO XC, MA DL, WU DQ. Effect of up-regulating miR-222 in HepG2 cells on its invasion and proliferation[J]. Pract Oncol J, 2015, 29(3): 235-238. (in Chinese) 陶宣辰, 马东来, 吴德全. 上调miR-222对肝癌细胞系HepG2增殖和侵袭能力的影响[J]. 实用肿瘤学杂志, 2015, 29(3): 235-238.
[18] JIANG F, ZHAO W, ZHOU L, et al. MiR-222 targeted PUMA to improve sensitization of UM1 cells to cisplatin[J]. Int J Mol Sci, 2014, 15(12): 22128-22141.
[19] SHEN H, WANG D, LI L, et al. MiR-222 promotes drug-resistance of breast cancer cells to adriamycin via modulation of PTEN/Akt/FOXO1 pathway[J]. Gene, 2017, 596: 110-118.
[20] LIU K, LIU S, ZHANG W, et al. miR 222 regulates sorafenib resistance and enhance tumorigenicity in hepatocellular carcinoma[J]. Int J Oncol, 2014, 45(4): 1537-1546.
引证本文:ZHANG ZQ, LU SM, WANG HL, et al. Expression of microRNA-222 in hepatocellular carcinoma tissue and its clinical significance[J]. J Clin Hepatol, 2017, 33(8): 1502-1505. (in Chinese) 张竹青, 卢书明, 王花丽, 等. microRNA-222在肝细胞癌组织中的表达及意义[J]. 临床肝胆病杂志, 2017, 33(8): 1502-1505.
(本文编辑:葛 俊)
Expression of microRNA-222 in hepatocellular carcinoma tissue and its clinical significance
ZHANGZhuqing,LUShuming,WANGHuali,etal.
(DepartmentofPathology,DalianCentralHospital,Dalian,Liaoning116033,China)
Objective To investigate the expression of microRNA-222 (miRNA-222) in hepatocellular carcinoma (HCC) tissue and its clinical significance. Methods A total of 103 HCC tissue samples were collected from the patients who underwent surgical resection in Dalian Central Hospital and The First Affiliated Hospital of Dalian Medical University from January 2012 to December 2014. Quantitative real-time PCR was used to measure the expression of miRNA-222 in HCC tissues, adjacent cirrhotic tissues, and distal liver tissues, and the association between miRNA-222 expression and the clinicopathological features of HCC was analyzed. A one-way analysis of variance was used for comparison of continuous data between multiple groups, and the Dunnett′s T3 test was used for further comparison between any two groups; thet-test was used for comparison between two groups. Results There was a significant difference in the expression of miRNA-222 between HCC tissues, adjacent cirrhotic tissues, and distal liver tissues (F=27.167,P<0.001); the HCC tissues had significantly higher relative expression of miRNA-222 than the adjacent cirrhotic tissues (4.543±2.029 vs 3.072±0.844,P<0.01) and the distal liver tissues (4.543±2.029 vs 1.559±0.695,P<0.01), and the adjacent cirrhotic tissues had significantly higher relative expression of miRNA-222 than the distal liver tissues (P<0.01). The expression of miRNA-222 was significantly associated with tumor size, degree of tumor differentiation, tumor thrombus in the portal vein, and invasion/metastasis (t=7.256, 9.900, 2.345, and 4.225, allP<0.05), while it was not associated with sex, age, the presence of viral hepatitis, or increased alpha-fetoprotein level (allP>0.05). Conclusion
The expression of miRNA-222 is abnormally upregulated in HCC tissue, and miRNA-222 measurement may help to evaluate the clinical progression and prognosis of HCC.
carcinoma, hepatocellular; microRNAs
10.3969/j.issn.1001-5256.2017.08.018
2017-02-28;
2017-03-30。
国家自然科学基金项目(81502274);辽宁省自然科学基金资助项目(2015020324);大连市卫生局课题
张竹青(1978-),女,主要从事消化道恶性肿瘤发生机制研究。
R735.7
A
1001-5256(2017)08-1502-04
