LAMP技术在水体病原微生物检测中的应用
2017-08-30尹红果方福如
尹红果,方福如,商 栩
(1.湖南环境生物职业技术学院 医学院,湖南 衡阳 421005; 2.温州医科大学 浙南水科学研究院,浙江 温州 325035)
LAMP技术在水体病原微生物检测中的应用
尹红果1,方福如1,商 栩2
(1.湖南环境生物职业技术学院 医学院,湖南 衡阳 421005; 2.温州医科大学 浙南水科学研究院,浙江 温州 325035)
为了探究LAMP技术在水体病原微生物检测中的应用情况,利用该技术对环境水体常见细菌类病原体进行研究。针对水体常见病原微生物的特异基因设计引物,建立环介导等温扩增快速检测方法,选择目标病原微生物并考查其在水环境中的分布特征及丰度情况。结果表明,沙门菌存活量在所研究区域范围内达到一定丰度,且分布特点显著,各站位沙门菌浓度大致为2.39×10~2.39×105mL-1。表明LAMP方法能够有效运用于水体病原微生物的快速检测,为环境水体中病原微生物的选择和检测提供了一种实用、便捷的手段。
环介导等温扩增; 病原微生物; 环境水体
病原微生物污染及其对人类健康的危害是当今最受关注的全球性环境问题之一,其中由于水环境受污染或经水传播而引起的病原体感染尤为突出[1]。目前,介水传播引起的肠道传染病仍是我国急性传染病中发病数最多、流行面最广、影响群众生活生产最普遍的一类疾病[2]。尽管预防介水传染病一直是卫生防疫机构的关注重点,但对城乡各类地表水体受相关病原微生物污染的状况却知之甚少。针对传统病原微生物检测方法费时费力、检出特异性和准确性偏低的问题,开展基于分子生物学技术的快速检测工作为大势所趋。环介导等温扩增技术(LAMP技术)是2000年日本学者Notomi等报道的一种恒温核酸扩增方法,该方法主要针对靶基因的6个区域设计4种特异引物,利用链置换DNA聚合酶(BstDNA polymerase)在等温条件下(约65 ℃)进行反应,1 h内就能将靶序列DNA扩增109倍。该技术以其简单、快捷、特异性强、敏感性高、不需要昂贵的实验仪器设备等优点,在分子生物学领域备受关注[3-5]。目前,LAMP方法已经被广泛应用于不同领域的多种病原微生物检测[6-7]。本研究拟运用环介导等温扩增技术对水环境中常见病原微生物进行检测,并对目标水域主要病原菌沙门菌的分布特点及丰度值进行探究,以期实现水体中沙门菌污染情况的快速定量检测,从而为介水传染病的防控提供一种新的途径。
1 材料与方法
1.1 仪器与试剂
LA-302C实时浊度仪(日本荣研生物科技有限公司),5810R型高速冷冻离心机(德国Eppendorf公司),YXQ-LS-50SⅡ型高压灭菌器(上海博讯实业有限公司),DK-600型恒温水浴箱(上海精宏试验设备有限公司)。AxyPrep细菌基因组DNA试剂盒、BstDNA聚合酶、dNTPs、10×loading buffer、DNA Marker DL100、溴化乙锭(纽英伦生物技术有限公司),水体DNA提取试剂盒(美国Omage公司)。
1.2 样品处理
本研究于温瑞塘河40个常规站位中选取5个典型站位,其中,A3位于两河相汇处;B7与常有污水注入的瓯江相通;B15周围是学校、医院等人口集中的场所;C1处在生活区,水质黑臭;W3位于三垟湿地。每月定时按微生物取样方法(GB/T 5750.12—2006)采取水样1 000 mL。然后于实验室准确量取水样500 mL,用0.45 μm的微孔滤膜过滤,再用水体DNA提取试剂盒提取水中微生物的DNA,得到各基因组样品,放入冰箱(-20 ℃)备用。
1.3 引物设计
1.3.1 引物的选择
通过文献查阅和LAMP引物设计软件进行引物筛选,目标病原菌的特异性基因引物序列由生工生物工程(上海)股份有限公司合成。隐孢子虫的引物序列:FIP 5′-TTGCGCCCTGTTAATCCAGCATT AATTAATCCATCTGGCAGRTTT-3′,BIP 5′-TTGTAG ATACATACGGAGGATGGGTCTACTTTAGTTGCATCT TTCC-3′,F3 5′-ATTTGAT RGACAAAGAAACTAG-3′,B3 5′-CGATTGACTTTGCAACAAG。弯曲杆菌的引物序列:FIP 5′-ACAGCACCGCCACCTATAGTAG AAGCTTTTTTAAACTAGGGC-3′,BIP 5′-AGGCAGC AGAACTTACGCATTGAGTTTGAAAAAACATTCTACC TCT-3′,F3 5′-GCAAGACAATATTATTGATCGC-3′,B3 5′-CTTTCACAGGCTGCACTT。肠球菌的引物序列:FIP 5′-CACTTTTTGTTGTTGGTTTTCGCTTTATT ATCTGCTTGGGGTGC-3′,BIP 5′-ATCTGCAGACAA AGTAGTAATTGCTCCAAGCTTTTAAGCGTGTC-3′,F3 5′-GCCGGAAATCGATGAAGA-3′,B3 5′-TCCA GCAACGTTGATTGT。大肠杆菌O157:H7的引物序列:FIP 5′-CTCTCTTTCCTCTGCGGTCC-GATGTT TTTCACACTTATTGGAT C-3′,BIP 5′-TAAGGAATC ACCTTGCAGATAAACTAGTACATTGGCATCGTGT-3′,F3 5′-AACAGTCTTGTACAAGTCCA-3′,B3 5′-GGTGCTTTTGATATTTTTCCG。沙门菌的引物序列:FIP 5′-GGCGTGAGAGATCCACCTGGAATGCGCCGT AATAGCGGTC-3′,BIP 5′-CACCATTATGGAAACGC TTATCCGCCGGATACAGCTGAAGCATC-3′,F3 5′-GCCATTCCACATCGAAGAGGT-3′,B3 5′-ATGAGA ACATCAATGGTATGGC。外引物(F3/B3)、内引物(FIP/BIP)浓度分别配制成5 pmoL·L-1、40 pmoL·L-1。
1.3.2 LAMP反应体系与扩增条件
反应体系(25 μL)包括内引物(FIP和BIP)各0.4 μL,外引物(F3和B3)各0.5 μL,RM 12.5 μL,BstDNA聚合酶1 μL,染料1 μL,DNA模板2 μL,双蒸水6.7 μL,矿物油1滴。沙门菌和大肠杆菌O157:H7均于65 ℃扩增60 min,隐孢子虫和弯曲杆菌均于63 ℃扩增60 min,肠球菌在66 ℃扩增60 min,扩增后各种病原微生物分别在80 ℃孵化10 min。
1.3.3 结果判定
利用实时浊度仪实时监测LAMP核酸扩增反应过程,以直观的图文形式来显示整个反应过程中各个反应的速率和时间。当LAMP实时终点监控浊度仪分析线性图的线性峰值超过预定标准或柱形图底部显示红色柱形时,反应结果即为阳性,蓝色柱高度代表反应生成的产物量,数值越高表示产物量越大。
2 结果与分析
2.1 病原微生物LAMP扩增结果及选择
除阳性对照样品和沙门菌实际水样检测显示阳性结果,隐孢子虫、弯曲杆菌、肠球菌和大肠杆菌O157:H7的实际水样相对应的柱形图几乎未出现峰值,即均未被检出(图1)。初步断定所选择的采样点中这些病原菌可能含量极少,甚至不存在。水体病原菌一般并非水中固有菌,而是从外界污染而来,特别是人畜粪便的污染[8]。本研究采样站位多处于医院、生活区等人口密集的地方,导致沙门菌检出率较高,沙门菌在水域中达到一定丰度,势必对附近居民的健康产生一定的安全隐患,所以其分布情况值得研究。
2.2 沙门菌分布情况
按优化好的LAMP反应体系,对4—12月提取的各特定站位水体基因组DNA进行扩增分析,以检测水体中沙门菌的分布状况。各个月份沙门菌阳性检出率的变化趋势如图2所示,从4月开始,沙门菌大量生长繁殖,6—7月丰度达到最大,8月数量锐减后又再次生长繁殖。由于本研究区域高温月份持续时间较长,雨水偏多,而沙门菌与温度和降雨呈正相关[9],再结合沙门菌在环境中存活持久性特点[10],该检出结果是符合沙门菌生活习性的。Rudolfs等[11]的研究结果表明,水体微生物有再生长趋向,因而8月检出率呈现骤降,9—12月检出率再次升高。
2.3 沙门菌LAMP定量分析
针对B7、C1站位,选择温差较大的夏冬两季取水样,分别进行沙门菌LAMP定量分析。研究以各个站位实际水样(500 mL)为基准提取基因组,然后以原始浓度为参考,分别对各基因组样品进行10倍梯度逐级稀释,按优化好的LAMP反应体系进行最低浓度检测,以确定各样品在何浓度时不被检出,结果如图3、图4所示。从沙门菌的阳性检出率结果可以看出,B7站位的微生物基因组丰度比C1站位低2个数量级及以上,B7站位的水样在夏季最低检出限为起始浓度稀释10倍,而冬季的最低检出限为起始浓度,进一步稀释便检测不出;C1站位的沙门菌最低检出限在夏季为起始浓度稀释10 000倍,而冬季则为起始浓度稀释100倍。

图2 沙门菌阳性检出率
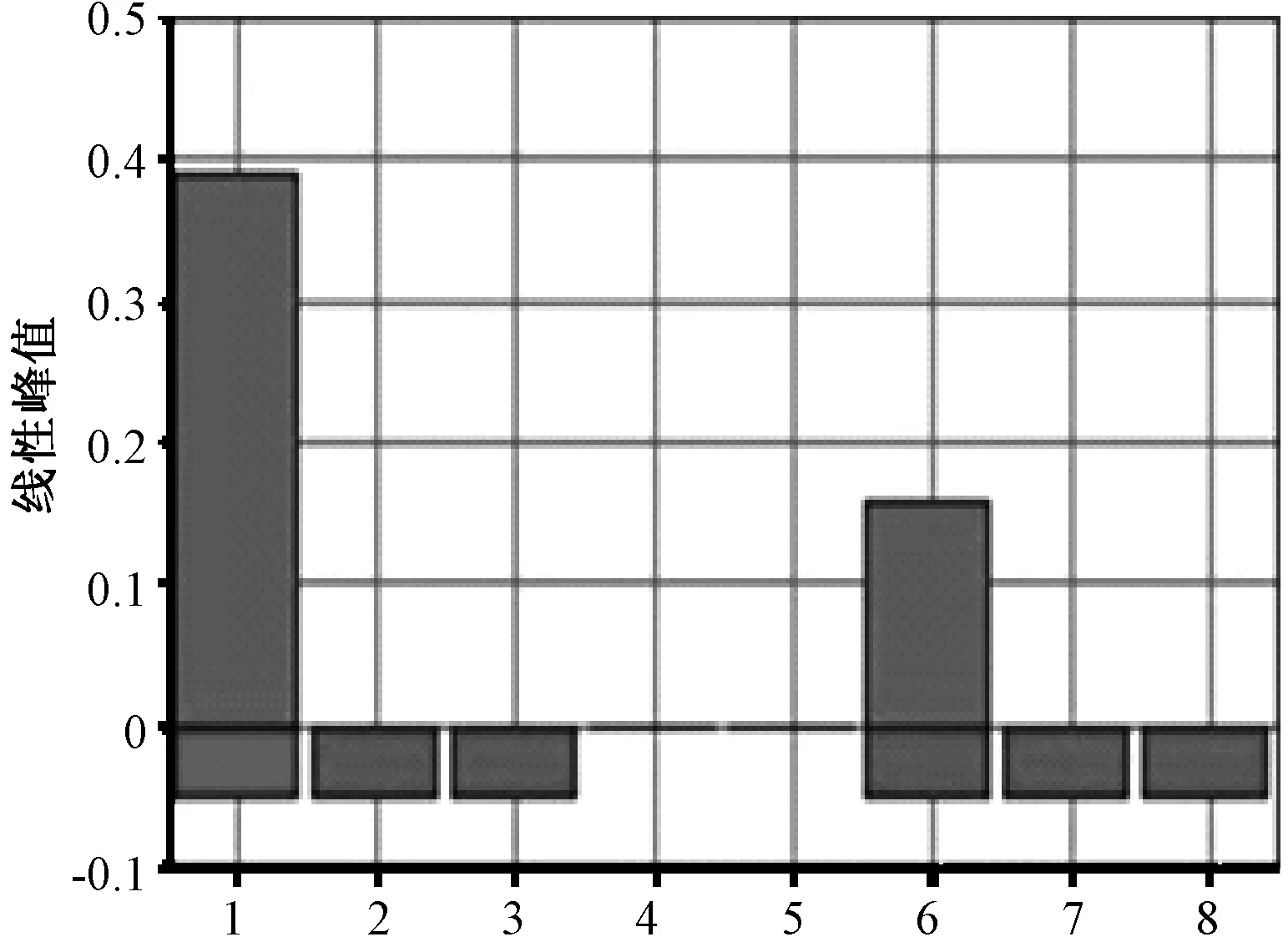
1,B7 10倍稀释浓度(10-1);2,B7 100倍稀释浓度(10-2 );3,B7 1 000倍稀释浓度(10-3);6,C1 104倍稀释浓度(10-4);7,C1 105倍稀释浓度(10-5);8,C1 106倍稀释浓度(10-6)图3 夏季B7、C1站位沙门菌的最低检出限

1,B7未稀释(100);2,B7 10倍稀释浓度(10-1);3,B7 100倍稀释浓度(10-2);6,C1 100稀释浓度(10-2);7,C1 1 000稀释浓度(10-3)图4 冬季B7、C1站位沙门菌的最低检出限
环境加标水样中沙门菌的最低检出限为2.39×10 mL-1[12],由此可以得出,夏季B7站位沙门菌的数量大于或者等于2.39×102mL-1,C1站位沙门菌的数量大于或者等于2.39×105mL-1;冬季,B7站位沙门菌的数量大于或者等于2.39×10 mL-1,C1站位沙门菌的数量大于或者等于2.39×103mL-1。又因为其他站位的浓度含量介于两者之间,因此可以推出其他研究站位沙门菌的浓度介于2.39×10~2.39×105mL-1。
3 小结
本研究针对环境水体中常见病原微生物建立了环介导等温扩增方法,有效避免了传统微生物检测方法费时费力、检出特异性和准确性偏低的问题。在已有的研究基础上,通过对特定区域主要病原微生物存在情况进行探究,进一步证实了该研究方法的快速高效和准确性。为了凸显LAMP技术在环境微生物检测中的实用性,本研究进一步对区域主要病原菌沙门菌的分布规律及丰度进行了调查,从检测结果看,沙门菌在所研究区域分布特点显著,其浓度介于2.39×10~2.39×105mL-1,表明LAMP方法能够有效应用于环境水体中病原微生物的快速检测。
[1] ROSZAK D B, COLWELL R R. Survival strategies of bacteria in the natural environment [J]. Microbiological Reviews, 1987, 51(3): 365-379.
[2] 周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 2005.
[3] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63.
[4] 匡燕云, 李思光, 罗玉萍. 环介导等温扩增核酸技术及其应用[J]. 微生物学通报, 2007, 34(3): 557-560.
[5] MORI Y, NAGAMINE K, TOMITA N, et al. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation [J]. Biochemical & Biophysical Research Communications, 2001, 289(1): 150-154.
[6] SONG T, TOMA C, NAKASONE N, et al. Sensitive and rapid detection ofShigellaand enteroinvasiveEscherichiacoliby a loop-mediated isothermal amplification method [J]. FEMS Microbiology Letters, 2005, 243(1): 259-263.
[7] MARUYAMA F, KENZAKA T, YAMAGUCHI N, et al. Detection of bacteria carrying the stx2 gene by in situ loop-mediated isothermal amplification [J]. Applied & Environmental Microbiology, 2003, 69(8): 5023-5028.
[8] 谢晓东, 蒋蓉芳, 宋伟民. 蝎形引物PCR快速检测环境水样中沙门菌方法研究[J]. 环境与职业医学, 2003, 20(2): 115-119.
[9] HALEY B J, COLE D J, LIPP E K. Distribution, diversity, and seasonally of waterborne salmonellae in a rural watershed [J]. Applied & Environmental Microbiology, 2009, 75(5): 1248-1255.
[10] THOMAS J L, SLAWSON R M, TAYLOR W D. Salmonella serotype diversity and seasonality in urban and rural streams [J]. Journal of Applied Microbiology, 2013, 114(3): 907-922.
[11] RUDOLFS W, GEHM H W. Sewage chlorination studies [M]. New Jersey: New Jersey Agricultural Experiment Station, 1936.
[12] 尹红果, 马小雪, 商栩, 等. 环境水体中沙门菌环介导等温扩增快速检测方法[J]. 环境与健康杂志, 2013, 30(2): 146-149.
(责任编辑:侯春晓)
2017-05-12
湖南环境生物职业技术学院院长科研青年基金(ZK2016-02)
尹红果(1987—),女,湖南岳阳人,助教,硕士,从事微生物分子生态学研究工作,E-mail:hongguoyin@126.com。
10.16178/j.issn.0528-9017.20170844
X172
A
0528-9017(2017)08-1440-04
文献著录格式:尹红果,方福如,商栩. LAMP技术在水体病原微生物检测中的应用[J].浙江农业科学,2017,58(8):1440-1443.
