急性ST段抬高型心肌梗死患者血清IL—37、TGF—β的表达及其意义
2017-08-26周亚光吴惠惠王荣花杨昆刘亚
周亚光+吴惠惠++王荣花++杨昆++刘亚楠++王坤++何京丽++彭春霞
[摘要] 目的 探讨急性ST段抬高型心肌梗死(STEMI)患者血清白细胞介素(IL)-37、转化生长因子β(TGF-β)的表达及其意义。 方法 选取2014年9月~2015年9月在民航总医院急诊科确诊且行经皮冠状动脉介入治疗(PCI)的STEMI患者40例作为实验组,同时选取40名常规体检者作为对照组。采用酶联免疫吸附测定(ELISA)法检测其外周血血清中IL-37、TGF-β的浓度。 结果 实验组患者血清IL-37浓度明显高于对照组(P = 0.02),TGF-β浓度明显低于对照组,差异有统计学意义(P = 0.000)。实验组IL-37与TGF-β呈负相关(r = -0.79,P = 0.00),对照组IL-37与TGF-β无明显相关性(r = 0.03,P = 0.86)。 结论 IL-37与TGF-β二者均参与STEMI的炎症过程。IL-37、TGF-β在STEMI炎性反应过程中具有负相关性,IL-37的抗炎作用发挥可能与TGF-β有关。
[关键词] 急性ST段抬高型心肌梗死;白细胞介素37;转化生长因子β
[中图分类号] R542.22 [文献标识码] A [文章编号] 1673-7210(2017)07(b)-0058-04
Expression and significance of serum IL-37, TGF-β in patients with acute ST-segment elevation myocardial infarction
ZHOU Yaguang WU Huihui WANG Ronghua YANG Kun LIU Ya′nan WANG Kun HE Jingli PENG Chunxia
Department of Emergency, Civil Aviation General Hospital, Beijing 100123, China
[Abstract] Objective To investigate the expression and significance of serum interleukin (IL)-37, transforming growth factor β (TGF-β) in patients with acute ST-segment elevation myocardial infarction (STEMI). Methods Forty patients with STEMI diagnosed and taken percutaneous coronary intervention (PCI) in Department of Emergency, Civil Aviation General Hospital from September 2014 to September 2015 were selected as experimental group, and 40 normal regular healthy control were selected as control group. The concentration of serum IL-37, TGF-β in peripheral blood was detected by enzyme-linked immunosorbent assay (ELISA). Results The concentration of serum IL-37 in experimental group was significantly higher than that of control group (P = 0.02), the concentration of TGF-β was significantly lower than that of control group, the difference was statistically significant (P = 0.000). The concentration of IL-37 was negatively correlated with TGF-β in experimental group (r = -0.79, P = 0.00), while there was no obvious correlation between IL-37 and TGF-β in control group (r = 0.03, P = 0.86). Conclusion Both IL-37 and TGF-β are involved in the inflammatory process of STEMI. IL-37 and TGF-β has a negative correlation in the inflammatory process of STEMI. The anti-inflammatory effect of IL-37 may be related to TGF-β.
[Key words] Acute ST segment elevation myocardial infarction; Interleukin-37; Transforming growth factor β
急性ST段抬高型心肌梗死(STEMI)是一種常见的严重的心血管疾病,它是以动脉粥样斑块破裂、溃疡、糜烂或夹层,引起一支或多支冠状动脉血栓形成,导致心肌血流减少或远端血小板栓塞伴心肌坏死。冠状动脉粥样硬化形成及斑块的破裂是STEMI发病的主要机制,炎症参与了斑块破裂、血栓形成的整个过程,而抑炎因子对延缓冠状动脉粥样硬化进展及阻止心肌梗死的发生有重要作用[1]。2000年,Kumar等[2]发现了一种与经典白细胞介素(IL)-1家族具有共结构域的前体肽,2001年,Dunn等[3]发现这种前体肽属于IL-1家族,将其命名为IL-1F7。2010年Nold等[4]发现IL-1F7具有抗炎及抑制固有免疫的作用,遂将其命名为IL-37。有研究证实在冠状动脉粥样硬化斑块泡沫细胞中发现IL-37的存在,提示IL-37参与了冠状动脉粥样硬化过程[5]。转化生长因子β(TGF-β)是细胞生长增殖调节蛋白超家族的成员之一,具有多种生物功能。作为一种经典的抑炎因子,TGF-β在急性冠脉综合征中发挥保护作用[6-7]。最近有研究证实IL-37参与了急性冠脉综合征的炎症过程[8-9],目前关于IL-37在STEMI患者中的水平及意义尚无定论,对于IL-37与TGF-β的关系尚无研究。本研究旨在探讨二者在STEMI中的水平、意义及二者之间的相关性。
1 资料与方法
1.1 一般资料
入选2014年9月~2015年9月在民航总医院急诊科确诊为STEMI且行急诊经皮冠状动脉介入治疗(PCI)的40例患者作为实验组,同时选取常规体检的40例体检者作为对照组。其中STEMI患者术前根据病情接受抗凝、抗血小板、调脂、扩张冠状动脉等治疗,伴发糖尿病、高血压病患者给予常规治疗。排除标准:严重肝肾功能不全、瓣膜病、扩张性心肌病、脑出血、高热及感染急性期、恶性肿瘤、风湿性疾病、长期使用免疫抑制剂。
1.2标本的收集及检测
所有STEMI患者在入院时即行静脉采血,对照组清晨空腹采集静脉血,标本置入肝素钠抗凝管内,行3000 r/min离心20 min后取上清液,置于-80℃低温冰箱保存待测。IL-37由AdipoGen公司提供,最低检测浓度为10 pg/mL,TGF-β由Multi-Sciences公司提供,最低检测浓度为10 pg/mL,IL-37及TGF-β均采用酶联免疫吸附测定(ELISA)进行检测。实验步骤:①取出试剂盒室温平衡30 min,取出血样放至室温。②配标准品:取150 μL标准品加入150 μL标准品稀释液稀释,依次稀释5次。分别于各反应孔中加入标准品50 μL,样品40 μL,标准品做复孔,样品做3孔。③分别于样品孔中加入10 μL抗体。标准品和样品孔中分别加入50 μL链酶亲和素-HRP,盖上封板膜轻轻震荡混匀,37℃温育60 min。④小心揭开封板膜,弃去液体,甩干,每孔加200 μL洗涤液,静置30 s后弃去,如此重复5次,拍干。⑤每孔先加入显色剂A 50 μL,再加显色剂B 50 μL,轻轻震荡混匀,37℃避光显色6 min。每孔加入终止液50 μL终止反应(此时蓝色立即转为黄色)。以空白孔调零,450 nm波长依序测量各孔的吸光度。测定应在加终止液10 min之内进行。保存结果并分析处理数据。
1.3 统计学方法
采用SPSS 19.0软件进行统计学处理。计量资料以均数±标准差(x±s)表示,采用两独立样本t检验,计数资料采用χ2检验,相关分析采用Pearson法。以P < 0.05为差异有统计学意义。
2 结果
2.1 两组患者基本资料比较
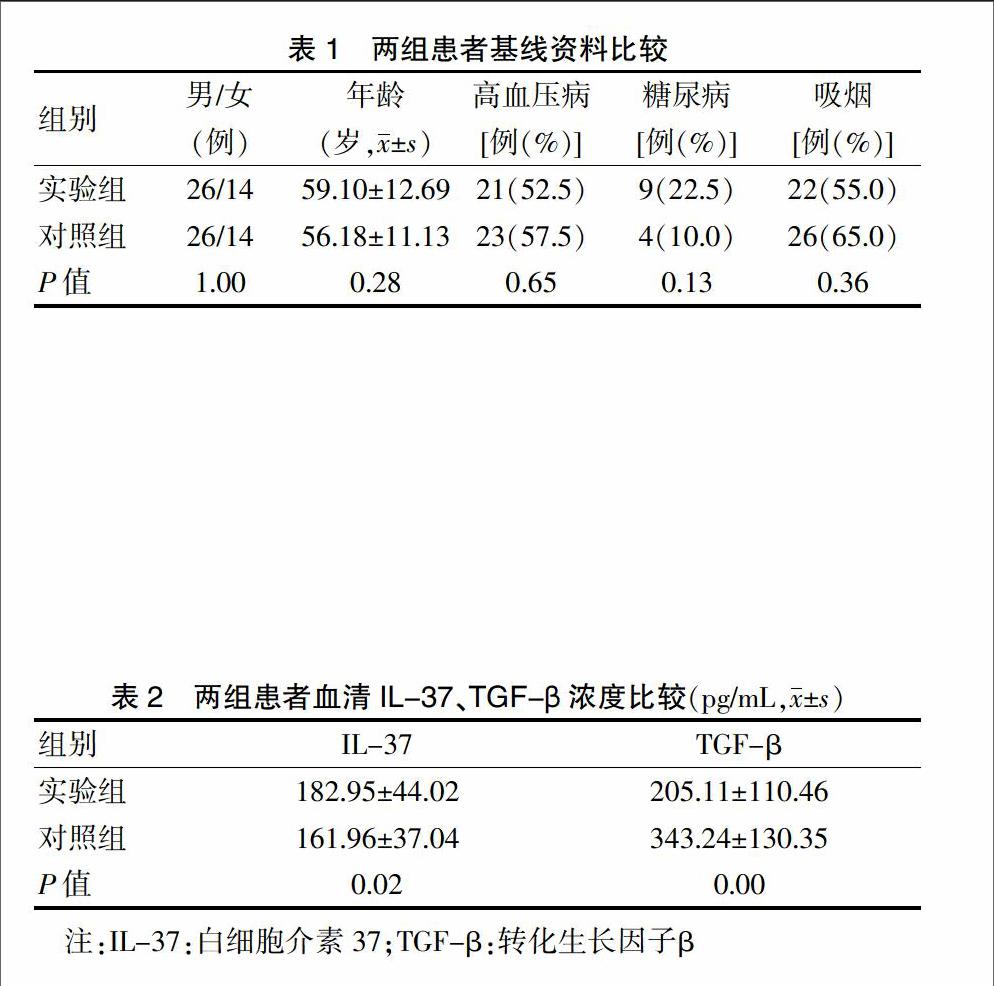
两组性别、年龄、高血压病及糖尿病患病率、吸烟率比较,差异均无统计学意义(P > 0.05)。见表1。
2.2 两组患者血清IL-37、TGF-β浓度比较
实验组患者血清IL-37浓度明显高于对照组,TGF-β浓度明显低于对照组,差异均有统计学意义(P < 0.05)。见表2。
2.3 两组患者血清IL-37、TGF-β浓度相关性
实验组IL-37与TGF-β呈负相关(r = -0.79,P = 0.00),对照组IL-37与TGF-β无明显相关性(r = 0.03,P = 0.86)。
3 讨论
以冠状动脉粥样硬化斑块为基础的心血管疾病,尤其是STEMI,严重威胁着人类健康和生命。目前观点普遍认为冠状动脉粥样硬化是大中动脉的慢性炎症性疾病,众多炎性因子和介质参与其中,抑炎因子可以延缓冠状动脉粥样硬化的进展,其中IL-1家族、TGF-β是参与冠状动脉粥样硬化斑块发生发展的重要细胞因子[10]。IL-1已被发现30余年,大多数家族成员,如IL-1α、IL-β、IL-18、IL-33等具有促炎功能,通过不同的作用机制在炎性反应及变态反应的发生、发展及转归过程中发挥着重要的作用[11]。在多种人类正常组织、肿瘤组织及细胞系中均可检测到IL-37的表达,目前关于IL-37具体的生物学功能尚未明确,但是不同于经典的IL-1家族成员,IL-37被发现具有抗炎及抑制固有免疫的作用。在生理条件下,IL-37表达水平很低,但多种炎症刺激物及相关细胞因子可使其表达增多。有研究表明,生理条件下IL-37含量很少,表达在外周血单个核细胞(PBMC)中,可以被脂多糖(LPS)等刺激,引起表达增多。使用IL-37特异性小干扰RNA(siRNA)干扰后发现,LPS刺激引起的PBMC中IL-37蛋白含量较对照组减少,同时炎性细胞因子IL-1β、IL-6、TNF表达增加2~3倍[4]。IL-37已被证实对肾缺血再灌注损伤、ConA介导的肝细胞损伤、结肠炎、肝脏肿瘤等均具有一定的作用[4,12-15]。另外IL-37被发现在参与类风湿关节炎、炎症性肠病、过敏性鼻炎等自身免疫性疾病的发生、发展中起着抑制炎性反应的作用[5,16-18]。有研究发现IL-37抑炎作用的发挥依赖Smad3的活化,用SIS3特异性阻断Smad3后,IL-37对IL-1α、IL-6的抑制作用明显减弱[19]。Nold等[4]在体外实验中应用免疫沉淀的方法发现了IL-37/Smad3复合物,体内实验结果证实将Smad3基因敲除后,IL-37的活性明显受到抑制。
TGF-β是细胞生长增殖调节蛋白超家族的成员之一,是一种经典的抑炎因子。它对多种不同类型的细胞产生强有力的、多样的影响,参与多种生物学过程,如胚胎发育、细胞生长和分化、细胞增殖和存活、纤维化、免疫和炎性反应的调节,以及参与组织损伤、修复和重塑[20]。TGF-β参与了缺血导致心肌细胞重塑的整个过程,包括促进心肌纤维化、心肌细胞凋亡、心室肥厚,并与急性心肌梗死后的射血分数降低有关。另外TGF-β在心脏缺血的早期阶段通过减低炎性反应对心肌起着保护的作用,但是对心梗后心肌重塑不利[21]。Smad蛋白是细胞内的蛋白质,它的主要作用是转导细胞外信号到细胞核内,转录并调节许多基因的表达,还参与了丝氨酸/苏氨酸激酶信号通路的转导。Smad蛋白的活性或蛋白稳定性受到多种激酶的调控。Smad3是Smad蛋白家族的一个成员,属于所谓的受体调节的R-Smad(receptor-regulated Smad),转导细胞外信号到细胞核内。Smad3也是TGF-β主要的细胞内信号传导分子,TGF-β信号通过膜结合型受体-配体复合物从细胞表面转导至细胞質,该复合物将胞质内的R-Smad磷酸化。Smad3在细胞内被TGF-β磷酸化,与其他蛋白形成复合物进入细胞核,并调节其靶基因的转录[22]。Smad3可以抑制DC活性和巨噬细胞活化,诱导T细胞耐受,抑制细胞毒作用,对于心梗引起的纤维重塑、舒张功能减低和胶原沉积所致的心室肥厚发挥有益的作用[23]。TGF-β通过Smad3信号转导通路可以刺激平滑肌细胞合成间质胶原,增强斑块的稳定性,对急性冠脉综合征具有保护作用[1]。目前研究发现TGF-β下降可导致Smad3磷酸化基团下降,导致Smad无法从细胞膜受体脱离,与Smad3信号分子结合发挥信号转导的效应[24]。由于IL-37与TGF-β具有共同的下游信号通路Smad3,当IL-37发挥抗炎作用会受到TGF-β的影响。
在本研究中,实验组与对照组年龄、性别、高血压病患病率、糖尿病患病率、吸烟率等一般资料比较无明显差异,实验组较对照组患者血清IL-37浓度明显升高,与前期研究一致[8-9]。这提示IL-37可能参与了急性心梗患者病情的发展过程,对STEMI具有保護作用。本研究也检测了血清中TGF-β的浓度,发现实验组患者血清TGF-β浓度明显低于对照组。在IL-37与TFG-β的相关性研究中发现,二者在STEMI中具有明显的负相关性。IL-37本身有抑制炎性反应的作用,升高的IL-37应该对斑块的稳定性起保护作用。由于IL-37与TFG-β具有共同的信号通路Smad3,IL-37抑炎作用的发挥依赖Smad3的活化。在心梗患者中,TGF-β下降影响了Smad3信号通路水平,可能是IL-37在STEMI中抑制炎症作用减弱的原因。STEMI的疾病过程导致了细胞因子网络的变化,显示了机体调控的复杂性。
由于本研究样本数量有限,且只研究了急性冠脉综合征中最严重的类型STEMI,结果具有一定的局限性。本研究结果提示IL-37在STEMI中显著升高,初步揭示了IL-37参与了STEMI的过程,且IL-37、TGF-β在抗炎作用上有联系,提示IL-37抗炎作用的发挥与TGF-β有关,目前具体机制仍需要进一步研究证实。
[参考文献]
[1] Hansson GK,Hermansson A. The immune system in ath?鄄erosclerosis [J]. Nat Immunol,2011,12(3):204-212.
[2] Kumar S,McDonnell PC,Lehr R,et al. Identification and initial characterization of four novel members of the interleukin-1 family [J]. J Biol Chem,2000,275(14):10308-10314.
[3] Dunn E,Sims JE,Nicklin MJ,et al. Annotating genes with potential roles in the immune system:six new mumbers of the IL-1 family [J]. Trends Immunol,2001,22(10):533-536.
[4] Nold MF,Nold-Petry CA,Zepp JA,et al. IL-37 is a fundamental inhibitor of innate immunity [J]. Nat Immunol,2010, 11(11):1014-1022.
[5] Boraschi D,Lucchesi D,Hainzl S,et al. IL-37:a new anti-inflammatory cytokine of the IL-1 family [J]. Eur Cytokine Netw,2011,22(3):127-147.
[6] Tashiro H,Shimokawa H,Sadamatu K,et al. Prognostic significance of plasma concentrations of transforming growth factor-[beta] in patients with coronary artery disease [J]. Coron Artery Dis,2002,13(3):139-143.
[7] 黄波,胡珺,郑宏超.冠心病患者血清TGF-β与IGF-1的相关性[J].中国老年病杂志,2014,34(3):1368-1369.
[8] 黄瑛,林英忠,施莹,等.急性冠脉综合症患者血浆IL-37变化水平及意义[J].实用医学杂志,2014,30(10):1559- 1561.
[9] Ji Q,Zeng Qi,Huang Y,et al. Elevated Plasma IL-37,IL-18,and IL-18BP Concentrations in Patients with Acute Coronary Syndrome [J]. Mediators Inflamm,2014,2014:165742.
[10] Libby P. Mechanisms of acute coronary syndromes and their implications for therapy [J]. N Engl J Med,2013, 368(21):2004-2013.
[11] Dinarello CA. Overview of the interleukin-1 family of ligands and receptors [J]. Semin Immunol,2013,25(6):389-393.
[12] Bulau AM,Fink M,Maucksch C,et al. In vivo expression of IL-37 reduces local and systemic inflammation in concanvalin A-induced hepatitis [J]. Sci World J,2011,11:2480-2490.
[13] Gunaltay S,Nyhlin N,Kumawat AK,et al. Differential expression of interleukin-1/Toll-like receptor signaling regulators in microscopic and ulcerative colitis [J]. World J Gastroenterol,2014,20:12249-12259.
[14] Yang Y,Zhang ZX,Lian D,et al. IL-37 inhibits IL-18-induced tubular epithelial cell expression of pro-inflammatory cytokines and renal ischemia reperfusion injury [J]. Kidney Int,2015,87(2):396-408.
[15] Zhao JJ,Pan QZ,Pan K,et al. Interleukin-37 mediates the antitumor activity in hepatocellular carcinoma:role for CD57+NK cells [J]. Sci Rep,2014,4:5177.
[16] Yang L,Zhang J,Tao J,et al. Elevated serum levels of Interleukin-37 are associated with inflammatory cytokines and disease activity in rheumatoid arthritis [J]. APMIS,2015, 123(12):1025-1031.
[17] Weidlich S,Bulau AM,Schwerd T,et al. Intestinal expression of the anti-inflammatory interleukin-1 homologue IL-37 in pediatric inflammatory bowel disease [J]. J Pediatr Gastroenterol Nutr,2014,59(2):e18-e26.
[18] Liu W,Deng L,Chen Y,et al. Anti-inflammatory effect of IL-37b in children with allergic rhinitis [J]. Mediators Inflamm,2014,2014:746846.
[19] Jinnin M,Ihn H,Tamaki K. Characterization of SIS3,a novel specific inhibitor of Smad3,and its effect on transforming growth fator-betal-induced extracellular matrix expression [J]. Mol Pharmacol,2006,69(2):597-607.
[20] Marcin D,Wei Chen,Nikolaos GF. Transforming Growth Factor(TGF)-β signaling in cardiac remodeling [J]. J Mol Cell Cardiol,2011,51(4):600-606.
[21] Euler G. Good and bad sides of TGFβ-signaling in myocardial infarction [J]. Front Physiol,2015,6:66.
[22] Derynck R,Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signaling [J]. Nature,2003,425(6958):577-584.
[23] Duan Y,Zhu W,Liu M,et al. The expression of Smad signaling pathway in myocardium and potential therapeutic effects [J]. Histol Histopathol,2016,11(15):11845.
[24] Matsuzaki K. Smad phospho-isoforms direct context-dependent TGF-β signaling [J]. Cytokine Growth Factor Rev,2013,24(4):385-399.
(收稿日期:2017-03-07 本文編辑:张瑜杰)
