健脾益肾丸对肾脏纤维化大鼠TGF-β1/Smads信号通路相关基因表达的研究*
2017-08-24深圳市中医院中药实验室深圳市医院中药制剂研究重点实验室深圳518033
深圳市中医院中药实验室 深圳市医院中药制剂研究重点实验室(深圳518033)
邹美南 郑 平 李中桂 郑 琳 魏俊婷 王曼茹 江 霞 易铁钢△ 李顺民△ 陈剑平 张尚斌
健脾益肾丸对肾脏纤维化大鼠TGF-β1/Smads信号通路相关基因表达的研究*
深圳市中医院中药实验室 深圳市医院中药制剂研究重点实验室(深圳518033)
邹美南 郑 平 李中桂 郑 琳 魏俊婷 王曼茹 江 霞 易铁钢△李顺民△陈剑平 张尚斌
目的:研究健脾益肾丸对5/6肾切除大鼠模型肾损伤的改善作用,并分析探讨其可能存在的机制。方法:40只SD大鼠随机分为假手术组、模型对照组、健脾益肾丸低剂量组(2.06 g/kg·d-1)、健脾益肾丸高剂量组(10.89 g/kg·d-1)、培哚普利组(4 mg/kg·d-1),每组10只。造模4个月后开始给药,连续给药6周。6周后处死大鼠,留取血清,采用酶联免疫吸附试验法检测血肌酐(Scr)、尿素氮(BUN);采用实时荧光定量PCR法检测肾组织TGF-β1、Smad2、Smad3 mRNA基因表达。结果:健脾益肾丸不同剂量均可明显降低大鼠血清Scr、BUN水平(P<0.01/P<0.05),下调TGF-β1、Smad2、Smad3 mRNA基因表达(P<0.01);培哚普利作为西药阳性对照,可明显降低大鼠血清Scr、BUN水平(P<0.01/P<0.05),下调TGF-β1、Smad2、Smad3 mRNA基因表达(P<0.01)。结论:健脾益肾丸能有效改善5/6肾切除慢性肾衰大鼠模型肾功能;其机制可能与下调TGF-β1、Smad2、Smad3水平,从而抑制过度激活的TGF-β1/Smads信号通路有关。
健脾益肾丸;肾切除模型;肾纤维化;慢性肾衰;脾肾阳虚;TGF-β1/Smads信号通路
Effect ofJianpiYishenPill on Relative Gene Expression of TGF-β1/SmadsSignal Path in Rats with Renal FibrationChinese Medicine Laboratory, Shenzhen Hospital of Traditional Chinese MedicineKey Laboratory of Chinese Medicine Preparation, Shenzhen Hospital
健脾益肾丸是基于“玉屏风散”、《圣济总录》“四精丸”、《金匮要略》之“大黄甘草汤”,并结合治疗慢性肾功能衰竭20余年的临床经验总结制成的中药制剂。[1-2]该方由黄芪、白术、山药、酒苁蓉、白豆蔻、丹参、炙甘草及大黄8味药组成,具有健脾益肾、活血化浊之功,主治慢性肾功能衰竭脾肾阳气虚,兼有湿浊、水气和瘀毒等症。临床上应用可降低各种尿毒症毒素,改善临床症状,延缓慢性肾衰的进展。肾脏纤维化是慢性肾脏疾病不断进展的共同病理改变,是导致终末期肾衰竭的主要病因。[3]肾脏纤维化常伴有肾小管萎缩、间质炎性细胞浸润、成纤维细胞聚积以及间质基质沉积等特征性病理改变。转化生长因子-β1(TGF-β1)一直以来被认为在肾脏纤维化中重要的调控因子,而Smad2和Smad3则作为TGF-β1生物效应2个重要的下游调控因子。[4]近年来以TGF-β1、Smad2和Smad3为靶点的干预手段及抗肾纤维化的分子研究引起人们的关注。因此,笔者采用5/6肾切除大鼠模型,研究健脾益肾丸对慢性肾损伤的影响及可能机制,探讨健脾益肾丸是否通过调控TGF-β1/Smads信号通路发挥作用,为健脾益肾丸临床上防治慢性肾衰肾脏纤维化提供理论依据。
1 材料
1.1 动物 SPF级SD大鼠,由广东省医学实验动物中心提供,实验动物生产许可证号SCXK(粤)2013-0002,实验动物质量合格证号:44007200026770。
1.2 药品及试剂 健脾益肾丸(深圳市中医院制剂科,批号20151221);培哚普利〔施维雅(天津)制药有限公司〕;肌酐(Scr)测定试剂盒(南京建成生物工程研究所,批号:20160419);尿素氮(BUN)测试盒(南京建成生物工程研究所,批号:20160415); TransZol Up Plus RNA Kit(北京全式金生物技术有限公司,货号:ER501);TransScript II All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(北京全式金生物技术有限公司,货号:AH141);TransStart Eva Green qPCR SuperMix(北京全式金生物技术有限公司,货号:AQ501)。
1.3 仪器 J3000动物电子秤(G&G公司);BS224S电子天平(1/万)(德国SARTORIUS公司);HH-6数显恒温水浴锅(金坛市富华仪器有限公司);3K30离心机(美国SIGMA公司);5424型小型高速离心机(德国 Eppendorf 公司);-80℃ 超低温冰箱(美国Thermo公司);Varsoskan Flash多功能酶标仪(美国Thermo公司);Bio-Rad CFX96荧光定量PCR检测系统(美国Bio-Rad公司)。
2 方法
2.1 分组、造模及给药 SD大鼠先适应性喂养7 d,随机分为假手术组、模型对照组、健脾益肾丸高、低剂量组、培哚普利组,每组10只。以10%水合氯醛腹腔注射麻醉动物,常规消毒铺巾,从右背部切口,打开腹腔。静脉夹夹住肾蒂后用高频电刀切除右肾上下极(切除2/3),止血后复位肾脏。2周后进行第2次手术,切除左侧肾脏。假手术组采取同样步骤打开腹腔,暴露肾脏后复位,避免牵拉肾脏。术后继续饲养动物,期间密切观察并记录大鼠的体质量、毛发、精神状态等情况。造模4个月后开始给药,健脾益肾丸低剂量组按2.06 g/kg·d-1、高剂量按10.89 g/kg·d-1,培哚普利组按4 mg/kg·d-1,给药量为10 mL/kg,实验时以蒸馏水按剂量配制成所需浓度,其余各组给以相同量的蒸馏水,连续给药6周。
2.2 标本采集 在给药第6周末,眼球采集血液,并分离血清,-20℃保存。切取双侧肾脏,用滤纸吸干肾表面血液后,将肾组织置液氮中冷冻后,以-80℃冰箱保存以备后续指标检测。
2.3 肾功能检查 按试剂盒的操作说明,采用多功能酶标仪测定血清中Scr、BUN水平。
2.4 总RNA的提取及质检 取-80 ℃ 冻存的肾组织标本,在液氮冷冻条件下使用研钵和研棒敲碎部分样品后,取100 mg样品充分研磨成粉末,按照TransZol Up Plus RNA Kit说明书上要求进行总RNA提取,并使用100 μL RNase-free Water进行洗脱;最后使用Nanodrop进行浓度和纯度检测,取1 μL 总RNA进行1.5%TAE琼脂糖凝胶电泳检测,判断提取的总RNA的完整性。
2.5 实时荧光定量聚合酶链式反应(Real-time PCR)检测TGF-β1、Smad2、Smad3 mRNA表达 采用TransScript II All-in-One First-Strand cDNA SynthesisSuperMix for qPCR反转录试剂盒将2 μg 总RNA反转录成cDNA。以GAPDH为内参,采用相对定量2-△△Ct法计算。引物系列,TGF-β1引物上游:5’-AAC AAT TCC TGG CGT TAC CTT-3’,下游:5’-GCC CTG TAT TCC GTC TCC TT-3’,片段长度123 bp;smad2引物上游:5’-GAA CTG CGA ATA CGC TTT CAG T-3’,下游:5’-AGT GGG TAT AGT CAT CCA GAG GC-3’,片段长度155 bp;smad3引物上游:5’-CAG GGC TTT GAG GCT GTC TAC-3’,下游:5’-CAT CTG GGT GAG GAC CTT GTC-3’,片段长度171 bp; GAPDH为内参,引物上游:5’-CAG CCC AGA ACA TCA TCC CT-3’,下游:5’-CGG CAT GTC AGA TCC ACA AC-3’,片段长度105 bp。

3 结果
3.1 对5/6肾切除大鼠血清Scr、BUN的影响 与假手术组相比,模型对照组大鼠血清Scr、BUN含量显著升高,差异具有非常显著性(P< 0.01)。与模型对照组相比,健脾益肾丸高、低剂量组大鼠血清Scr含量明显降低,差异具有显著性(P< 0.01/P< 0.05);健脾益肾丸高、低剂量组,培哚普利组血清BUN含量明显降低,差异具有非常显著性(P< 0.01)。结果见图1。

注:与假手术组比较,*P< 0.05,**P< 0.01;与模型组比较,#P< 0.05,##P< 0.01
图1 健脾益肾丸对5/6肾切除大鼠血清Scr、BUN的影响
3.2 各组大鼠肾组织TGF-β1 mRNA表达 与假手术组相比,模型对照组、健脾益肾丸组、培哚普利组TGF-β1 mRNA表达显著升高,差异具有非常显著性(P< 0.01)。与模型对照组相比,健脾益肾丸高、低剂量组、培哚普利组TGF-β1 mRNA表达明显降低,差异具有非常显著性(P< 0.01)。结果见图2。
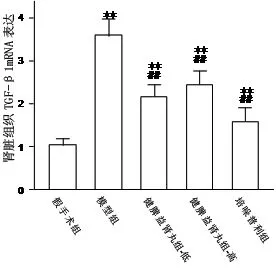
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
图2 健脾益肾丸对5/6肾切除大鼠肾组织TGF-β1 mRNA表达的影响
3.3 各组大鼠肾组织Smad2 mRNA表达 与假手术组相比,模型对照组Smad2 mRNA表达显著升高,差异具有非常显著性(P<0.01)。与模型对照组相比,健脾益肾丸高、低剂量组、培哚普利组Smad2 mRNA表达明显降低,差异具有非常显著性(P<0.01);结果见图3。
3.4 各组大鼠肾组织Smad3 mRNA表达 与假手术组相比,模型对照组Smad3 mRNA表达显著升高,差异具有非常显著性(P<0.01)。与模型对照组相比,健脾益肾丸高、低剂量组、培哚普利组Smad3 mRNA表达明显降低,差异具有非常显著性(P<0.01);结果见图4。
3 讨论
调查研究显示,慢性肾脏病在全球的发病率在8%~16%左右,而中国成年人群中慢性肾脏病的患病率约为10.8%,且该指标有逐年增高的趋势。[5-6]肾脏纤维化是所有慢性肾脏疾病发展至终末期肾脏病的最后共同通路,目前针对肾病纤维化的治疗没有确切的西药,而中医在防治肾脏纤维化方面的作用逐渐引起关注。健脾益肾方是单位临床应用20余年之验方,其在改善慢性肾衰患者的蛋白尿、延缓肾功能进展方面有确切疗效。临床观察显示,该方能降低Scr和BUN水平,保护和稳定肾功能,提高患者的生活质量。[2,7]笔者在汤剂的基础上经工艺筛选制成丸剂,[8]同样证实健脾益肾丸可以显著降低5/6肾切除模型大鼠血清Scr和BUN水平,改善大鼠的肾功能。
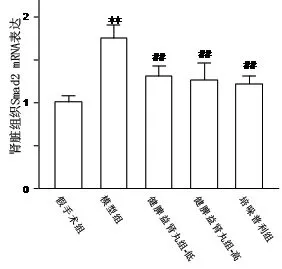
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
图3 健脾益肾丸对5/6肾切除大鼠肾组织Smad2 mRNA表达的影响
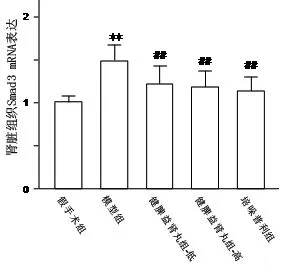
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
图4 健脾益肾丸对5/6肾切除大鼠肾组织Smad3 mRNA表达的影响
TGF-β1被认为是肾脏纤维化形成和发展的关键调控因子,而TGF-β1/Smads通路在肾脏纤维化的发生发展过程中起到重要的作用。TGF-β1与其受体结合后,激活下游的Smad2/3蛋白,并形成具有活性的复合物进入细胞核内,从而调节目的基因的转录,如各型胶原的表达,导致细胞外基质的积聚,引起肾脏纤维化的形成和发展。[9-11]因此,通过调控TGF-β1及下游Smad2/3等的表达,将是延缓肾脏纤维化的进程有效途径。本研究结果显示,健脾益肾丸能显著降低5/6肾切除大鼠肾组织中TGF-β1、Smad2/3的基因表达,提示健脾益肾丸可能通过TGF-β1/Smads信号通路发挥防治肾脏纤维化的作用。健脾益肾丸方中重用黄芪益气健脾升阳运化为君;白术、山药健脾补肾,以助肾脏气化为臣;酒苁蓉温肾扶阳、润肠通便,白豆蔻温中化湿行气共为佐药;丹参活血祛瘀,大黄消癥散结、荡涤肠胃、推陈致新共为使,可开启脾胃升降之枢,通腑泻浊,清解血分之毒;炙甘草健脾而调和诸药。有研究报道,黄芪所含的有效成分黄芪甲苷能延缓通过调控TGF-β/Smads信号通路下调TGF-β1、Smad2/3和ɑ-SMA表达起到延缓糖尿病小鼠肾脏纤维化进程。[12]同样,在体内外的研究中,以黄芪为君药的中药复方黄芪汤也能通过TGF-β/Smads通路改善肾脏纤维化。[13]此外,处方中丹参、大黄提取物及其含有的丹酚酸B和大黄酸也具有抗纤维化的作用。[14]笔者在前期健脾益肾丸的化学分析中测定该制剂含有黄芪甲苷、丹酚酸B等8个有效成分,[15]可以推断健脾益肾丸抗肾脏纤维化可能是通过处方中多个成分共同起作用的结果,而确切有效物质基础的研究将在是下一步的工作中进行。
本研究设定高、低2个剂量进行试验,其中高剂量为临床等效剂量,低剂量为1/4临床等效剂量。研究结果显示,剂量的高低与对大鼠的肾功能和肾脏基因表达作用不呈正比。健脾益肾丸高剂量组在下调BUN水平和Smad2/3表达方面优于低剂量组;而低剂量组在下调Scr水平和TGF-β1表达方面优于高剂量组。笔者推测可能设定的高、低剂量组处于药物作用的平顶区,之后的量效筛选中设定剂量范围时应整体调低。此外,本实验未进一步测定肾脏组织中TGF-β1和Smad2/3的蛋白表达,这是本研究的不足之处。前期研究中,笔者采用ELISA法检测显示健脾益肾方汤剂可降低尿TGF-β1水平,[16]故推测健脾益肾丸对肾脏组织中TGF-β1和Smad2/3的蛋白表达与基因表达的趋势一致,即可降低TGF-β1和Smad2/3的蛋白表达,但具体的结果需进一步的实验确认。
[1]李顺民,傅博,易铁钢,等.健脾益肾方(法)治疗慢性肾功能衰竭及其营养不良的研究[J].中华中医药学刊,2008,26(10):2 102-2 104
[2]李顺民,杨曙东.健脾益肾方治疗脾肾气虚型慢性肾功能衰竭46例疗效观察[J]. 新中医,2005,37(10):36-37
[3]EddyAA,NeilsonEG. Chronic kidney disease progression [J].J Am Soc Nephrol, 2006, 17(11): 2 964-2 966
[4]LanHY. Diverse Roles of TGF-β/Smads in Renal Fibrosis and Inflammation [J]. Int J Biol Sci, 2011, 7(7): 1 056-1 067
[5]JhaV,Garcia-GarciaG,IsekiK, et al. Chronic kidney disease: global dimension and perspectives [J]. Lancet, 2013, 382(9888): 260-172
[6]ZhangL,WangF,WangL, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey [J]. Lancet, 2012, 379(9818): 815-822
[7]易铁钢,祁爱蓉,易无庸.健脾益肾方治疗慢性肾衰竭62例临床观察[J].中国中西医结合肾病杂 志,2004,5(3):149-151
[8]陈剑平,张尚斌,郑平,等. 正交试验优化健脾益肾丸的水提工艺[J]. 中国药房,2016,27(34): 4 833-4 835
[9]KavsakP,RasmussenRK,CausingCG, et al. Smad7 binds to Smurf2 to form an E3 ubiquitin ligase that targets the TGF beta receptor for degradation [J]. Mol Cell, 2000, 6(6): 1 365-1 375
[10]EbisawaT,FukuchiM,MurakamiG, et al. Smurf1 interacts with transforming growth factor-beta type I receptor through Smad7 and induces receptor degradation [J]. J Biol Chem, 2001, 276(16): 12 477-12 480
[11]杨彦裕,魏明刚,刘蔚,等. 芪归益肾方对UUO小鼠肾组织TGF-1/Smads/PI3K信号通路的影响[J]. 中国实验方剂学杂志,2016,22(6):89-93
[12]WangY,LinC,RenQ, et al. Astragaloside effect on TGF-β1, SMAD2/3, and α-SMA expression in the kidney tissues of diabetic KKAy mice [J]. Int J Clin Exp Pathol, 2015, 8(6):6 828-6 834
[13]ZhaoJ,WangL,CaoAL, et al. Huangqi decoction ameliorates renal fibrosis via TGF-β/Smad signaling pathway in vivo and in vitro [J]. Cell Physiol Biochem, 2016, 38(5): 1 761-1 774
[14]HuQ,NoorM,WongYF, et al. In vitro anti-fibrotic activities of herbal compounds and herbs [J]. Nephrol Dial Transplant, 2009, 24(10): 3 033-3 041
[15]陈剑平,郑平,李中桂,等. HPLC-MS法同时测定健脾益肾丸中8个成分的含量[J]. 药物分析杂 志,2017,37(6):962-967
[16]傅博,李顺民,祁爱蓉,等. 健脾益肾方对5/6肾切除大鼠尿转化因子-β1表达的影响[J]. 中国中西医结合肾病杂志,2013,14(7):599-600
(2017-07-07 收稿)
ZOUMei-nanZHENGPingLIZhong-guiZHENGLinWEIJun-tingWANGMan-ruJIANGXia
YITie-gangLIShun-minCHENJian-pingZHANGShang-bin
(Shenzhen 518033)
Objective: to study the improvement function ofJianpiYishenPill on renal injury of 5/6 nephrectomy in rats, and to explore the possible mechanism. Methods: 40 SD rats were randomly divided into sham operation group, control group, low dose ofJianpiYishenPill group (2.06 g/kg·d-1), high dose group (10.89 g/kg·d-1), and Perindopril group (4 mg/kg·d-1), 10 rats a group. 4 months after models finished, administration began and it lasted for 6 weeks. The rats were then killed with serum taken. Enzyme-linked immunosorbent test was used to detect serum creatinine (Scr) and blood urea nitrogen (BUN), and real-time fluorescence quantification PCR to detect gene expressions of TGF-β1, Smad2, Smad3 and mRNA. Results: both high and low dose ofJianpiYishenPill could significantly decrease Scr and BUN (P<0.01/P<0.05) and lower TGF-β1, Smad2, Smad3 and mRNA expressions (P<0.01); Perindopril could significantly decrease Scr and BUN (P<0.01/P<0.05) and lower TGF-β1, Smad2, Smad3 and mRNA expressions (P<0.01). Conclusion:JianpiYishenPill can effectively improve the renal function of 5/6 nephrectomy in rats with chronic renal failure, whose mechanism may be related to inhibiting the excessive activated TGF-β1/Smads signal path through lowering TGF-β1, Smad2 and Smad3.
JianpiYishenPill; nephrectomy model; renal fibration; chronic renal failure; spleen-kidney yang deficiency; TGF-β1/Smads signal path
*广东省自然科学基金项目:No.2015A030310247; 广东省中医药局项目:No.20162124; 深圳市科技计划项目:No.JSGG20141017 103353178、 ZDSYS201606081515458、 JCYJ20160428182041577
张尚斌,男,主任药师,研究方向:中药新药。
R285.5
A
1007-5615(2017)04-0007-05
△深圳市中医院肾病科(深圳 518033)
