常染色体显性遗传性少毛症分子遗传学研究进展
2017-08-24黄鹤群汤华阳孙良丹陈梦云徐明贵许奕荟许静凯张学军
黄鹤群 汤华阳 孙良丹 陈梦云 徐明贵 许奕荟 许静凯 张学军
常染色体显性遗传性少毛症分子遗传学研究进展
黄鹤群 汤华阳 孙良丹 陈梦云 徐明贵 许奕荟 许静凯 张学军
遗传性少毛症是一种表现为毛发永久性部分或完全缺失的单基因遗传性疾病,按遗传异质性分为常染色体显性遗传、常染色体隐性遗传、X连锁显性遗传、X连锁隐性遗传。本文重点介绍常染色体显性遗传性少毛症的各种亚型:遗传性单纯性头皮性少毛症(HSS)、遗传性单纯性少毛症(HHS)、Marie Unna型少毛症(MUHH)、常染色体显性羊毛状发(ADWH)、生长期毛发松动综合征(LAHS)等分子遗传学研究进展。
少毛症; 突变位点; 分子遗传
遗传性少毛症是一组罕见的单基因遗传性疾病,主要表现为毛发局限性或弥漫性的稀少或缺失,活组织检查可以发现毛囊的减少、缺失或毛球萎缩。目前已发现有以下几种,现综述如下。
1 遗传性头皮单纯性少毛症(hypotrichosis simplex of scalp,HSS)
HSS是一种罕见的仅表现为头发脱落的遗传性脱发性疾病,呈常染色体显性遗传。目前发现的主要致病基因为CDSN。
Levy-Nissenbaum等[1]对西班牙、以色列及丹麦3个HSS家系进行研究,发现为致病基因CDSN的Q215X和Q200X无义杂合突变。Davalos等[2]对一个墨西哥HSS家系进行研究,验证CDSN基因Y239X无义杂合突变。Huang等[3]对一中国家系进行测序,在cDNA上发现突变T1229C、C1317G、A1579G(图1)。CDSN基因编码的角化桥粒素蛋白,在表皮和毛囊的内毛根鞘处均有表达,在正常头发的生长中具有重要的作用。然而CDSN基因的突变可导致多肽链翻译的提前终止,形成结构不完整的角化桥粒素蛋白,影响毛发的正常生长,导致先天性头皮单纯性少毛症,同时CDSN基因与银屑病和广泛的表皮剥脱性皮炎综合征有关,而HSS与银屑病及表皮剥脱性皮炎是否有关,仍有待进一步研究。
2 遗传性单纯性少毛症(hereditary hypotrichosis simplex,HHS)
HHS是一种以毛囊微型化为特征的常染色体显性遗传性毛发性疾病,HHS目前发现的主要致病基因为APCDD1、RPL21和SNRPE。Shimomura等[4]对2个巴基斯坦HHS家系进行测序发现致病基因APCDD1及基因信号肽上的杂合突变(c.26T>G,L9R)。Li等[5]对一个中国HHS家系进行研究,验证了APCDD1基因突变(图2a)。APCDD1基因位于染色体18p11.22上,能够编码一种在毛囊中大量表达的膜结合糖蛋白,这种蛋白与Wnt信号通路中的两个关键分子LRP5和Wnt3A相互作用,从而影响毛囊的形态。功能学研究表明APCDD1以细胞自主方式抑制Wnt3信号通路和β-连环蛋白的上游功能,此外APCDD1还抑制Wnt信号及目标基因的激活,从而抑制Wnt信号通路的生物学效应。Leu9Arg突变位于APCDD1信号肽上,可以扰乱蛋白质从内质网到细胞膜的翻译过程,导致蛋白质合成障碍,产生生物学效应。Zhou等[6]对一例中国HHS家系进行连锁分析,发现致病基因RPL21基因及致病性突变c.95G>A(图2b)。RPL21基因位于13q12.12-12.3上,编码核糖体蛋白L21,核糖体蛋白L21是60S亚基的组成部分,由160个氨基酸残基构成,属于核糖体蛋白L21e家族。它存在于细胞的细胞质中,是核糖体的组成成分,对于蛋白质的合成必不可少,可调节胚芽生成。由于mRNA要竞争有限的核糖体,则二倍体生物体中核糖体蛋白单倍剂量的不足,可能会导致翻译的低效率和翻译产物的光谱改变,而导致头发生长的缺陷。但RPL21基因的突变造成HHS的具体机制仍有待进一步研究。2013年Pasternack等[7]对一例西班牙家系进行研究,将致病基因定位在1q31.3-1q41,通过直接测序发现了c.1A>G杂合性突变,导致下游起始密码子的缺失突变。随后又在一例英国家系中发现了相同的突变,在一例突尼斯家系发现新的杂合性突变c.133G>A(图2c),SNRPE基因编码snRNPs核心蛋白是mRNA前体加工过程的关键因素。
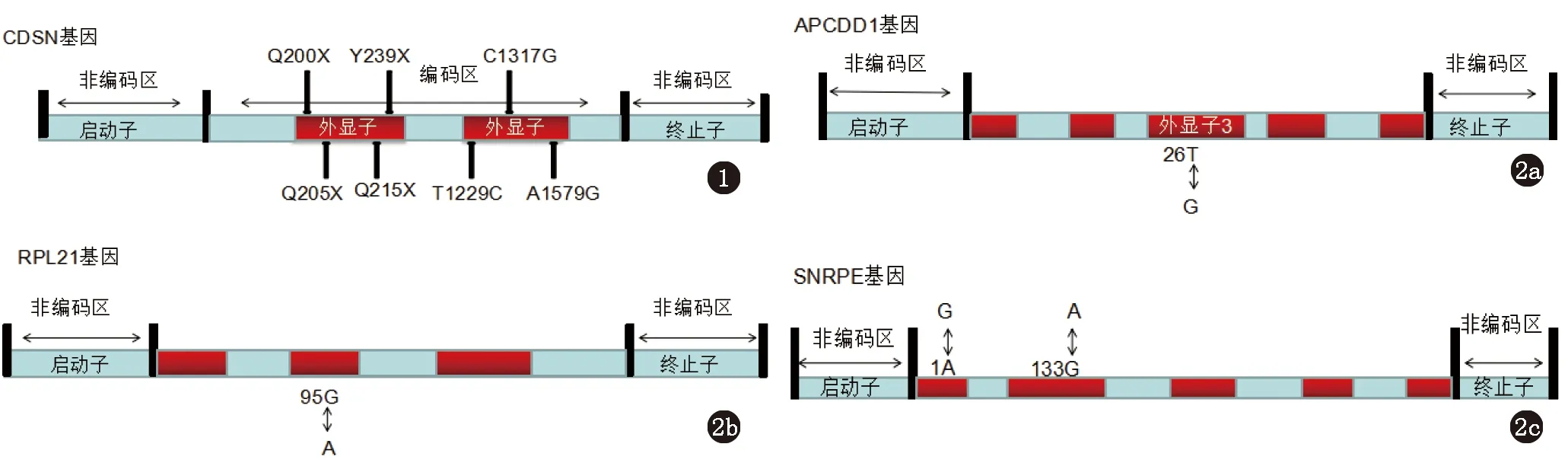
图1 HSS的致病基因CDSN突变位点分布图 图2 2a HHS的致病基因APCDD1突变位点分布图;2b HHS的致病基因RPL21突变位点分布图;2c HHS的致病基因SNRPE突变位点分布图
3 Marie Unna型遗传性少毛症(marie Unna hereditary hypotriehosis,MUHH)
MUHH是一种罕见的毛发生长周期紊乱性疾病,呈常染色体显性遗传。目前发现的主要致病基因为U2HR和EPS8L3。2005年Yang等[8]对一例中国家系进行研究,将该家系致病基因定位于1p21.1-1q21.3上的D1S248~D1S2345之间17.5cM区域,该区域包含人类无毛基因HR基因。2009年Wen等[9]对一例中国MUHH家系进行研究,在HR基因的5'-非翻译区(5'untranslated region, 5'-UTR),上游的开放读码框(upstream open reading frame,UORF)U2HR中发现了起始密码子突变2T-C,7T-C,73C-G,104A-G。2010年Mansur等[10]在一例土耳其家系中发现U2HR基因在开放阅读框中起始密码子突变2T-C。随后Kim等[11]对一例高加索家系进行测序,发现HR基因转录起始点位置的突变320T-C。2012年Zhou等[12]对一例中国家系进行研究,在U2HR发现了一个新的起始密码子突变14C-T。2014年,Yun等[13]对韩国一家系进行研究,在U2HR上发现了一个新的起始密码子杂合错义突变80C-T(图3a)。U2HR编码由34个氨基酸组成的小分子多肽,若U2HR发生致病突变则会导致其下游的HR基因翻译抑制的丧失,从而会使HR基因的翻译蛋白量增加,由此推断,HR蛋白质水平必须保持在一定范围内才能防止毛发的脱落。
2012年Zhang等[14]对一例中国MUHH家系进行突变检测,发现EPS8L3基因突变(外显子2:c.22G>A)(图3b)。EPS8L3属于EPS8基因家族,EPS8参与表皮生长因子受体(epider-mal growth factor receptor,EGFR)通路,EGFR通路主要是传输细胞外促有丝分裂信号,如转化生长因子 (TGFa)和表皮生长因子。EGFR通路信号不仅对毛发生长的起始有着至关重要的作用,而且对延迟毛囊的变异、保护毛囊免受免疫损害也非常重要。EGFR还可通过调控毛发的生长周期及毛囊形态的发生和发展而发挥作用,由此推测,EPS8L3基因突变可能是通过对减少毛囊数量、改变毛囊形态及毛发生长周期而导致脱发。
4 常染色体显性遗传性羊毛状发(autosomal dominant woolly hair,ADWH)
ADWH是一种少见的头发似羊毛状外观的遗传性疾病,可呈常染色体显性遗传,目前发现的主要致病基因为KRT74和KRT71。
2010年Shimomura等[15]对2例巴基斯坦ADWH家系进行研究,将致病基因定位于染色体12q12-q14.1区域的KRT74基因上,并检测到外显子1(c.444C>G)杂合突变。2011年Wasif等[16]发现KRT74基因内含子8上剪接受体位点突变(c.IVS8-1G>A)和外显子9的错义突变(c.1444G>A)。2014年Raykova等[17]检测发现外显子4(c.821T>C)(图4a)。2012年又有研究者对一个日本ADWH家系进行研究[18],排除了已知的致病基因并发现了KRT71基因突变(c.422T>G,p.Phel41Cys)(图4b)。KRT74基因由九个外显子构成,编码内根鞘(inner root sheath,IRS)的特异性上皮角蛋白74,IRS是支持和使毛干成形的关键结构,共三层:IRS角质层、Huxley层、Henle层。在人类毛囊的IRS中一共有四种II型上皮角蛋白,分别为K71~K74,且在IRS的不同分层中进行表达。KRT71-74基因突变可导致角蛋白中间丝的形成障碍,从而影响毛发的生长。
5 生长期毛发松动综合征(loose anagen hair syndrome, LAHS)
LAHS是一种罕见的常染色体显性遗传性毛发疾病,目前发现的主要致病基因为K6HF。Chapalain等[19]对9个LAHS家系进行基因突变检测,发现其中有3个家系患者的K6HF基因发生外显子1的GCC-ACC突变,随后又对外显子2-9进行测序,发现两个杂合性突变G-A和T-C。2004年Winter等[20]对一高加索家系三代进行测序,在K6HF基因发现了一个G-A的杂合性突变(图5),导致了丙氨酸与苏氨酸的替代。K6HF基因主要编码一种毛囊内的角蛋白,该基因的突变可能会导致生长期头发毛小皮与内毛根鞘之间黏附异常,从而导致头发松动易拔。
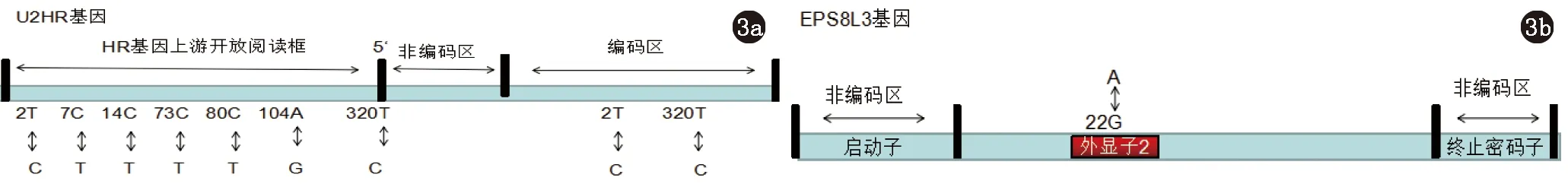
图3 3a MUHH的致病基因U2HR突变位点分布图;3b MUHH的致病基因EPS8L3突变位点分布图
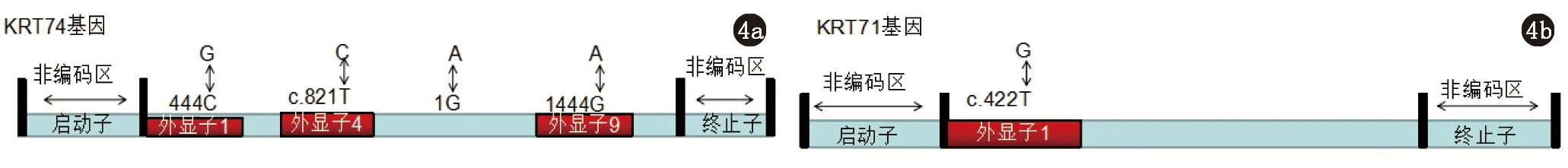
图4 4a ADWH的致病基因KRT74突变位点分布图;4b ADWH的致病基因KRT71突变位点分布图
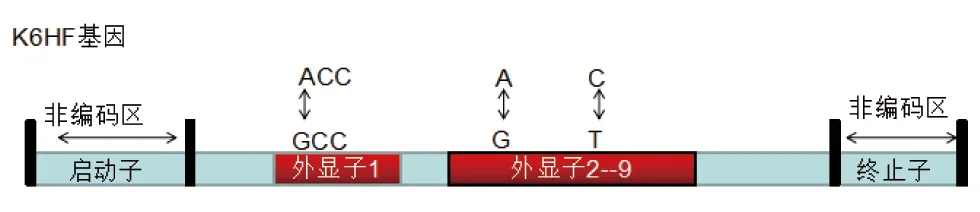
图5 LAHS的致病基因K6HF突变位点分布图
6 讨论
遗传性少毛症致病基因和突变位点的频繁报道,丰富了此类疾病的遗传突变谱,为此类疾病的产前诊断、基因治疗等提供理论基础,尤其是产前诊断,可以通过分子遗传学检测,对此类疾病进行有效的预防,如遗传性大疱性表皮松解症,目前最有效的预防方式就是产前诊断,但是,此类疾病的具体发病机制目前尚不十分清楚,对已发病者及其后代的高患病率,仍缺乏有效的解决方法,这些也是我们医学工作者即将面临的新课题。
[1] Levy-Nissenbaum E, Betz RC, Frydman M, et al. Hypotrichosis simplex of the scalp is associated with nonsense mutations in CDSN encoding corneodesmosin[J]. Nat Genet,2003,34(2):151-153.
[2] Davalos NO, Garcia-Vargas A, Pforr J, et al. A non-sense mutation in the corneodesmosin gene in a Mexican family with hypotrichosis simplex of the scalp[J]. Bri J Dermatol,2005,153(6):1216-1219.
[3] Huang XS, Jiang HO, Quan QL. Clinical investigation of a Chinese family with hypotrichosis simplex of the scalp and mutational analysis of CDSN gene[J]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi,2012;29(4):452-454.
[4] Shimomura Y, Agalliu D, Vonica A, et al. APCDD1 is a novel Wnt inhibitor mutated in hereditary hypotrichosis simplex[J]. Nature,2010,464(7291):1043-1047.
[5] Li M, Cheng R, Zhuang Y, et al. A recurrent mutation in the APCDD1 gene responsible for hereditary hypotrichosis simplex in a large Chinese family[J]. Bri J Dermatol,2012,167(4):952-954.
[6] Zhou C, Zang D, Jin Y, et al. Mutation in ribosomal protein L21 underlies hereditary hypotrichosis simplex[J]. Hum Mutat,2011,32(7):710-714.
[7] Pasternack SM, Refke M, Paknia E, et al. Mutations in SNRPE, which encodes a core protein of the spliceosome, cause autosomal-dominant hypotrichosis simplex[J]. Am J Hum Genet,2013,92(1):81-87.
[8] Yang S, Gao M, Cui Y, et al. Identification of a novel locus for Marie Unna hereditary hypotrichosis to a 17.5 cM interval at 1p21.1-1q21.3[J]. J Investi Dermatol,2005,125(4):711-714.
[9] Wen Y, Liu Y, Xu Y, et al. Loss-of-function mutations of an inhibitory upstream ORF in the human hairless transcript cause Marie Unna hereditary hypotrichosis[J]. Nat Genet,2009,41(2):228-233.
[10] Mansur AT, Elcioglu NH, Redler S, et al. Marie Unna hereditary hypotrichosis: a Turkish family with loss of eyebrows and a U2HR mutation[J]. Am J Med Genetics Part A,2010,152a(10):2628-2633.
[11] Kim JK, Kim E, Baek IC, et al. Overexpression of Hr links excessive induction of Wnt signaling to Marie Unna hereditary hypotrichosis[J]. Hum Mol Genet,2010,19(3):445-453.
[12] Zhou C, Zang D, Ma X, et al. Identification of a novel U2HR mutation c.14C>T in a Chinese patient with Marie Unna hereditary hypotrichosis[J]. Euro J Dermatol,2012,22(1):34-35.
[13] Yun SK, Cho YG, Song KH, et al. Identification of a novel U2HR mutation in a Korean woman with Marie Unna hereditary hypotrichosis[J]. Int J Dermatol,2014,53(11):1358-1361.
[14] Zhang X, Guo BR, Cai LQ, et al. Exome sequencing identified a missense mutation of EPS8L3 in Marie Unna hereditary hypotrichosis[J]. J Med Genet,2012,49(12):727-730.
[15] Shimomura Y, Wajid M, Petukhova L, et al. Autosomal-dominant woolly hair resulting from disruption of keratin 74 (KRT74), a potential determinant of human hair texture[J]. Am J Hum Genet,2010,86(4):632-638.
[16] Wasif N, Naqvi SK, Basit S, et al. Novel mutations in the keratin-74 (KRT74) gene underlie autosomal dominant woolly hair/hypotrichosis in Pakistani families[J]. Hum Genet,2011,129(4):419-424.
[17] Raykova D, Klar J, Azhar A, et al. Autosomal recessive transmission of a rare KRT74 variant causes hair and nail ectodermal dysplasia: allelism with dominant woolly hair/hypotrichosis[J]. PLoS One,2014,9(4):e93607.
[18] Fujimoto A, Farooq M, Fujikawa H, et al. A missense mutation within the helix initiation motif of the keratin K71 gene underlies autosomal dominant woolly hair/hypotrichosis[J]. J Investi Dermatol,2012,132(10):2342-2349.
[19] Chapalain V, Winter H, Langbein L, et al. Is the loose anagen hair syndrome a keratin disorder?. A clinical and molecular study[J]. Arch Dermatol,2002,138(4):501-506.
[20] Winter H, Schissel D, Parry DA, et al. An unusual Ala12Thr polymorphism in the 1A alpha-helical segment of the companion layer-specific keratin K6hf: evidence for a risk factor in the etiology of the common hair disorder pseudofolliculitis barbae[J]. J Investi Dermatol,2004,122(3):652-657.
(收稿:2016-06-28 修回:2016-07-24)
Update of autosomal dominant hereditary hypotrichosis
HUANGHequn,TANGHuayang,SUNLiangdan,CHENMengyun,XUMinggui,XUYihui,XUJingkai,ZHANGXuejun.
InstituteofDermatology,AnhuiMedicalUniversity,Hefei230000,China
ZHANGXuejun,E-mail:ayzxj@vip.sina.com
Hereditary hypotrichosis is a single gene genetic disease and the manifestation is partial or total hair loss permanently. According to the hereditary model, hereditary hypotrichosis includes the autosomal dominant, autosomal recessive, X-linked dominant and X-linked recessive hereditary hypotrichosis. This article focuses on the update of autosomal dominant hereditary hair less, including various subtypes, hypotrichosis simplex of scalp, hereditary hypotrichosis simplex, marie Unna hereditary hypotrichosis, autosomal dominant woolly hair and loose anagen hair syndrome.
hypotrichosis; mutation; molecular genetics
国家高层次人才特殊支持计划项目(编号:2013-33)
安徽医科大学皮肤病研究所,合肥,230000
张学军,E-mail:ayzxj@vip.sina.com
