枇杷内生木霉P3.9菌株液体发酵条件优化筛选
2017-08-22洪亮胡金碧鲁海菊张海燕李丽莎
洪亮+胡金碧+鲁海菊+张海燕+李丽莎

摘要:为弄清枇杷内生木霉P3.9菌株最佳发酵条件,以分离自枇杷主干韧皮部的内生木霉P3.9菌株为供试菌株,以菌丝生长量為指标,通过单因素和正交试验,筛选最佳组合液体发酵培养液,碳源、氮源、pH及其接种量。结果表明,最佳培养液为马铃薯浸汁,碳源为D-果糖,氮源为磷酸二氢铵,pH 7.0,接种量为1.5%;正交试验表明其菌丝生长的最佳组合培养条件为马铃薯浸汁,在其中添加2%D-果糖、0.05%磷酸二氢铵、pH 6.0、接种量为1.5%。按优化后的培养条件培养,最高菌丝干重可达5.1 mg/mL。
关键词:内生菌;木霉;液体发酵;菌丝干重
中图分类号:S667.3 文献标识码:A 文章编号:0439-8114(2017)14-2670-04
DOI:10.14088/j.cnki.issn0439-8114.2017.14.017
Abstract: In order to make clear optimal conditions of liquid fermentation for Trichoderma strain P3.9,Taking Trichoderma strain P3.9 isolated from trunk phloem of loquat as material,optimal substrates and its concentration of medium,including carbon source,nitrogen source,pH and inoculation count were studied according to the mycelial production by simple factor and orthogonal experiments,in order to screen out the best liquid fermentation for P3.9 strain. The results showed that the proper medium was potato juice; Carbon source was D-fructose; Nitrogen source was ammonium phosphate monobasic; pH was 7.0;Inoculation count was 1.5%. The orthogonal experiment indicated that optimal medium of the highest yields of mycelia consisted potato juice,2% D-fructose. 0.05% was ammonium phosphate monobasic. pH was 6.0. Inoculation count was 1.5%. By the optimal medium and culture conditions,the maximum mycelial yield was 5.1 mg/mL.
Key words: endophyte; Trichoderma; liquid fermentation; mycelial dry weight
植物内生菌是指生活在健康植物组织和器官内部的真菌或细菌,可通过竞争或其他作用来抑制或杀死各种致病菌[1]。在印楝[2]、银杏[3]、曼陀罗[4]、万寿菊[5]等药用植物中均发现内生真菌。枇杷(Eriobotrya japonica)为蔷薇科常绿乔木,其花、果、叶、根和树皮均可入药,具有抗炎和止咳的作用[6]。鲁海菊等[7,8]在枇杷中也发现若干株内生真菌。枇杷果实果肉柔软多汁,酸甜适度,营养丰富。已成为浙江、福建、台湾、四川、云南等省市主要果树之一。随着大面积连片种植枇杷树苗,苗期和成株期枇杷病害逐年增加。近年来,在台湾[9]、福建[10]及云南[11],枇杷根腐病严重阻碍了枇杷产业的可持续发展,而化学防治难以有效控制此土传病害。
木霉是重要的生防因子之一。内生木霉与其他腐生木霉相比,受到宿主组织的良好保护,更易于发挥生防作用。鲁海菊等[12]从枇杷主干韧皮部中,发现1株能抑制枇杷根腐病菌的内生木霉P3.9,经显微形态观察及ITS测序,鉴定为深绿木霉(Trichoderma atroviride),此菌株同时能抑制枇杷内生真菌[13]及其根际土壤真菌[14],抗菌谱广[15],能成功定殖于枇杷植株及其根际土壤。因此,枇杷内生木霉P3.9菌株有望作为生防菌株来开发应用。其固体发酵条件[16]已明确,鉴于固体发酵产品有效成分以木霉孢子为主,不耐储藏,加之木霉P3.9菌株对枇杷有促生作用,液体发酵产品比固体发酵产品更容易被枇杷根部吸收利用。因此,本试验以更耐储藏的木霉菌丝产量为指标,采用单因素和正交试验方法[17],筛选P3.9菌株液体发酵最佳组合条件,为研制和开发生防木霉液体菌剂提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 枇杷内生木霉P3.9菌株,是从云南省蒙自市枇杷种植基地采集枇杷根茎韧皮部,采用常规组织分离法进行分离纯化[18,19]获得,置于斜面培养基低温(4 ℃)保存。现保存于云南省红河学院植物病理教学实验室。
1.1.2 液体发酵培养液 PD(马铃薯葡萄糖培养液):20%马铃薯浸汁,2%葡萄糖,去离子水1 000 mL;PS(马铃薯蔗糖培养液):20%马铃薯浸汁,2%蔗糖,去离子水1 000 mL;CD(胡萝卜葡萄糖培养液):20%胡萝卜浸汁,2%葡萄糖,去离子水1 000 mL;BD(香蕉葡萄糖培养液):20%香蕉浸汁,2%葡萄糖,去离子水1 000 mL;培养液A:葡萄糖10.0 g,蛋白胨5.0 g,K2HPO4 1.00 g,MgSO4·7H2O 0.50 g,去离子水1 000 mL;CM:蔗糖30.00 g,NaNO3 2.00 g,K2HPO4 1.00 g,KCl 0.50 g,MgSO4·7H2O 0.50 g,去离子水1 000 mL。
1.1.3 药品与试剂 碳源包括麦芽糖、蔗糖、葡萄糖、D-果糖、α-乳糖、可溶性淀粉、D-甘露醇,氮源包括硝酸钠、硝酸铵、硫酸銨、尿素、磷酸二氢铵、磷酸二氢钾、甘氨酸、酵母膏、牛肉膏、蛋白胨,酸盐、氢氧化钠。上述材料均购自农贸市场及试剂公司,试剂均为分析纯。
1.2 方法
1.2.1 测定不同液体发酵培养液对枇杷内生木霉P3.9菌株菌丝产量的影响 将P3.9木霉菌株在PDA平板培养基中28 ℃恒温扩大培养3 d,用去离子水冲洗孢子,制成孢子液(1.5×106个/mL)备用[18],分别在500 mL锥形瓶中加入100 mL上述6种不同的液体发酵培养液(121 ℃高压灭菌25 min),同时接种1 mL上述准备好的孢子悬液,于28 ℃、光暗交替、180 r/min摇床培养7 d,然后真空抽滤菌丝体,60 ℃烘箱烘干至恒重,进行称量。每个处理设5个重复。
1.2.2 碳源和氮源对枇杷内生木霉P3.9菌株菌丝产量的影响 以PD为基础培养基,分别用相等质量分数的碳(麦芽糖、蔗糖、葡萄糖、D-果糖、α-乳糖、可溶性淀粉、D-甘露醇)和氮(硝酸钠、硝酸铵、硫酸铵、尿素、磷酸二氢铵、磷酸二氢钾、甘氨酸、酵母膏、牛肉膏、蛋白胨)替换蔗糖和硝酸钠。接种、培养和测量方法同“1.2.1”。
1.2.3 pH对枇杷内生木霉P3.9菌株菌丝产量的影响 以PD为基础培养基,用0.1%盐酸及0.1%氢氧化钠将pH分别调至3、4、5、6、7、8、9和10。接种、培养和测量方法同“1.2.1”。
1.2.5 不同接种量对枇杷内生木霉P3.9菌株菌丝产量的影响 以PD为基础培养基,分别接种0.5、1.0、1.5、2.0、2.5、3.0 mL P3.9木霉孢子液,接种、培养和测量方法同“1.2.1”。
1.2.7 正交试验 在单因素试验的基础上,做4因素3水平L9(34)的正交试验(表1),灭菌、孢子液制备、接种、培养和测量方法同“1.2.1”。
1.2.8 数据统计 所有试验数据均采用SPSS 19.0统计软件Duncans多重比较法进行统计分析,计算处理间的差异显著性。
2 结果与分析
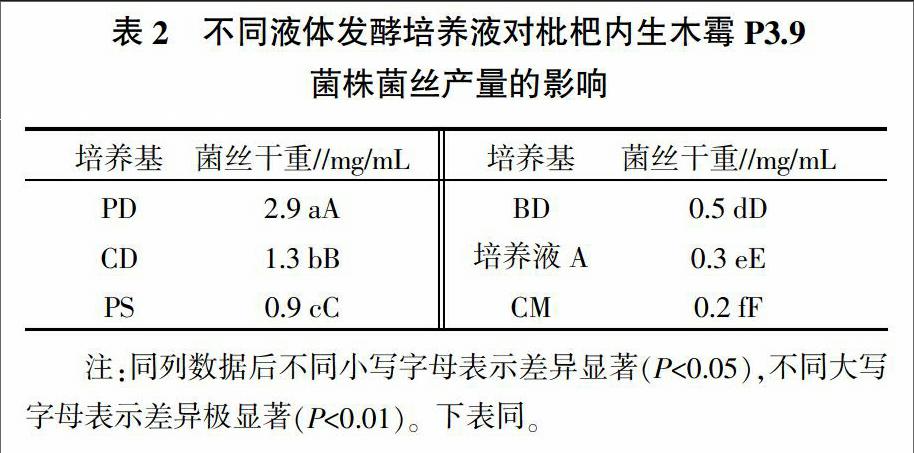
2.1 不同液体发酵培养液对枇杷内生木霉P3.9菌株菌丝产量的影响
由表2可知,P3.9菌株在不同培养液中均能生长,但其菌丝产量差异极显著。其中,马铃薯葡萄糖培养液中菌丝干重最大,表明马铃薯葡萄糖培养液最适合其菌丝生长。其余培养液菌丝干重表现为CD>PS>BD>培养液A>CM。
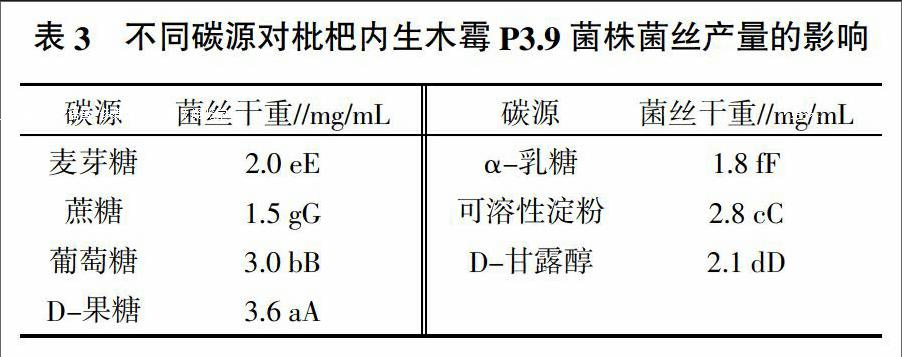
2.2 不同碳源对枇杷内生木霉P3.9菌株菌丝产量的影响
由表3可知,P3.9菌株在不同碳源培养液中均能生长,但其菌丝产量差异极显著。其中,D-果糖培养液中菌丝干重最大,说明D-果糖最适合其菌丝生长。其余碳源中菌丝干重表现为葡萄糖>可溶性淀粉>D-甘露醇>麦芽糖>α-乳糖>蔗糖。
2.3 不同氮源对枇杷内生木霉P3.9菌株菌丝产量的影响
由表4可知,P3.9菌株在不同氮源培养液中均能生长,其中,磷酸二氢铵中菌丝产量与其他氮源差异极显著,菌丝干重最大,表明磷酸二氢铵最适合其菌丝生长。硫酸铵和酵母膏中菌丝产量差异不显著,硝酸钠、硝酸铵、磷酸二氢钾和甘氨酸中菌丝产量差异不显著,牛肉膏、蛋白胨和尿素之间及其与其他氮源差异极显著。其中,尿素中菌丝干重最小,说明尿素最不适合其菌丝生长。
2.4 不同pH对枇杷内生木霉P3.9菌株菌丝产量的影响
由表5可知,P3.9菌株在不同pH中均能生长,但其菌丝产量差异极显著。其中,pH 7时菌丝干重最大,其余菌丝干重表现为pH 6>pH 5>pH 4>pH 3>pH 8>pH 9>pH 10。表明pH 7最适合其菌丝生长,其次是pH 6和pH 5。
2.5 不同接种量对枇杷内生木霉P3.9菌株菌丝产量的影响
由表6可知,P3.9菌株在接种量为1.0和1.5 mL、2.5和3.0 mL时,两两之间菌丝产量差异不显著,接种量为0.5 mL和2.0 mL与其余接种量中菌丝产量差异极显著。菌丝干重表现为1.0 mL=1.5 mL>0.5 mL >2.0 mL>2.5 mL=3.0 mL。表明接种量为1.0 mL(1%)或1.5 mL(1.5%)最适合其菌丝生长,其次是接种量为0.5 mL(0.5%)。
2.6 正交试验结果
由表7可知,P3.9菌株在9种配方中均能生长,其中配方4菌丝产量与其他配方差异极显著,菌丝干重最大,表明配方4最适合其菌丝液体发酵,即最佳组合为A2B1C2D3,即2%D-果糖,0.05%磷酸二氢铵,pH 6,接种量1.5%。4个因素中D-果糖和接种量对其菌丝产量影响最大。
3 小结与讨论
枇杷内生木霉P3.9菌株在液体培养条件下生长良好,其菌丝体生物产量与培养条件密切相关,尤其受碳源及接种量的影响最为显著。其液体发酵最佳组合条件为马铃薯浸汁、添加2%D-果糖、0.05%磷酸二氢铵、pH 6、1.5%接种量,最高菌丝干重可达5.1 mg/mL。P3.9菌株固体发酵[16]以木霉孢子量为计测指标,液体发酵以木霉菌丝干重为指标。菌丝比孢子耐储藏,液体发酵产品比固体发酵产品更容易被枇杷根部吸收利用。固、液体发酵最佳碳、氮源基本一致,接种量不一致,液体发酵接种量少于固体发酵接种量(5%)。P3.9菌株固体发酵最佳温度[16]为28 ℃,因此本试验培养温度同样采用28 ℃。参照钩状木霉(T. hamatum)Th12菌株[20]最佳摇床转速,本试验摇床转速设定为180 r/min。Th12菌株[20]菌丝液体发酵最佳碳源为葡萄糖,氮源为蛋白胨,与此菌株不一致,pH、接种量与P3.9菌株一致。木霉厚垣孢子最耐储藏,有研究表明哈茨木霉[21]液体发酵产厚垣孢子的最佳基质为玉米粉,氮源为酵母膏,与此菌株不一致,最佳温度与P3.9菌株一致(28 ℃)。长枝木霉[22]液体发酵产厚垣孢子的最佳温度为28 ℃,pH为5。表明不同木霉菌株适合的液体发酵条件存在差异。该研究对木霉P3.9菌株液体发酵主要影响因素碳源、氮源、pH及接种量进行了优化,为深入研究其产孢、孢子类型及发酵代谢产物提供参考依据。
木霉是防治作物土传病害的重要拮抗真菌,研究发现植物体内存在内生木霉真菌,在可可[23]、茶树[24]、芦竹[25]、芦荟[26]、南方红豆杉[27]等植物中成功分离到内生木霉真菌。其中,芦竹和南方红豆杉中分离的内生木霉分别对烟草赤星病和水稻纹枯病有很好的防治效果。研究还发现从其他地方分离的木霉菌株能在可可茎上定殖,与其形成共生关系,最终成为宿主的内生真菌[28]。表明不管是土著的内生木霉还是从外界引入的木霉,都能与宿主形成共生关系,最终成为宿主的内生真菌,对宿主有促生、抗病等作用[29]。近年来,用宿主内生木霉防治宿主植物病害的研究已成为绿色防控研究热点。如茶树内生木霉防治茶叶斑病[24]、黄瓜内生木霉防治黄瓜枯萎病[30]、香蕉内生木霉防治香蕉枯萎病[31]等。鲁海菊等[13]用枇杷内生木霉防治枇杷根腐病,发现枇杷内生木霉P3.9菌株能成功定殖于枇杷植株及其根际土壤,对枇杷有防病促生作用。其作用机理及其菌剂使用技术还待进一步研究。
枇杷内生木霉P3.9菌株液体发酵最佳组合条件为马铃薯浸汁,添加2%D-果糖、0.05%磷酸二氢铵,pH 6,1.5%接种量,光暗交替28 ℃、180 r/min摇床培养7 d。最高菌丝干重可达5.1 mg/mL。其菌剂有效成分以木霉菌丝为主,比其孢子耐储藏。厚垣孢子比菌丝更耐储藏,P3.9菌株液体发酵产厚垣孢子的最佳组合条件有待进一步研究。
参考文献:
[1] 马彩霞,姜东亮,魏希颖.内生菌与宿主植物关系及其育种技术的研究進展[J].药物生物技术,2010,17(4):353-356.
[2] 邵士成,吴少华,陈有为,等.云南元江印楝植物内生真菌的种类组成[J].生物多样性,2008,16(1):63-67.
[3] 易大为,张怡轩,何建勇,等.一株银杏内生真菌代谢产物的初步研究[J].微生物学杂志,2007,27(3):102-106.
[4] 郑 毅,伍 斌,陈有为.曼陀罗内生真菌代谢产物抗皮肤致病真菌活性成分研究[J].安徽农业科学,2011,39(3):1323-1324,1329.
[5] 鲁海菊,施玉梅,潘柳君,等.万寿菊内生真菌WZ2菌株形态鉴定及生物学特性[J].湖北农业科学,2015,54(11):2606-2609.
[6] 王立为,刘新民,余世春,等.枇杷叶抗炎和止咳作用研究[J].中草药,2004,35(2):174-176.
[7] 鲁海菊,董 梅,崔同敏,等.枇杷内生真菌多样性初步研究[J].北方园艺,2014(4):100-102.
[8] 鲁海菊,郝小燕,崔同敏,等.抗枇杷根腐病病菌的枇杷主干内生真菌生物学特性研究[J].北方园艺,2014(8):108-111.
[9] CHERN L L,ANN P J,YOUNG H R. Root and foot rot of loquat in Taiwan caused by Phytophthora[J].Plant Disease,1998,82(6):651-656.
[10] 庄文远,吴志珍,曾忠坚.枇杷根腐病的发生与防治技术[J].广西植保,2002,15(1):8-9.
[11] LU H J,WANG C M,ZHENG X L,et al. First report of loquat root rot disease caused by Pestalotiopsis microspora in China[J]. Plant Disease,2016,100(5):1008-1009.
[12] 鲁海菊,董 梅,崔同敏,等.从枇杷内生真菌中筛选抗枇杷根腐病菌的活性菌株[J].江苏农业科学,2014,42(1):95-97.
[13] 鲁海菊,张建春,沈云玫,等.枇杷内生真菌对P3.9生防木霉菌株的抑菌作用研究[J].湖北农业科学,2014,53(11):2547-2550.
[14] 沈云玫,张建春,李 河,等.枇杷根际土壤真菌对生防木霉菌株P3.9的影响[J].江苏农业科学,2014,42(4):106-108.
[15] 鲁海菊,张建春,杞敬香,等.枇杷内生木霉P3.9菌株抗菌谱研究[J].北方园艺,2014(24):103-107.
[16] 鲁海菊,王 波,潘柳君,等.深绿木霉P3.9生防菌株固体发酵条件优化筛选[J].北方园艺,2014(14):119-123.
[17] 王英姿,祁之秋,魏松红,等.绿色木霉菌固体发酵培养基优化组合正交筛选[J].植物保护,2007,33(2):61-63.
[18] 方中达.植病研究方法[M].第三版.北京:中国农业出版社,1998.
[19] 曾垄钢,鲁海菊,王 栋,等.云南省蒙自市辣椒黑斑病初步研究[J].北方园艺,2015(3):109-113.
[20] 王 晖,孙晓东,吕国忠.钩状木霉Th12菌株液体发酵条件的研究[J].安徽农业科学,2011,39(13):7568-7571.
[21] 粟 静,罗志威,吕 黎,等.哈茨木霉液体发酵产厚垣孢子条件的优化[J].山西农业科学,2014,42(2):169-173.
[22] 李 锋.木霉厚垣孢子的液体发酵及其可湿性粉剂研制[D].四川雅安:四川农业大学,2010.
[23] SAMUELS G J,SUAREZ C,SOLIS K,et al. Trichoderma theobromicola and T. paucisporum:Two new species isolated from cacao in South America[J].Mycological Research,2006,110(4):381-392.
[24] 武汉琴,苏经迁,谢明英,等.茶树内生木霉种的鉴定及其在植物体内的定殖[J].菌物学报,2009,28(3):342-348.
[25] 纪丽莲.芦竹内生真菌F0238对烟草赤星病的防治作用[J].江苏农业科学,2005,33(2):54-56.
[26] 王莉衡,柯 杨,强 毅,等.芦荟内生菌内生哈茨木霉LH-7对植物病原菌的抗性[J].应用生态学报,2014,25(4):1130-1136.
[27] 王国平,鲁书玲,郑必强,等.内生真菌紫杉木霉ZJUF0986菌株及其活性代谢产物防治水稻纹枯病的效果[J].中国生物防治,2009,25(1):30-34.
[28] BAILEY B A,STREM M D,WOOD D,et al. Trichoderma species form endophytic associations within Theobroma cacao trichomes[J]. Mycological Research,2009,113(12):1365-1376.
[29] NAGARAJU A,SUDISHA J,MURTHY M S,et al. Seed priming with Trichodema harzianum isolates enhances plant growth and induces resistance against Plasmopara halstedii,an incitant of sunflower downy mildew disease[J].Australasian Plant Pathology,2012,41(6):609-620.
[30] 贺字典,赵春明,谢新宇,等.黄瓜内生木霉菌对尖孢镰孢菌黄瓜专化型(Fusarium oxysporum f. sp. cucumerinum)的抑菌作用[J].河北科技师范学院学报,2015,29(1):1-5.
[31] 夏晓敏.香蕉内表生木霉的分布、种群结构及对香蕉枯萎病的生防作用研究[D].福建厦门:厦门大学,2009.
