化学氧化剂-微生物协同作用对除草剂氟乐灵降解过程的影响
2017-08-22陈家长胡庚东孟顺龙范立民裘丽萍
季 丽,宋 超,张 聪,陈家长,胡庚东,孟顺龙,范立民,裘丽萍,郑 尧,刘 颖,吴 伟②
(1.中国水产科学研究院淡水渔业研究中心/ 农业部水产品质量安全环境因子风险评估实验室(无锡),江苏 无锡 214081; 2.农业部水产品质量安全控制重点实验室,北京 100000;3.江苏省无锡市农业委员会,江苏 无锡 214000)
化学氧化剂-微生物协同作用对除草剂氟乐灵降解过程的影响
季 丽1,2,宋 超1,2①,张 聪1,2,陈家长1,2,胡庚东1,2,孟顺龙1,2,范立民1,2,裘丽萍1,2,郑 尧1,2,刘 颖3,吴 伟1,2②
(1.中国水产科学研究院淡水渔业研究中心/ 农业部水产品质量安全环境因子风险评估实验室(无锡),江苏 无锡 214081; 2.农业部水产品质量安全控制重点实验室,北京 100000;3.江苏省无锡市农业委员会,江苏 无锡 214000)
氟乐灵在水产养殖中常被用来清除池塘底部青苔,但是使用过后也会对鱼类产生毒性。因此,清除水体过量的氟乐灵对养殖后期鱼类生长极其重要。选取过碳酸钠和过硫酸氢钾为研究对象,在比较2种氧化剂降解效果的基础上,研究了化学氧化剂-微生物协同作用对除草剂氟乐灵降解过程的影响。结果显示,过碳酸钠比过硫酸氢钾更适宜作为化学氧化剂对养殖水体中氟乐灵进行降解。单独使用0.15 mg·L-1过碳酸钠和φ=0.01%比例、添加浓度为109CFU·mL-1的FJ-01菌液中微生物对氟乐灵5 d的降解率分别为44.79%和66.78%,而两者结合处理时5 d的降解率高达75.87%,显著优于单一的微生物降解或化学氧化。该研究表明化学氧化剂和微生物协同降解是水产养殖中氟乐灵污染水体修复的良好途径和方法。
氟乐灵;降解;化学氧化剂;微生物;水产养殖
氟乐灵是一种应用十分广泛的二硝基苯胺类的选择性芽前除草剂,其主要作用机理是通过影响杂草的激素生成和传递从而抑制细胞的分裂[1]。在水产养殖中,该药常被用来清除池塘底部青苔。有报道显示,以氟乐灵为主要成分的“护草青苔净”能迅速降低植物表面张力,从而使丝状藻、青苔等快速脱水萎缩死亡,能够高效地去除附着于池塘、网箱网具和虾、蟹、贝类、蚌和鱼类体表上的青苔。此外,由于氟乐灵为芽前除草剂,其对已萌发生长的水草杀灭作用有限,故在养蟹池塘中该药用于早春防治池塘青苔的过量生长,起到灭苔不伤草的功效。一般情况下750 mLφ=40%的氟乐灵可用于0.01 km2水面1 m水深的池塘防治青苔[2]。
氟乐灵对人畜低毒,但使用过后会对鱼类产生较高的毒性作用[1]。VESNA等[3]对鲤鱼进行了氟乐灵的急性毒性和亚急性毒性实验,结果表明,较高浓度的氟乐灵会严重损害鲤鱼的肾、鳃等部位。冯碧[4]以鲫鱼的巨噬细胞和淋巴细胞作为研究对象,探究了氟乐灵对其免疫细胞的影响,研究结果显示,氟乐灵对鱼类的巨噬细胞和淋巴细胞均呈现一定毒性,对鱼类的免疫系统有显著影响。因此,清除池塘水体过量的氟乐灵对养殖后期鱼类生长极其重要。
环境中农药残留的降解方法主要有化学氧化方法和微生物降解方法[5]。水产养殖中常用的氧化剂有过碳酸钠和过硫酸氢钾。这2类化学氧化剂因具有增氧、安全等特点而在水产养殖业上作为增氧剂和水处理剂大量使用,是目前水产养殖业上应用最广泛的化学氧化剂[6]。季丽等[7]前期研究重点考察了降解菌株FJ-01对氟乐灵的降解效果。但因微生物本身的生长以及对化学物质的代谢特点,其在前期的作用效果并不十分突出,降解速率较低。如适度利用化学氧化剂进行前期预处理,再进行微生物的后续降解,对养殖环境中氟乐灵的降解则会更加快速和高效。因此,选取过碳酸钠和过硫酸氢钾为研究对象,在比较2种氧化剂降解效果的基础上,研究了化学氧化剂-微生物协同作用对除草剂氟乐灵降解过程的影响。
1 材料与方法
1.1 仪器
实验器材为安捷伦7890A 气相色谱仪,高纯氮气,检测器为μ-ECD,色谱柱为HP-5MS石英毛细柱(30 m×0.25 mm,0.25 μm),SIGMA 2-16K低温冷冻离心机,QHZ-98B全温度光照振荡培养箱,PGX-150B智能光照培养箱,TOMY Autoclave SS-325型全自动高压灭菌器,SHR-080恒温生化培养箱,ZHJH-1214双面气流式无菌工作台,TH-100BY单槽超声波清洗机,全自动控温型养殖系统(内含60个100 cm×60 cm×50 cm玻璃水族箱)等。
1.2 试剂
φ=48%的氟乐灵乳油由镇江建苏农药化工有限公司提供;φ=98.4%的氟乐灵标准品由国家标准物质中心提供;过碳酸钠由天津市凯信化学工业有限公司提供;过硫酸氢钾由Aladdin试剂(上海)有限公司提供;葡萄糖为分析纯,二氯甲烷为色谱纯,牛肉膏、酵母膏、蛋白胨、琼脂粉均为国药集团化学试剂公司产品;其他试剂均为分析纯,由国药集团化学试剂公司提供。
1.3 实验方法
在实验室各水族箱中放入200 L基础条件一致的养殖水(来自周边养殖池塘,过滤后灭菌使用。不投放养殖生物,不充氧),水温控制在(30±1) ℃,水质pH值为7.0,t(光)∶t(暗)为12 h∶12 h,光照强度为2 500 lx。根据养殖生产中的实际使用浓度及考虑多次使用后浓度的叠加,加入48%的氟乐灵乳油并混合均匀,使水体中氟乐灵的最终浓度分别接近0.05 mg·L-1,形成含氟乐灵的模拟养殖水体。
2种化学氧化剂在降解氟乐灵时的对比实验:选择水产养殖上应用最广泛的氧化剂过碳酸钠和过硫酸氢钾作为化学降解剂,同时参考了其在养殖生产上的实际使用浓度,设置5个不同的实验组,即对照组(CK)、0.15 mg·L-1过碳酸钠实验组(L+N)、0.30 mg·L-1过碳酸钠实验组(H+N)、0.15 mg·L-1过硫酸氢钾实验组(L+K)、0.30 mg·L-1过硫酸氢钾实验组(H+K),每个组设3个平行。因过碳酸钠和过硫酸氢钾遇水会产生气体,故实验时先用天平准确称取氧化剂,然后直接投入养殖水中,并搅拌均匀。分别在实验开始后每隔0.5 h测定养殖水体中氟乐灵含量,持续5 h,以了解化学氧化剂对氟乐灵的降解效果。
化学氧化剂-微生物协同作用对氟乐灵的降解实验:选择对比实验中降解效果最佳的1种氧化剂和作用浓度,对养殖水体中氟乐灵进行化学氧化,5 h后再加入一定浓度的FJ-01菌液,对氟乐灵进行微生物降解,实验持续时间为5 d。之所以选择化学氧化剂作用5 h后再加入微生物,是考虑到过碳酸钠或过硫酸氢钾为氧化剂,对微生物有一定的灭活和杀生作用,不可同时加入实验水体。而通过预实验发现该2种氧化剂加入水体3 h后对微生物几乎没有影响。
降解菌株FJ-01的筛选和培养方法见前期研究[7]。降解菌液是用FJ-01菌株在肉汤培养基中培养至菌浓度为109CFU·mL-1时备用。使用时稀释至0.01%。实验期间,每隔5 h对实验水体进行搅拌,保证各种反应和采样的准确性。
1.4 仪器分析
养殖水体中氟乐灵的测定采用气相色谱法,具体条件为:色谱柱HP-5MS石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:70 ℃保持1 min,以30 ℃·min-1升至185 ℃,保持2.5 min,以25 ℃·min-1升至280 ℃,保持5 min。载气:高纯氮气,流速为1.2 mL·min-1;进样量1 μL,不分流进样。进样口温度:230 ℃。检测器:μ-ECD,检测器温度300 ℃。该条件下氟乐灵保留时间为8.73 min。
1.5 数据统计和分析
实验数据使用SPSS 19.0软件进行差异显著性分析。氟乐灵降解率(%)=(Ct-C0)×100/C0。式中,Ct为养殖水体中氟乐灵的最终浓度,mg·L-1;C0为养殖水体中氟乐灵的初始浓度,mg·L-1。
2 结果与分析
2.1 2种化学氧化剂在降解氟乐灵时的对比实验
以过碳酸钠和过硫酸氢钾为化学氧化剂,对添加0.05 mg·L-1氟乐灵的养殖水体的化学降解效果见图1。
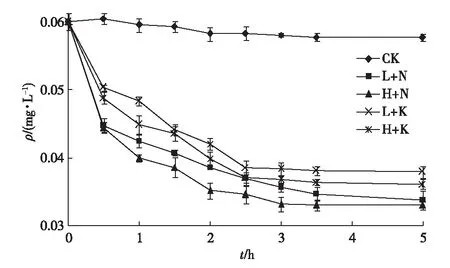
CK为对照组,L+N和H+N分别为0.15 和0.30 mg·L-1过碳酸钠实验组, L+K和H+K分别为0.15 和0.30 mg·L-1过硫酸氢钾实验组。
经5 h后对照组去除率为4.13%,这主要是受挥发和光解的影响,而实验组氟乐灵去除率为37.19%~45.45%,与对照组差异极显著(P<0.01),表明过碳酸钠和过硫酸氢钾对氟乐灵具有化学降解作用。0.15 mg·L-1过碳酸钠实验组1 h降解率为29.5%,5 h降解率为44.13%;0.30 mg·L-1过碳酸钠实验组1 h降解率为33.72%,5 h降解率为45.45%。高浓度与低浓度过碳酸钠在5 h时对氟乐灵的降解效果已无显著差异(P>0.05),但在实验初始1 h内存在显著差异(P<0.05)。过碳酸钠低、高浓度组1 h降解率分别为5 h总降解率的67.05%和74.19%,表明过碳酸钠的作用主要在实验接触后1 h内完成。
0.15 mg·L-1过硫酸氢钾实验组1 h降解率为16.36%,5 h的降解率为37.19%;0.30 mg·L-1过硫酸氢钾实验组1 h降解率为18.84%,5 h降解率为40.17%。高、低浓度过硫酸氢钾实验组在5 h的实验过程中效果差异不显著(P>0.05)。过硫酸氢钾低、高浓度组1 h降解率分别占5 h总降解率的43.99%和46.90%。
将同等浓度的过碳酸钠实验组与过硫酸氢钾实验组进行比较,无论是1 h还是5 h的降解效果,过碳酸钠实验组均显著高于过硫酸氢钾组(P<0.05)。综合以上实验结果,选择0.15 mg·L-1过碳酸钠作为化学氧化剂进行下一步实验。
2.2 化学氧化剂和微生物单独作用对氟乐灵的降解
图2显示,实验5 d内,不添加任何降解剂的空白对照组氟乐灵质量浓度由0.060 5(实测值)下降为0.054 6 mg·L-1,降低9.75%,表明因挥发和光降解等因素造成氟乐灵降低率不大于10%。
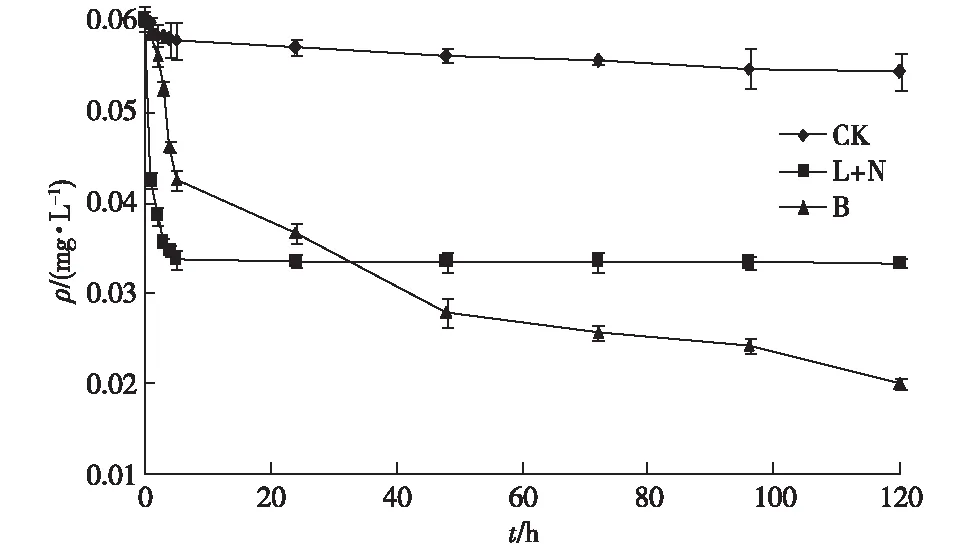
CK为对照组,L+N为0.15 mg·L-1过碳酸钠实验组, B为109 CFU·mL-1 FJ-01菌液实验组。
采用0.15 mg·L-1过碳酸钠的化学降解组5 d内氟乐灵下降至0.033 4 mg·L-1,降解率为44.79%,但实验5 h的降解率即为44.13%,5 h和5 d的降解率无显著差异(P>0.05)。表明化学氧化剂的降解作用主要在实验后5 h内。
采用0.01%比例、添加浓度为109CFU·mL-1的FJ-01菌液的微生物降解组5 d内氟乐灵下降至0.020 1 mg·L-1,降解率为66.78%,降解率远高于化学氧化组,呈极显著差异(P<0.01),但实验5 h的降解率仅为29.42%,1 d时为39.17%,表明微生物降解虽较化学氧化彻底,但前期(1 d内)的速率远低于化学氧化。
2.3 化学氧化剂和微生物协同作用对氟乐灵的降解
在模拟的养殖水体中,5 h前添加0.15 mg·L-1过碳酸钠,之后以0.01%比例添加浓度为109CFU·mL-1的FJ-01菌液,研究两者协同作用对氟乐灵的降解效果(图3)。实验5 h时,降解率为45.12%,5 d时氟乐灵浓度下降至0.014 6 mg·L-1,降解率高达75.87%。5 d时降解效果显著优于单一的微生物降解组或化学氧化组(P<0.01)(图4)。

CK为对照组,L+N+B为0.15 mg·L-1过碳酸钠(5 h前添加)和109 CFU·mL-1 FJ-01菌液实验组(5 h后添加)。

L+N为0.15 mg·L-1过碳酸钠实验组,B为109 CFU·mL-1 FJ-01菌液实验组,L+N+B为0.15 mg·L-1过碳酸钠和109 CFU·mL-1 FJ-01菌液实验组。直方柱上方英文小写字母不同表示各实验组间氟乐灵浓度差异显著(P<0.05)。
3 讨论
3.1 氧化剂的降解机制探讨
通过模拟实验,发现化学氧化剂对氟乐灵的降解作用主要发生在与水体接触后5 h之内,0.15 mg·L-1过碳酸钠更加适宜处理养殖水体中氟乐灵污染和残留。过碳酸钠溶于水中可分解出活性氧,具有很强的氧化能力,其用途十分广泛,可用作果蔬保鲜剂等[8]。过硫酸氢钾是过硫酸氢钾复合盐的活性物质,具有极强的非氯氧化能力,并且在使用和处理过程中符合安全和环保要求,所以现在已经被广泛地应用于消费领域和工业生产中,可作氧化剂和消毒剂等。此2类化学氧化剂因具有增氧、安全等特点而在水产养殖业上作为增氧剂和水处理剂大量使用,是目前水产养殖业上应用最广泛的化学氧化剂[9]。
作为氧化剂,考察其氧化能力主要看其进入水体后的作用产物。过碳酸钠进入水体后形成过氧化氢和碳酸钠,以过氧化氢来体现其氧化性[10];而过硫酸氢钾进入水体后形成过氧化氢和硫酸氢钾,同样以过氧化氢来体现其氧化性。过氧化氢在中性介质中的氧化还原电位为1.10 V,具有较强的氧化性。而在水体中生成等量的过氧化氢,过碳酸钠使用量要低于过硫酸氢钾,因此相同使用浓度下,过碳酸钠对氟乐灵的作用效果显著高于过硫酸氢钾(P<0.05)[11]。由于过碳酸钠本身含有过氧化氢,其进入水体后可立即释放新生氧,进行氧化反应,而过硫酸氢钾则需先与水反应生成过氧化氢,然后再行氧化反应,故过碳酸钠在1 h内对氟乐灵的降解率显著高于过硫酸氢钾(P<0.05),但过硫酸氢钾的持续氧化能力好于过碳酸钠[12]。因过硫酸氢钾的市场售价高达20元·kg-1,而过碳酸钠仅为4.0元·kg-1,综合该实验结果及对微生物的安全性,选择0.15 mg·L-1过碳酸钠作为化学氧化剂对养殖水体中氟乐灵进行化学氧化预处理。
3.2 微生物的降解机制探讨
通过培养降解细菌的方法来降解环境介质中氟乐灵已有报道。BELLINASO等[13]在被氟乐灵污染的土壤中分离得到利用氟乐灵作为碳源的8株细菌。通过生化鉴定和分子生物学鉴定发现,这些菌株属于Pseudomonas、Bacillus和Brevundimonas3个属。在该研究中,FJ-01菌株也是利用无碳培养基在被污染的养殖水体中分离出来的,通过鉴定,该菌株属于Leucobacter属[7]。可见,降解氟乐灵的菌株对生长环境具有选择性。将微生物应用于养殖水体氟乐灵的修复时需要考虑实际的养殖情况。然而,关于微生物降解氟乐灵的机制应该具有共性,都是通过烷基化方式来进行第1步降解[14]。
4 结论
通过模拟实验,发现采用0.15 mg·L-1过碳酸钠预氧化并以0.01%比例添加浓度为109CFU·mL-1的FJ-01菌液的微生物进行处理,5 d降解率高达75.87%,降解效果显著优于单一的微生物降解或化学氧化。该研究表明化学氧化剂和微生物协同降解是水产养殖中氟乐灵污染水体修复的良好途径和方法。
[1] 朱文达,陈彩娟.48%氟乐灵乳油土壤处理防除禾本科杂草的效果[J].湖北农业科学,2003(3):57-58.[ZHU Wen-da,CHEN Cai-juan.Triforalin 48 EC Controls the Gramineous Weeds in the Direct Seeding Cotton Field[J].Hubei Agricultural Sciences,2003(3):57-58.]
[2] 季丽,张骞月,晏涛,等.氟乐灵在养殖水体环境中消解动态的模拟研究[J].农业环境科学学报.2015,34(1):182-189.[JI Li,ZHANG Qian-yue,YAN Tao,etal.Simulation Study on Dynamics of Trifluralin Degradation in Aquaculture Water[J].Journal of Agro-Environment Science,2015,34(1):182-189.]
[3] VESNA P H,VESELA K.Effects of Trifluralin:Human Health and Ecological Risk Assessment[R].New York,USA:Syracuse Environmental Research Association,2011.
[4] 冯碧.三种环境激素对鱼类免疫细胞活性与功能的影响[D].杭州:浙江大学,2003.[FENG Bi.Relationship and Immnocytotoxic Effects of Three Environmental Hormones on Lymphocytes and Macrophages in Crucian Carp (Carassiusauratus) in Vitro[D].Hangzhou:Zhejiang University,2003.]
[5] AUDUS L J.The Biological Detoxication of Hormone Herbicides in Soil[J].Plant and Soil,1951,3(2):170-192.
[6] 吴伟,徐跑,蒋高中.渔业环境保护[M].北京:中国农业出版社,2013:45-58.[WU Wei,XU Pao,JIANG Gao-zhong.Fishery Envrionmental Protection[M].Beijing:China Agricultural Press,2013:45-58.]
[7] 季丽,吴伟.氟乐灵降解菌株的分离鉴定及降解特性研究[J].江苏农业科学,2016,44(3):390-393,531.[JI Li,WU Wei.Isolation,Identification and Characterization of Trifluralin-Degradation Bacteria[J].Jiangsu Agricultural Sciences,2016,44(3):390-393,531.]
[8] USEPA.Field Applications of in Situ Remediation Technologies:Chemical Oxidation[R].Washington DC,USA:Solid waste and Emergency Response,1998.
[9] 赵丹,阎秀兰,廖晓勇,等.不同化学氧化剂对焦化污染场地多环芳烃的修复效果[J].环境科学,2011,32(3):849-856.[ZHAO Dan,YAN Xiu-lan,LIAO Xiao-yong,etal.Chemical Oxidants for Remediation of BTEX-Contaminated Soils at a Coking Sites[J].Environmental Science,2011,32(3):849-856.]
[10]GOMEZ M V,CABALLERO R,VAZQUEZ E,etal.Green and Chemoselective Oxidation of Sulfides With Perborate and Sodium Percarbonate:Nucleophilic and Electrophilic Character of the Oxidation System[J].Cheminform,2007,38(34):331-336.
[11]FELL R T,MEUNIER B.Oxidation of Thioureas With Potassium Monopersulfate:An Efficient Method for Their Environmentally Safe Degradation[J].Comptes Rendus De Lacademie des Sciences,2000,3(4):285-288.
[12]张丹.纳米材料表面分子印迹技术研究及其对农药的特异性识别[D].上海:华东师范大学,2012.[ZHANG Dan.Study on Surface Molecularly Imprinting Technology Based on Nanomaterials and Their Applications in Specific Recognition of Pesticide[D].Shanghai:East China Normal University,2012.]
[13]BELLINASO M D L,GREER C W,PERALBA M D C,etal.Biodegradation of the Herbicide Trifluralin by Bacteria Isolated From Soil[J].FEMS Microbiology Ecology,2003,43(2):191-194.
[14]DIMOU A D,SAKKAS V A,ALBANIS T A.Trifluralin Photolysis in Natural Waters and Under the Presence of Isolated Organic Matter and Nitrate Ions:Kinetics and Photoproduct Analysis[J].Journal of Photochemistry and Photobiology A:Chemistry,2004,163(3):473-480.
(责任编辑: 陈 昕)
Synergistic Effects of Chemical Oxidant and Bacteria on Degradation Process of Trifluralin.
JILi1,2,SONGChao1,2,ZHANGCong1,2,CHENJia-zhang1,2,HUGeng-dong1,2,MENGShun-long1,2,FANLi-min1,2,QIULi-ping1,2,ZHENGYao1,2,LIUYing3,WUWei1,2
(1.Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences/ Laboratory of Quality & Safety Risk Assessment for Aquatic Products on Environmental Factors (Wuxi), Ministry of Agriculture, Wuxi 214081, China;2.Key Laboratory of Control of Quality and Safety for Aquatic Products, Ministry of Agriculture, Beijing 100000, China;3.Wuxi Aquaculture Technique Popularization Station, Wuxi 214000, China)
Trifluralin is often used in aquiculture to clear off green moss in the bottom of a fish pond, but it is found to have some toxic effect on fish. It is, therefore, essential to remove excessive trifluralin from the pond for the growth of the fish at their late stages. In this paper two chemicals, sodium percarbonate and potassium persulfate, were tested as oxidant. Based on comparison between the two in trifluralin degradation effect, further studies were done on synergistic effects of the chemicals and bacteria on degradation process of trifluralin. Results show that sodium percarbonate is more suitable than potassium persulfate for use as oxidant to oxidize trifluralin in fish ponds. The separate use of 0.15 mg·L-1sodium percarbonate and 0.01% 109CFU·mL-1FJ-01 bacteria degraded trifluralin by 44.79% and 66.78% within 5 days, respectively, while the two used together increased the degradation rate significantly up to 75.87%. The findings indicate that the use of chemical oxidant and bacteria together is an effective method of remedy trifluralin polluted pond water. The study may shed light on the issue of quality safety of aquatic product.
trifluralin; degradation; chemical oxidant; bacteria; aquaculture
2017-02-06
公益性行业(农业)科研专项(201503108);农业部财政项目(GJFP2016009)
X52
A
1673-4831(2017)08-0743-05
10.11934/j.issn.1673-4831.2017.08.010
季丽(1989—),女,江苏泰州人,硕士,主要研究方向为渔业生态环境与水产品质量安全。E-mail: 1040486245@qq.com
① 通信作者E-mail: songc@ffrc.cn
② 共同通信作者E-mail: wuw@ffrc.cn
