Bacillus subtilis ZH168多酚氧化酶特性研究
2017-08-22张丽香
张丽香
Bacillus subtilis ZH168多酚氧化酶特性研究
张丽香
(北京市经济管理学校,北京100142)
从Bacillus subtilis ZH168发酵液中提取多酚氧化酶,通过分光光度计法对其pH值、温度、底物、抑制剂及激活剂等特性进行研究。结果表明,邻苯二酚做底物时,pH值为7时活性最大,多巴做底物时最适pH值为8;该酶最适温度40℃,具有较好热稳定性;多酚氧化酶可催化不同酚类物质,催化活性不同;SDS,Triton X-100和尿素对酶均具有激活作用;Cys,NaHSO3,EDTA,VC,苯甲酸和Gly对酶有抑制作用;金属离子Cu2+可以显著提高酶活,Al3+和Mn2+显著抑制酶活。
黑色素;枯草芽孢杆菌;酪氨酸酶;多酚氧化酶;酶活性
0 引言
黑色素(Melanin)是一种在细菌、真菌、动植物中均有分布的天然色素,其应用前景广阔,可用于研发防晒霜、染发剂、太阳伞、抗紫外眼镜、生物杀虫剂的保护剂等。酪氨酸酶(Tyosinaes)是微生物体内产生的催化黑色素形成的最重要的多酚氧化酶(Polyphenol oxidase,PPO)之一,多酚氧化酶活性控制成为研究的热点问题[1]。已有报道枯草芽孢杆菌能产生催化黑色素形成的多酚氧化酶,且已经被纯化[2],该酶是一种具有催化活性的蛋白质,不同来源的酪氨酸酶其特性有较大差异[3],其酶活性受底物、温度、pH值等多种条件影响。试验对Bacillus subtilis ZH168所产胞外多酚氧化酶pH值、温度、底物、激活剂及抑制剂等进行较为系统研究。
1 材料和方法
1.1 材料
供试菌株:产黑色素菌株,B.subtilis ZH168[1]。
培养基:①种子培养基,5 g牛肉膏,10 g蛋白胨,10 g NaCl,pH值7,蒸馏水1 L。②产酶培养基,Fd培养基;LB培养基,酵母浸膏1.5 g、胰蛋白胨1.5 g、NaCl 5 g、蒸馏水1 L;肉汤培养基,5 g牛肉膏,10 g蛋白胨,10 g NaCl,pH值7,蒸馏水1 L培养基121℃蒸汽灭菌20 min,L-Tyr 115℃。
试剂和仪器:L-Tyr,L-dopa(Sigma),其他供试生化试剂,除特别说明外,使用的培养基材料和化学试剂分别为生化试剂和分析纯试剂,均购自北京化学试剂公司、北京欣经科试剂有限公司和北京蓝弋试剂有限公司。752型紫外/可见分光光度计,上海精密科学仪器厂产品;TU-1901型双光束紫外可见分光光度计,北京普析通用仪器有限公司产品。
1.2 试验方法
1.2.1 B.subtilis ZH168多酚氧化酶(PPO)的发酵及提取
液体种子培养:在250 mL三角瓶中装50 mL种子培养基,接种ZH168菌种,置于恒温摇床上,转速为140 r/min,于37℃培养8~12 h,至波长630 nm下OD值为0.800时接种入发酵培养基。
酶发酵:在50 mL/300 mL发酵培养基中,按4%接种量接种种子,控制培养温度37℃,转速140 r/min,发酵24 h后,以转速9 000 r/min离心10 min,除去大部分菌体,收集发酵液上清液。将收集到的粗蛋白液在冰浴中用硫酸铵进行沉淀,使硫酸铵饱和度为75%,待硫酸铵完全溶解后,将容器放至4℃冰箱中静置过夜。取出后离心,以10 000×g,4℃条件下离心20 min,收集沉淀,20 mmol/L磷酸缓冲液溶解后,装入8 000 Da透析袋内,透析除盐后进行冷冻干燥浓缩蛋白,即得粗酶。称取适量粗酶,溶于pH值为7的磷酸缓冲液,4℃冰箱保藏,为供试粗酶液。
1.2.2 B.subtilis ZH168 PPO活性测定[4-7]
多酚氧化酶(PPO)活性测定:①邻苯二酚底物:参照Zauberman方法,稍加改进。在3 mL的反应体系中,加1.8 mL 0.1 mol/L pH值7磷酸缓冲液,1 mL 0.1 mol/L邻苯二酚、0.2 mL酶液,从酶液加入后15 s开始记录每30 s反应体系于波长420 nm处的吸光度,连续测定5 min。以每1 h吸光度变化0.01为1个酶活力单位(U)。酶活性表示为U/(mL·min),重复3次。②多巴底物:反应体系同上,底物换成1 mmol/L多巴,于波长475 nm处测定吸光度变化,多巴储备液用去氧的二次蒸馏水配制,在低于20℃的室温下可存放约1周。③3,5-二甲氧基-4-羟基苯甲醛或丁香醛(Syringaldazine)作底物。
1.2.3 B.subtilis ZH168菌PPO的底物专一性
按照上述酶活性的体系更换不同底物溶液测定PPO的活性。用于测定的底物为多巴、邻苯二酚,焦棓酸,间苯二酚,间苯三酚,对苯二酚,愈创木酚和L-酪氨酸。以相对酶活性表示,最高活性为100,其他与最高活性相比来表示,重复3次。
1.2.4 pH值对B.subtilis ZH168菌PPO活性的影响
将醋酸缓冲液、磷酸缓冲液、甘氨酸-氢氧化钠缓冲液分别配置成1.0 mol/L pH值3~5,6~8,9~12的缓冲液。在体积为3 mL的测定体系中,加入1 mL 0.1 mol邻苯二酚,1.8 mL不同pH值的缓冲液,0.2 mL酶液。在分光光度计上于波长420 nm处测定吸光度。以相对酶活性表示,最高活性100为基准,其他与最高酶活性相对值来表示,重复3次。
1.2.5 温度对B.subtilis ZH168菌PPO活性及稳定性的影响[8-10]
温度对PPO活性的影响:将离心上清液各取1 mL到小离心管中,分别放在20,30,40,50,60,70,80,90,100℃下水浴加热10 min后,然后于10 000×g下离心10 min,收集上清液,按照上述酶活性的体系测定PPO活性。以相对酶活性表示,最高活性100为基准,其他与最高酶活性相对值来表示,重复3次。
PPO热稳定性:将装有1 mL酶液的小离心管分别放在50,60,70,80℃水浴加热5,10,15,20,25,30 min,迅速冰浴冷却,然后于10 000×g下离心10 min,收集上清液,按照酶活性的体系测定PPO的活性。以相对酶活性表示,最高活性100为基准,其他与最高酶活性相对值来表示,重复3次。
1.2.6 抑制剂及激活剂对B.subtilis ZH168菌PPO的影响
按照上述的酶活体系测定产PPO的活性,加入不同浓度的抑制剂和激活剂,相应减少缓冲液的加入量。试验所用的激活剂为SDS,曲拉通和尿素,抑制剂为cys,EDTA,抗坏血酸,苯甲酸和亚硫酸钠,以相对酶活表示,不加抑制剂和激活剂为100%,其他与之的相对值来表示,重复3次。
1.2.7 金属离子对B.subtilis ZH168菌PPO的影响
将一系列浓度为0.005,0.050,0.500 mmol/L的金属离子(Cu2+、Ca2+、Mg2+、Mn2+、Al3+)加入到PPO酶的反应液中,研究金属离子对酶活的影响。
1.3 结果与分析
1.3.1 B.subtilis ZH168菌催化黑色素酶反应的时间扫描光谱
从该菌发酵黑色素的优化Fd培养基中必需添加L-Tyr作底物才能形成黑色素,可见该菌能产生催化酪氨酸酶,而且发酵上清提取的粗酶也能催化多巴和邻苯二酚的氧化,但不能催化漆酶的底物取代酚,可见该菌能产生的一种胞外多酚氧化酶,即酪氨酸酶。
酶催化底物时间扫描光谱见图1。
如图1(a),酶催化邻苯二酚的时间扫描谱,图1(b),是该酶催化多巴氧化的时间扫描谱,2种底物的酶催化反应时间在前5 min,反应呈直线,所以测定酶活的反应时间为5 min。
1.3.2 B.subtilis ZH168菌PPO的底物专一性
PPO催化不同底能力见图2。
由图2可知,以多巴和邻苯二酚为底物时,该菌所产的PPO活性最强。底物专一性由高至低的趋势依次为多巴>邻苯二酚>焦棓酸>间苯二酚>间苯三酚>对苯二酚,愈创苯酚和酪氨酸为底物时,PPO的活力几乎为零。最适底物是多巴,邻苯二酚仅次之。分析试验中对于酪氨酸的催化活力为零,但在发酵产黑色素过程中,却是以酪氨酸为底物获得的黑色素,所以可以确定该菌所产的PPO肯定能催化酪氨酸,但对酪氨酸的催化存在一个较长的迟滞期,而此次试验测定的是相同的短时间酶对不同底物的催化能力,所以对酪氨酸催化能力未表现出来。

图1 酶催化底物时间扫描光谱

图2 PPO催化不同底能力
1.3.3 pH值对B.subtilis ZH168菌PPO活性的影响pH值对PPO活性的影响见图3。

图3 pH值对PPO活性的影响
分别以邻苯二酚和多巴为底物,在不同pH值的缓冲液中测定ZH168所产PPO的活性,2种底物的最适pH值,基本趋势相同,邻苯二酚做底物时,pH值为7时活性最大,在pH值6~8时有较高的活性,多巴做底物时的最适pH值为8,但偏碱的环境更利于对多巴的氧化催化形成黑色素。
1.3.4 温度对B.subtilis ZH168菌PPO活性的影响及其热稳定性
测定多巴为底物,菌株ZH161产生的PPO在不同的温度下的酶活力,可见此菌的PPO最适温度为50℃。
PPO最适温度见图4。
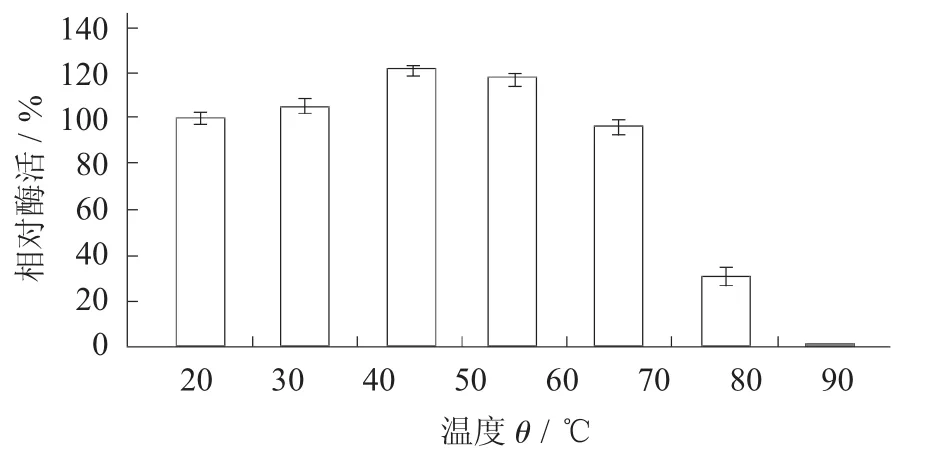
图4 PPO最适温度
以多巴为底物,在pH值8的条件下,将酶液分别于30~100℃,间隔10℃,保温酶液10 min后,立即进行冰浴冷却,然后于室温测定多酚氧化酶活性,算出相对活性。
温度对B.subtilis ZH168菌PPO活性的影响见图5。

图5 温度对B.subtilis ZH168菌PPO活性的影响
由图5可知,温度在30~60℃时酶活性保持较高水平,经10 min的40℃保温后,酶活性有所提高,可见该酶的最适温度在40℃左右,且该酶比较耐高温。60℃以后酶的活性随着温度的升高而降低。70~80℃时,酶活性急剧下降,到70℃时,酶活性仅为最大活性的31%,80℃时,酶活性仅为最大活性的5.5%,90℃及以上高温时,酶活性基本消失。
以多巴为底物,在pH值8的条件下,分别于40,50,60,70℃加热酶液5~30 min后,立即进行冰浴冷却,室温测定PPO活性。
PPO热稳定性见图6。
40~70℃范围内,PPO活性随时间的延长和温度的升高而降低。其中PPO在40~60℃时具有较好的热稳定性,40℃保温15 min,酶活基本不变,50,60℃下加热30 min其酶活性仍分别保持37%和22%;而温度再升高酶活性则迅速失活,如70℃加热10 min,其活性就迅速下降到了最高活性31%。

图6 PPO热稳定性
1.3.5 激活剂对B.subtilis ZH168菌PPO的影响
不同激活剂对产黑色素酶的激活作用见图7。

图7 不同激活剂对产黑色素酶的激活作用
由图7可知,SDS和Triton X-100作为该酶的激活剂,浓度与激活能力呈负相关,低浓度激活效果明显,1mmol/L的SDS可以将酶的活性提高100%,0.1%Triton X-100能提高55%的酶活力,与之相反,另一种该酶激活剂尿素对酶的激活作用与浓度呈正相关,浓度增大激活能力也升高。
1.3.6 抑制剂对B.subtilis ZH168菌PPO的影响
研究半胱氨酸、亚硫酸钠、EDTA、抗坏血酸、苯甲酸和甘氨酸6种抑制剂对PPO酶得抑制作用。
抑制剂对PPO活性影响见图8。

图8 抑制剂对PPO活性影响
其中半胱氨酸的抑制效果最为明显,25 mmol/L的半胱氨酸就基本上可以抑制PPO的83%的酶活性。此外,抗坏血酸和亚硫酸钠对此酶的活性抑制效果也比较明显,苯甲酸和EDTA的抑制效果相对较差,2 mmol/L的苯甲酸抑制率约35%的酶活性,而2 mmol/L的EDTA仅能抑制20%的酶活性,整体趋势看,在一定的浓度范围内,苯甲酸、EDTA、甘氨酸对PPO抑制能力随着浓度增大而提高。
1.3.7 金属离子对B.subtilis ZH168菌PPO的影响
以多巴为底物,测定不同金属离子对枯草芽孢杆菌ZH161所产PPO酶的影响。
金属离子对PPO酶活的影响见图9。
Cu2+可以明显提高酶的活力,0.5 mmol/L时PPO酶活力提高了127%,0.5 mmol/L的Mg2+对酶活稍有提高,低浓度的Ca2+也能微弱提高PPO酶的活力,但这2种离子对酶活的提高均不太明显。3个浓度的Al3+和Mn2+都显示了抑制PPO酶对多巴的催化作用,Mn2+随着浓度的升高,抑制作用有降低的趋势。
2 讨论及结论
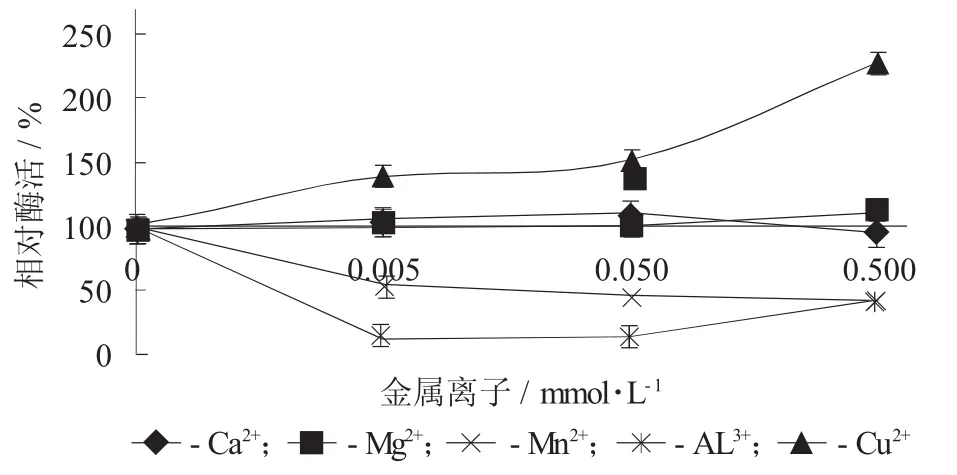
图9 金属离子对PPO酶活的影响
菌株B.subtilis ZH168能分泌胞外多酚氧化酶,能够催化酪氨酸氧化生成黑色素,具酪氨酸酶活性,没发现其具有漆酶活性,该菌的PPO具有较好热稳定性,最适反应温度为40℃。据报道苏云金芽抱杆菌酪氨酸酶热稳定性超强,在100℃,10 min仍有一半的酶活性,pH值会影响酶结构的稳定性,过酸、过碱都会影响酶蛋白的构象,甚至使酶变性而失活[3]。pH值不但会影响酶分子的解离状态,也会影响底物分子的解离状态,从而影响酶与底物的结合,影响酶活性,邻苯二酚为底物时该菌PPO的最适pH值为7,多巴作底物的最适值pH值为8,SDS,Triton X-100和尿素对酶均具有激活作用,半胱氨酸,亚硫酸钠、EDTA、抗坏血酸、苯甲酸和甘氨酸抑制剂对酶有抑制作用,其中半胱氨酸抑制作用最强。与其不同的是Triton X-100不是苏云金芽抱杆菌的酪氨酸酶的激活剂[3]。以潜伏态方式存在的PPO能被多种生化物质激活,如去污剂、脂肪酸、胰蛋白酶等,一些研究人员发现低浓度的SDS也可以激活酶的活性。这可能是因为酶在细胞内以酶原的形式存在,或者是因为去除了PPO结合的抑制子,或者是因为构象的改变。金属离子Cu2+可以明显提高酶的活力,以多巴为底物时,0.5 mmol时,PPO酶活力提高了127%,Mg2+、Ca2+有微弱的激活作用,3个浓度的Al3+和Mn2+都显示了抑制PPO酶对多巴的催化作用,且Mn2+随着浓度的升高,抑制作用有降低的趋势,可能高浓度的Mn2+能促进多巴的催化,据有关报道在pH值5.5的弱酸性缓冲溶液中,锰和铝离子对多巴氧化生成黑色素的过程具有协同催化作用。铝不是过渡金属,本身不能启动氧化作用。锰离子可启动多巴的氧化,生成中间体多巴色素。铝离子可催化多巴色素转化为5,6-二羟基吲哚的反应,它是黑色素形成过程中很重要的一步反应,其产物可进一步氧化并聚合生成黑色素。因此,锰和铝离子的协同作用促进了多巴氧化生成黑色素,增加了体系的氧化压力。Cu2+激活作用是由于PPO是含铜的酶,外加的铜离子对其有一定的激活作用。
[1]张丽香,刘强,孙忠伟,等.一株产黑色素芽孢杆菌的分离与鉴定[J].华南农业大学学报,2010,31(2):63-67.
[2]张丽香.Bacillus subtilis ZH168多酚氧化酶分离纯化研究[J].食品科技,2015,40(11):19-23.
[3]刘楠.苏云金芽抱杆菌酪氨酸酶纯化、性质研究及其mel基因的克隆和表达[D].武汉:武汉大学,2004.
[4]王斐,李俊霞,张丽香,等.产黑色素菌株发酵条件的研究[J].食品工业与技,2008(5):19-23.
[5]狄俊伟,毕树平.多巴氧化生成黑色素过程中锰和铝协同作用的紫外-可见光谱研究[J].光谱学与光谱分析,2005(11):83-85.
[6]丁大鹏,马文丽,郑文岭.酪氨酸酶抑制剂的研究进展[J].实用医学杂志,2005,21(12):1 364-1 367.
[7]陈丽凤,吴可克,王舫,等.无机阳离子对酪氨酸酶活性的上调作用[J].大连轻工业学院学报,2000,19(3):175-177.
[8]Ruan L F,Yu Z N,Fang B,et al.Melanin pigment formation and increased UV resistance in bacillus thuringiensis following high temperature induction[J].System Appl Microbiol,2004,27:286-289.
[9]Yuzo F,Masahiro A,Masakatsu I,et al.Fungal melanin inhibitor and related compounds from Penicillium decumbens[J].Phytochemistry,2002,60:703-708.
[10]Metal L B.Specificities of the tyrosinase-related proteins[J]. Biochemical and Biophysical Research Communications,1998(3):579-585.
[11]Liu N,Zhang T,Wang Y J,et al.A heat inducible tyrosinase with distinct properties from Bacillus thuringiensis[J]. Letters in Applied Microbiology,2004,39:407-412.
[12]Junwei D,Shuping B.Aluminum ions accelerated the oxidative stress of coppermediated melanin formation[J]. Spectrochimica Acta Part A,2003,59:3 075-3 083.◇
Study on Characteristics of Polyphenol Oxidase from Bacillus subtilis ZH168
ZHANG Lixiang
(Beijing Economic Management School,Beijing 100142,China)
Polyphenol oxidase is extracted from fermented liquid of Bacillus subtilis ZH168,and the effects of pH,temperature,substrate,activator,and inhibitor on its properties are explored by spectrophotometry.When catechol is used as the substrate,the enzyme showed high activity at pH 7;when levodopa is used as the substrate,the optimal pH is 8.The enzyme shows good thermal stability and the optimum temperature is 40℃.The enzyme has low substrate specialty,it is activated by SDS,Triton X-100,urea,and inhibited by Cys,NaHSO3,EDTA,VC,benzoic acid and Gly.In addition,the enzyme activity is significantly enhanced by Cu2+but inhibited strongly by Al3+and Mn2+.
melanin melanin;Bacillus subtilis;tyrosinase;PPO;enzymatic activity
S626
A
10.16693/j.cnki.1671-9646(X).2017.07.004
1671-9646(2017)07a-0015-02
2017-03-01
张丽香(1976—),女,博士,讲师,研究方向为食品微生物资源开发利用及微生物检测。
