参附注射液联合利奈唑胺治疗耐甲氧西林金黄色葡萄球菌重症肺炎的临床观察
2017-08-22李劲松陈继军巫兴阳自贡市第四人民医院重症医学科四川自贡643000
李劲松,陈继军,朱 涛,巫兴阳(自贡市第四人民医院重症医学科,四川自贡 643000)
参附注射液联合利奈唑胺治疗耐甲氧西林金黄色葡萄球菌重症肺炎的临床观察
李劲松*,陈继军,朱 涛,巫兴阳(自贡市第四人民医院重症医学科,四川自贡 643000)
目的:观察参附注射液联合利奈唑胺治疗耐甲氧西林金黄色葡萄球菌(MRSA)重症肺炎患者的临床效果及安全性。方法:采用回顾性研究方法,选择2012年6月-2015年10月在我院重症监护病房治疗的62例MRSA重症肺炎患者的临床资料,按照用药方案分为观察组(25例)和对照组(28例)。在常规治疗的基础上,对照组患者给予利奈唑胺注射液600 mg,ivgtt,bid;观察组患者在对照组基础上加用参附注射液,首次静脉注射60 mL,随后以20 mL/h的速率持续静脉泵入60 mL,q12 h。两组患者均连续治疗2周。比较两组患者的临床疗效、细菌学疗效、治疗前后的心功能指标和血清炎症因子水平,以及不良反应发生情况。结果:观察组患者的临床有效率为88.00%,明显高于对照组的60.71%,差异有统计学意义(P<0.05)。观察组患者的细菌清除率为72.00%,对照组患者为64.28%,组间比较差异无统计学意义(P>0.05)。治疗前,两组患者的心功能指标和血清炎症因子水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者的左室射血分数、每搏输出量、心输出量和心脏排血指数均较治疗前明显升高,血清肿瘤坏死因子α、白细胞介素6、C反应蛋白和前降钙素水平均较治疗前明显降低,且观察组上述指标水平均明显优于对照组,差异均有统计学意义(P<0.05)。两组患者治疗过程中均未见严重不良反应发生。结论:参附注射液联合利奈唑胺可有效改善MRSA重症肺炎患者的心功能,提高抗炎效果,临床疗效显著,且安全性较高。
耐甲氧西林金黄色葡萄球菌;重症肺炎;参附注射液;利奈唑胺;心功能;血清炎症因子
金黄色葡萄球菌(SA)是医院获得性感染和社区相关性感染最重要的病原体,极易侵袭免疫功能及细菌清除能力低下者(如高龄体弱人群、低体质量新生儿、大创伤或手术后者、免疫缺陷疾病者等),进而导致各类型感染性疾病(如肺炎、脑膜炎、心内膜炎、骨髓炎、肠炎、脓毒症等)[1]。随着抗菌药物的广泛应用,耐甲氧西林金黄色葡萄球菌(MRSA)的感染率逐年上升,MRSA感染率约占全部SA感染率的50.8%,其中医院获得性MRSA感染率约占48.9%[2-3]。MRSA重症肺炎作为ICU的一种常见呼吸系统疾病,治疗较为困难,患者病死率较高。
利奈唑胺作为一种新型的唑烷酮类抗菌药物,具有杀菌效能高、肺组织穿透能力高、耐药性低等特点,已有较多研究证实其治疗MRSA肺炎的临床效果及细菌清除率均优于替考拉宁和万古霉素[4-5]。然而,大剂量、长疗程抗菌药物治疗易导致药物敏感性下降,且可诱发患者血红蛋白下降、血小板降低、白细胞降低等骨髓抑制症状和恶心、呕吐、腹泻等消化道反应[6-7]。参附注射液具有匡扶正气、畅达阳气、推动气血流畅、恢复阴阳平衡等功效,已被较多研究证实可有效抑制过度炎症反应、改善微循环状态、维持血流动力学稳定、保护重要脏器功能、降低远期病死率等[8-9]。本研究采用参附注射液联合利奈唑胺治疗MASA重症肺炎,临床效果较好,现报道如下。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)年龄>18岁;(2)临床症状、痰培养、影像学检查结果提示MRSA肺炎,且头孢类、喹诺酮类抗菌药物等治疗无效;(3)符合重症肺炎的诊断标准[10];(4)患者及其家属知情同意并签署知情同意书。
排除标准:(1)肺癌、肺结核患者;(2)其他耐药菌感染或混合性细菌感染者;(3)自身免疫疾病、免疫缺陷病患者;(4)长期应用免疫抑制剂或糖皮质激素者;(5)妊娠或哺乳期妇女;(6)对本研究所用药物过敏者;(6)治疗依从性较差者。
1.2 研究对象
本研究方案经医院医学伦理委员会审核通过后,采用回顾性研究方法,选择2012年6月-2015年10月在我院重症监护病房(ICU)治疗的62例MRSA重症肺炎患者的临床资料,按照用药方案分为观察组(25例)和对照组(28例)。患者年龄、性别、急性生理学及慢性健康状况评分系统(APACHEⅡ)评分、合并症、吸烟饮酒史等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
1.3 治疗方法

表1 两组患者一般资料比较Tab 1 Comparison of general information of patients between 2 groups
两组患者均积极处理原发疾病,同时给予化痰、吸氧、营养支持、控制血压及血糖、纠正水电解质酸碱平衡紊乱、维持内环境稳定、机械通气(合并呼吸衰竭时)等常规治疗方案。在此基础上,对照组患者给予利奈唑胺注射液(挪威Fresenius Kabi Norge AS,注册证号:H20110312,规格:300 mL∶600 mg)600 mg,ivgtt,bid。观察组患者在对照组基础上加用参附注射液[华润三九(雅安)药业有限公司,批准文号:国药准字Z51020664,规格:10 mL],首次静脉注射60 mL,随后以20 mL/h的速率持续静脉泵入60 mL,q12 h,保持平均动脉压在65 mmHg(1 mmHg=0.133 kPa)以上,酌情加用少量血管活性药物(如多巴胺)。两组患者均连续治疗2周。
1.4 观察指标及疗效判定标准
(1)观察两组患者的临床疗效和细菌清除情况。疗效判定标准[11]——痊愈:治疗后患者临床症状消失,胸部X线基本正常,白细胞恢复正常水平,病原菌完全或部分清除,完全脱离呼吸机;显效:临床症状显著改善,体温有所下降,胸部X线显著改善,病原菌部分清除,呼吸机参数明显降低;进步:临床症状有所好转但不够明显,体温有所下降,胸部X线有所改善,病原菌部分清除或未清除,呼吸机参数有所下降;无效:持续发热不退,精神状态较差,胸部X线无变化或恶化,白细胞水平不变或持续增高,病原菌未清除,呼吸机参数不变或持续增高。临床有效率=(痊愈例数+显效例数+进步例数)/患者总例数×100%。细菌学疗效判定标准[11]——清除:治疗后1 d所取标本无致病菌;假设清除:治疗前标本的细菌培养呈阳性,治疗后患者的临床疗效达到“显效”但不能收集到痰培养标本;替换:患者体内的原始致病菌被清除,但痰培养出现新的致病菌,无临床症状;未清除:治疗后致病菌依然存在;再感染:原始致病菌已被清除,但痰培养出新的需要治疗的致病菌。清除率=(清除例数+假设清除例数+替换例数)/患者总例数× 100%。(2)比较两组患者治疗前后的心功能指标。采用飞利浦IE33型超声心动图检测患者的左室射血分数(LVEF)、每搏输出量(SV)、心输出量(CO)和心脏排血指数(CI)。(3)比较两组患者治疗前后的血清炎症因子水平。采用酶联免疫吸附法(ELISA)测定血清肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)水平,试剂盒均由南京森贝伽生物科技有限公司提供;采用免疫比浊法测定血清C反应蛋白(CRP)水平,试剂盒由德国罗氏公司提供;采用LumatLB 9507型电化学发光分析仪(德国Berthold Technologies公司)、固相免疫色谱法测定血清前降钙素(PCT)水平。(4)观察两组患者不良反应发生情况。
1.5 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料以例数或率表示,采用χ2检验;等级资料以例数或率表示,采用Z检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效和细菌清除率比较
观察组患者的临床有效率为88.00%,明显高于对照组的60.71%,差异有统计学意义(P<0.05)。观察组患者的细菌清除率为72.00%,对照组患者为64.28%,组间比较差异无统计学意义(P>0.05),详见表2、表3。
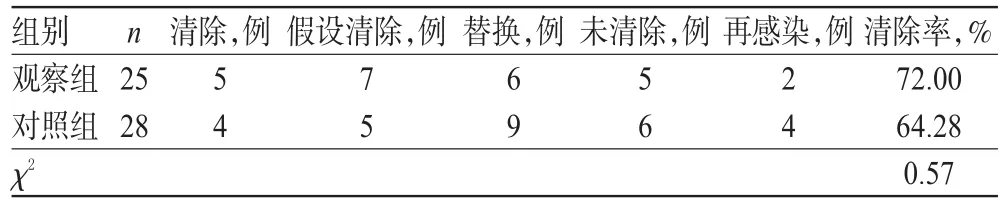
表3 两组患者细菌清除率比较Tab 3 Comparison of bacterial clearance rate between 2 groups
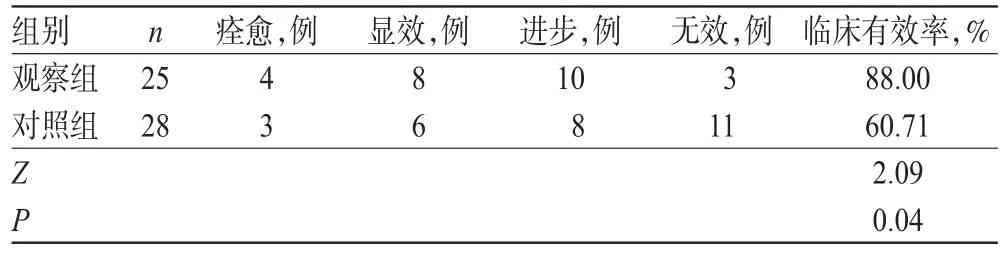
表2 两组患者临床疗效比较Tab 2 Comparison of clinical efficacy between 2 groups
2.2 两组患者治疗前后心功能指标比较
治疗前,两组患者的LVEF、SV、CO和CI比较,差异均无统计学意义(P>0.05);治疗后,两组患者的上述指标均较治疗前明显升高,且观察组指标明显高于对照组,差异均有统计学意义(P<0.05),详见表4。
2.3 两组患者治疗前后血清炎症因子水平比较
治疗前,两组患者血清TNF-α、IL-6、CRP和PCT水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者的上述指标水平均较治疗前明显降低,且观察组指标明显低于对照组,差异均有统计学意义(P<0.05),详见表5。
表4 两组患者治疗前后心功能指标比较(±s)Tab 4 Comparison of cardiac function indexes between 2 groups before and after treatment(±s)

表4 两组患者治疗前后心功能指标比较(±s)Tab 4 Comparison of cardiac function indexes between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别观察组对照组CI n tP治疗后3.1±0.9*2.7±0.7*2.36<0.001 25 28 LVEF,%治疗前34.9±5.3 33.8±4.7 1.04 0.30治疗后46.5±5.6*39.3±5.4*6.18<0.001 SV,mL治疗前49.3±8.8 48.5±9.2 0.42 0.68治疗后59.3±8.3*54.7±8.5*2.58 0.01 CO,L/min治疗前2.5±0.6 2.6±0.7 0.72 0.47治疗后4.3±0.7*3.7±0.8*3.75<0.001治疗前1.7±0.8 1.8±0.9 0.55 0.58
表5 两组患者治疗前后血清炎症因子水平比较(±s)Tab 5 Comparison of serum inflammatory factors between 2 groups before and after treatment(±s)

表5 两组患者治疗前后血清炎症因子水平比较(±s)Tab 5 Comparison of serum inflammatory factors between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别观察组对照组n tP治疗后2.3±1.0*3.1±1.2*3.40 0.00 25 28 TNF-α,ng/L治疗前112.3±22.3 108.5±20.4 0.84 0.40治疗后55.3±20.2*80.9±19.7*6.06<0.001 IL-6,ng/L治疗前143.6±25.2 139.9±28.6 0.65 0.52治疗后43.4±11.5*59.4±10.3*6.94<0.001 CRP,mg/L治疗前78.5±11.5 76.8±12.3 0.67 0.51治疗后31.8±9.8*40.3±10.9*3.86<0.001 PCT,g/L治疗前8.4±1.5 8.0±1.3 1.35 0.19
2.4 不良反应
两组患者治疗过程中均未见严重不良反应,血常规及肝肾功能正常。观察组患者有1例皮疹、1例轻度恶心、2例轻度头晕;对照组患者有2例轻度恶心、1例阵发性室上性心动过速。两组患者的不良反应均可耐受,给予相应的对症处理后均自行恢复正常。
3 讨论
MRSA重症肺炎多发生于年老体弱者、严重基础疾病者、长期住院者、经常性应用抗菌药物者、免疫功能低下者等,此类人群多合并高血压、冠心病、糖尿病、慢性阻塞性肺疾病等多种内科疾病,治疗过程中并发症多,预后较差,远期病死率较高[12]。万古霉素是治疗MRSA肺炎的一线传统药物,可通过结合细菌细胞壁肽聚糖前体末端结构,破坏细胞壁的完整性而发挥杀菌效应。然而,近年来研究发现,万古霉素的肺组织穿透力较低、杀菌速度较慢,且随着万古霉素中介金黄色葡萄球菌(VISA)和耐万古霉素金黄色葡萄球菌(VRSA)的出现,万古霉素的敏感性逐渐下降;同时,临床发现万古霉素最低抑菌浓度(MIC)可发生漂移作用,明显降低了MRSA肺炎的治疗成功率[13]。利奈唑胺作为一种新型唑烷酮类抗菌药物,可通过抑制细菌蛋白质合成而发挥杀菌效应,其组织穿透能力强、交叉耐药发生率低,已逐渐取代万古霉素成为MRSA肺炎的首选治疗药物。柯邵鹏等[14]通过一项荟萃分析发现,利奈唑胺治疗MRSA感染的临床及微生物疗效均明显优于万古霉素。
然而,长疗程、大剂量利奈唑胺的使用可导致血小板下降、恶心、呕吐、头痛、周围神经病变、末梢神经炎等多种不良反应。陈超等[15]通过回顾性分析345例应用利奈唑胺的住院患者的临床资料,发现利奈唑胺导致血小板降低率约为28.73%,年龄、基础营养状态、肾功能等是血小板降低的影响因素。参附注射液是由红参和附子组成的中药复方注射剂,其有效成分是人参皂苷和乌头碱。现代药理学研究表明,参附注射液可通过抑制核转录因子NF-κB的活化,进而抑制炎症因子如IL-6、TNF-α的释放,避免炎症因子级联反应及大量释放,调节促炎/抗炎因子平衡,减轻组织器官炎症损伤[16]。同时,参附注射液可促进前列腺素的释放,提高冠脉血流量,促进钙离子内流,增强心肌收缩力,降低血液黏度,改善微循环,维持循环稳定[17]。此外,参附注射液还可激活超氧化物歧化酶,降低机体氧自由基水平,减轻心脏、肺等器官的氧化应激损伤[8]。
本研究中,观察组患者在应用利奈唑胺的基础上联合参附注射液治疗MRSA重症肺炎,治疗后血清IL-6、TNF-α、PCT和CRP等炎症因子水平均明显低于对照组,证实了参附注射液的抗炎效应。观察组患者治疗后的LVEF、SV、CO和CI等心功能指标均明显高于对照组,说明参附注射液能明显改善MRSA重症肺炎患者的心功能状态。本研究还发现,观察组患者的临床有效率明显高于对照组、细菌清除率略高于对照组,说明参附注射液联合利奈唑胺治疗MRSA重症肺炎的临床效果更好。两组患者治疗过程中肝肾功能无明显异常,且不良反应轻微,患者均可耐受,说明参附注射液并未增加不良反应。
综上所述,参附注射液可有效改善MRSA重症肺炎患者的心功能,增强利奈唑胺的抗炎效应,临床效果显著,且安全性较高。然而本研究样本量较小、随访时间较短,同时并未对两组患者的远期预后情况进行统计分析,故本结论尚需大样本、高质量的随机对照研究加以证实;此外,参附注射液对MRSA肺炎的具体作用机制仍需要作进一步研究。
[1] Ruggero MA,Peaper DR,Topal JE.Telavancin for refractory methicillin-resistant Staphylococcus aureus bacteremia and infective endocarditis[J].Infect Dis(Lond),2015,47(6):379-384.
[2] 李光辉,朱德妹,汪复,等.2012年中国CHINET血培养临床分离菌的分布及耐药性[J].中国感染与化疗杂志,2014,14(6):474-481.
[3] 黄妮妮,刘洁.耐甲氧西林金黄色葡萄球菌感染流行病学调查[J].中华医院感染学杂志,2005,15(1):47-48.
[4] 施珍,康建强.利奈唑胺与替考拉宁治疗高龄患者重症MRSA感染的回顾性分析[J].中国药房,2015,26(29):4140-4142.
[5] Wang Y,Zou Y,Xie J,et al.Linezolid versus vancomycin for the treatment of suspected methicillin-resistant Staphylococcus aureus nosocomial pneumonia:a systematic review employing meta-analysis[J].Eur J Clin Pharmacol,2015,71(1):107-115.
[6] Lin PC,Wang BC,Kim R,et al.Estimating the cost-effectiveness of linezolid for the treatment of methicillin-resistant Staphylococcus aureus nosocomial pneumonia in Taiwan[J].J Microbiol Immunol Infect,2016,49(1):46-51.
[7] Pea F,Petrosillo N,Garau J.Clinical pharmacological approach for balancing the use of daptomycin and linezolid in comparison with that of vancomycin in the treatment of MRSA-related infections[J].Expert Rev Anti Infect Ther,2015,13(8):927-937.
[8] 黄君龄,孟婧,袁颖,等.参附注射液对心肺复苏多脏器功能保护的研究[J].中华急诊医学杂志,2014,23(7):791-795.
[9] 刘美,吕静.参附注射液对老年脑梗死患者血清IL-6及TNF-α的影响[J].中国老年学杂志,2015,35(22):6419-6420.
[10] 易慧,谢灿茂.重症肺炎临床及预后因素分析[J].中华医院感染学杂志,2008,18(1):56-58.
[11] 秦红梅,冀红.利奈唑胺治疗耐甲氧西林金黄色葡萄球菌感染重症肺炎的疗效观察[J].中国老年学杂志,2014,34(20):5869-5870.
[12] Niederman MS,Chastre J,Solem CT,et al.Health economic evaluation of patients treated for nosocomial pneumonia caused by methicillin-resistant Staphylococcus aureus:secondary analysis of a multicenter randomized clinical trial of vancomycin and linezolid[J].Clin Ther,2014,36(9):1233-1243.
[13] Jacqueline C,Broquet A,Roquilly A,et al.Linezolid dampens neutrophil-mediated inflammation in methicillinresistant Staphylococcus aureus-induced pneumonia and protects the lung of associated damages[J].J Infect Dis,2014,210(5):814-823.
[14] 柯邵鹏,刘江福,苏智军,等.利奈唑胺与万古霉素治疗耐甲氧西林金黄色葡萄球菌感染疗效及安全性荟萃分析[J].中华医院感染学杂志,2015,25(6):1281-1284.
[15] 陈超,郭代红,曹秀堂,等.住院患者使用利奈唑胺致相关性血小板减少症的危险因素分析[J].中国药物警戒,2012,9(2):71-76.
[16] Yuan W,Wu JY,Wang GX,et al.Effect of Shenfu injection pretreatment to myocardial metabolism during untreated ventricular fibrillation in a porcine model[J].Chin Med J(Engl),2015,128(22):3076-3082.
[17] Wu W,Jiang RL,Wang LC,et al.Effect of Shenfu injection on intestinal mucosal barrier in a rat model of sepsis [J].Am J Emerg Med,2015,33(9):1237-1243.
(编辑:胡晓霖)
Clinical Observation of Shenfu Injection Combined with Linezolid in the Treatment of Severe Pneumonia Caused by Methicillin-resistant Staphylococcus aureus
LI Jinsong,CHEN Jijun,ZHU Tao,WU Xingyang(ICU,Zigong Forth People’s Hospital,Sichuan Zigong 643000,China)
OBJECTIVE:To observe clinical effect and safety of Shenfu injection combined with linezolid in the treatment of severe pneumonia caused by methicillin-resistant Staphylococcus aureus(MRSA).METHODS:In retrospective study,62 MRSA severe pneumonia patients selected from ICU of our hospital during Jun.2012-Oct.2015 were divided into observation group(25 cases)and control group(28 cases)according to medication plan.Based on routine treatment,control group was additionally given Linezolid injection 600 mg,ivgtt,bid.Observation group was additionally given Shenfu injection intravenously with initial dose of 60 mL,and then given continuous intravenous infusion of 60 mL at a rate of 20 mL/h,q12 h,on the basis of control group.Both groups were treated for consecutive 2 weeks.Clinical efficacy,bacteriological efficacy,cardiac function indexes and serum levels of inflammatory factors before and after treatment as well as the occurrence of ADR were compared between 2 groups.RESULTS:The clinical response rate of observation group was 88.00%,which was significantly higher than 60.71%of control group,with statistical significance(P<0.05).Bacterial clearance rate of observation group was 72.00%,and that of control group was 64.28%,there was no statistical significance between 2 groups(P>0.05).Before treatment,there was no statistical significance in cardiac function indexes and serum inflammatory factor levels between 2 groups(P>0.05).After treatment,LVEF,SV,CO and CI of 2 groups were increased significantly compared to before treatment,while the levels of TNF-α,IL-6,CRP and PCT were decreased significantly;the indexes of observation group was significantly better than those of control group,with statistical significance(P<0.05).No severe ADR was found in 2 groups.CONCLUSIONS:Shenfu injection combined with linezolid effectively improves the cardiac function of patients with MRSA severe pneumonia,enhances the anti-inflammatory effect,and have a very significant clinic effect with good safety.
Methicillin-resistant Staphylococcus aureus;Severe pneumonia;Shenfu injection;Linezolid;Cardiac function;Serum inflammatory factor
R453
A
1001-0408(2017)20-2800-04
2016-08-14
2016-10-11)
*副主任医师。研究方向:脓毒症。电话:0813-22077237。E-mail:1749422337@qq.com
DOI10.6039/j.issn.1001-0408.2017.20.18
