乌司他丁通过诱导miR-155抑制体外循环心脏手术患者炎症反应的作用机制研究
2017-08-22徐黎青韦江启新乡市第一人民医院心胸外科河南新乡453000
徐黎青,韦江启(新乡市第一人民医院心胸外科,河南新乡 453000)
乌司他丁通过诱导miR-155抑制体外循环心脏手术患者炎症反应的作用机制研究
徐黎青*,韦江启(新乡市第一人民医院心胸外科,河南新乡 453000)
目的:研究乌司他丁在体外循环(CPB)心脏手术中对患者炎症因子抑制作用的机制。方法:选取2012年7月-2016年7月于我院择期行CPB心脏手术的40例患者为研究对象,按照随机数字表法分为对照组和观察组,各20例。观察组患者于麻醉诱导后即给予30万U乌司他丁静脉泵注,以2.5 mL/min的速率在20 min内完成,再将70万U乌司他丁以0.2 mL/min的速率使用微量泵持续静脉泵注至术毕;对照组患者给予等容量生理盐水。分别于麻醉诱导前(术前)和CPB停止(术后)6、12、24 h采集患者血液标本,以实时定量逆转录聚合酶链反应和蛋白质免疫印迹法检测外周血单核细胞中微小核糖核酸155(miR-155)及其靶基因髓样分化因子88(MyD88)的表达情况;以酶联免疫吸附测定法检测血清肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和IL-8的表达情况;采用Pearson相关系数分析观察组患者术后24 h的miR-155与TNF-α、IL-6、IL-8表达的相关性。结果:与对照组比较,观察组患者的miR-155表达水平显著升高,其靶基因MyD88的表达水平显著降低,炎症因子TNF-α、IL-6、IL-8的表达水平显著降低,差异均有统计学意义(P<0.01)。观察组患者术后24 h的miR-155与TNF-α、IL-6、IL-8的表达水平呈显著负相关(P<0.01)。结论:乌司他丁可通过诱导miR-155的表达来抑制炎症因子TNF-α、IL-6、IL-8的释放,这可能是该药在CPB心脏手术中发挥抗炎作用的新机制。
乌司他丁;体外循环;心脏手术;微小核糖核酸155;炎症反应
体外循环(Cardiopulmonary bypass,CPB)心脏手术是近年来开展较多的一类手术方式,CPB现已成为心内直视术的辅助手段。但是,手术期间由于血液与人工管道的接触、各脏器的低灌注及手术器械对机体的机械性损伤,加之器官缺血再灌注、疼痛等多因素的强烈刺激,从而激活体内的中性粒细胞、单核-巨噬细胞、内皮细胞等释放大量的炎症因子,进而激活体内免疫系统诱发级联炎症反应,导致全身炎症反应及多器官功能障碍综合征,甚至引起患者死亡[1-2]。因此,对此类手术患者在围术期的防控干预对其脏器的功能状态有着较大的影响,直接关系到手术的效果和预后。目前,临床常用一些蛋白酶抑制剂改善CPB引起的炎症反应,其中乌司他丁(Ulinastain)作为一种广谱蛋白水解酶抑制剂,对体内多种蛋白水解酶的活性发挥了广泛的抑制作用。其可清除氧自由基,减少炎症介质释放和炎症细胞浸润[3-4],从而减轻CPB心脏手术后患者的炎症反应,对CPB造成的心肌损伤发挥重要的保护作用,但目前关于其对心肌损伤的保护机制尚需要进一步研究。近年来的研究发现,心肌中的微小核糖核酸(miRNA)在心肌损伤的保护功能中起到重要的调控作用[5-7],这为临床上进行心肌保护治疗提供了新的靶点。那么乌司他丁减轻CPB心脏手术后患者的炎症反应、对心肌的保护作用是否与调节miRNA相关?研究发现,miR-155是一个重要的心肌功能调控miRNA,可通过抑制Toll样受体(TLRs)信号通路中重要的转导蛋白髓样分化因子88(MyD88)进而抑制核转录因子kappa B(NF-κB)信号通路的激活,减少炎症因子[肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和IL-8]的分泌[8]。因此,本研究中,笔者考察了乌司他丁对CPB心脏手术患者miR-155、TNF-α、IL-6和IL-8表达的影响,探讨了乌司他丁通过诱导miR-155进而抑制CPB心脏手术患者炎症反应、发挥心肌保护作用的机制。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)拟择期行全身麻醉下CPB心脏手术的患者;(2)美国纽约心脏病协会(NYHA)分级1~3级;(3)年龄<65岁。
排除标准:(1)伴有严重呼吸、循环系统基础疾病者;(2)肝肾功能和凝血功能异常者;(3)心率<60次/min或心律失常者;(4)血气分析和(或)电解质异常、血红蛋白<110 g/L者。
1.2 研究对象
选取2012年7月-2016年7月于我院进行CPB心脏手术的40例患者,按照随机数字表法分为对照组和观察组,各20例。两组患者的性别、年龄、体质量、手术类型、手术时间、CPB时间等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院医学伦理委员会审核通过,所有患者或其家属术前均阅读并签署知情同意书。

表1 两组患者一般资料比较(n=20)Tab 1 Comparison of general information of patients between 2 groups(n=20)
1.3 治疗方法
两组患者术前均常规禁食禁饮且均未用药。采用气管插管静吸复合麻醉常规CPB的方法进行手术;麻醉诱导均采用咪达唑仑4 mg+芬太尼15µg/kg+顺苯磺酸阿曲库铵0.15 mg/kg+依托咪酯0.2 mg/kg;麻醉维持采用七氟醚最小肺泡浓度(MAC)的0.8~1.5倍量。术中连续监测患者的平均动脉压、中心静脉压、心电图、尿量,并进行血气分析。观察组患者在麻醉诱导后即给予注射用乌司他丁(广东天普生化医药股份有限公司,批准文号:国药准字H19990134,批号:031604143,规格:10万U)30万U溶入50 mL生理盐水中静脉泵注,以2.5 mL/min的速率在20 min内完成,再将70万U(溶入50 mL生理盐水中)乌司他丁以0.2 mL/min的速率使用微量泵持续静脉泵注至术毕。对照组患者给予等容量生理盐水。两组其他预充液及CPB方法相同。
1.4 观察指标
(1)比较两组患者麻醉诱导前(术前)和CPB停止(术后)6、12、24 h外周血单核细胞中miR-155及其靶基因MyD88的表达情况。(2)比较两组患者术前及术后6、12、 24 h血清炎症因子(TNF-α、IL-6和IL-8)的表达结果。(3)分析观察组患者术后24 h的miR-155与炎症因子表达情况的相关性。(4)观察两组患者不良反应发生情况。
1.5 检测方法
(1)两组患者分别于术前和术后6、12、24 h由中心静脉导管采集血液标本,按照Ficoll-Paque PREMIUM细胞分离液(瑞典GE公司)说明书分离外周血单核细胞;依据Trizol试剂(美国Invitrogen公司)说明书提取细胞总RNA,采用miRNA实时定量逆转录聚合酶链反应(qRT-PCR)试剂盒(美国GeneCopeia公司)检测外周血单核细胞中miR-155的表达情况。miR-155上游引物:5′-CTCCTACATATTAGCATTAACA-3′;下游引物:由试剂盒提供;以snRNA U6为内参,内参上游引物:5′-CGCTTCGGCAGCACATATACTAA-3′;下游引物:5′-TATGGAACGCTTCACGAATTTGC-3′。以循环阈值(Ct值)为统计参数,采用2-ΔΔCt计算方法,用相对定量法(目的基因Ct值/snRNA U6内参基因Ct值)对miR-155的表达进行相对定量。(2)采用蛋白质免疫印迹(Western blot)法检测外周血单核细胞中miR-155靶基因MyD88的表达情况:外周血单核细胞经RIPA裂解液(上海碧云天生物公司)裂解,离心,取上清,采用BCA试剂盒(上海碧云天生物公司)测定蛋白浓度。取等量蛋白通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,以半干法转至聚偏氟乙烯(PVDF)膜,于5%脱脂奶粉中室温封闭2 h;将膜分别置于兔抗MyD88多克隆抗体(美国CST公司)、兔抗β-actin多克隆抗体(美国CST公司)一抗稀释液(稀释比例均为1∶1 000,V/V)中,4℃孵育过夜,用含吐温20的磷酸盐缓冲液(PBST)洗膜3次,每次10 min;再将膜置于辣根过氧化物酶(HRP)标记山羊抗小鼠免疫球蛋白(Ig)G(北京中杉公司)二抗稀释液(稀释比例均为1∶10 000,V/V)中室温孵育2 h,PBST洗膜3次,每次10 min。将增强型化学发光(ECL)底物(美国Millpore公司)滴加至PVDF膜上,于化学发光检测仪收集荧光信号,用Gel-Pro Analyzer分析软件分析蛋白的灰度值,与内参蛋白β-actin的灰度值进行相对定量(目的蛋白灰度值/内参蛋白灰度值)。(3)应用酶联免疫吸附测定(ELISA)试剂盒(美国R&D Systems公司)测定患者血清中炎症因子TNF-α、IL-6和IL-8的表达情况。
1.6 统计学方法
采用SPSS 16.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料以例数表示,采用χ2检验;应用Pearson相关系数分析miR-155与TNF-α、IL-6、IL-8表达的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术前后外周血单核细胞中miR-155及其靶基因MyD88的表达情况
术前,两组患者外周血单核细胞中miR-155的表达水平比较,差异均无统计学意义(P>0.05)。与术前比较,对照组患者术后6、12、24 h外周血单核细胞中miR-155的表达水平均显著降低,观察组患者的表达水平均显著升高;且观察组患者术后各时点miR-155的表达水平均显著高于对照组,差异均有统计学意义(P<0.05或 P<0.01),详见表2。
表2 两组患者手术前后外周血单核细胞中miR-155的表达结果(±s,n=20)Tab 2 Expression of miR-155 in peripheral blood mononuclear cells in 2 groups before and after surgery(±s,n=20)

表2 两组患者手术前后外周血单核细胞中miR-155的表达结果(±s,n=20)Tab 2 Expression of miR-155 in peripheral blood mononuclear cells in 2 groups before and after surgery(±s,n=20)
注:与术前比较,*P<0.05,**P<0.01;与对照组比较,#P<0.01Note:vs.before operation,*P<0.05,**P<0.01;vs.control group,#P<0.01
术后24 h 0.317±0.035**6.573±0.334**#组别对照组观察组术前1.123±0.105 1.037±0.103术后6 h 0.820±0.030*1.560±0.105**#术后12 h 0.543±0.080**3.340±0.248**#
术前及术后6 h,两组患者外周血单核细胞中MyD88的表达水平比较,差异均无统计学意义(P>0.05)。与术前比较,两组患者术后12、24 h外周血单核细胞中MyD88的表达水平均显著升高,但观察组患者显著低于对照组,差异均有统计学意义(P<0.05或P<0.01),详见表3。
表3 两组患者手术前后外周血单核细胞中MyD88的表达结果(±s,n=20)Tab 3 Expression of MyD88 in peripheral blood mononuclear cells in 2 groups before and after surgery(±s,n=20)
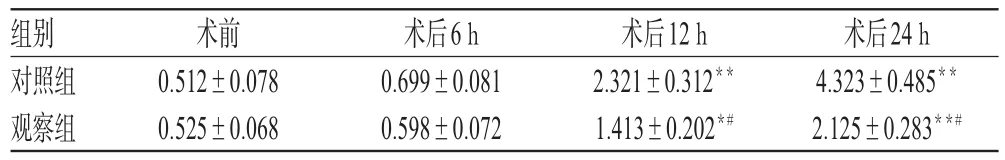
表3 两组患者手术前后外周血单核细胞中MyD88的表达结果(±s,n=20)Tab 3 Expression of MyD88 in peripheral blood mononuclear cells in 2 groups before and after surgery(±s,n=20)
注:与术前比较,*P<0.05,**P<0.01;与对照组比较,#P<0.01Note:vs.before operation,*P<0.05,**P<0.01;vs.control group,#P<0.01
术后24 h 4.323±0.485**2.125±0.283**#组别对照组观察组术前0.512±0.078 0.525±0.068术后6 h 0.699±0.081 0.598±0.072术后12 h 2.321±0.312**1.413±0.202*#
2.2 两组患者手术前后血清炎症因子的表达情况
术前,两组患者各血清炎症因子表达水平比较,差异均无统计学意义(P>0.05)。与术前比较,两组患者术后6、12、24 h的TNF-α、IL-6和IL-8水平均显著升高,但观察组显著低于对照组,差异均有统计学意义(P<0.05或P<0.01),详见表4。
表4 两组患者手术前后血清TNF-α、IL-6和IL-8的表达结果(±s,n=20,pg/mL)Tab 4 The expression of serum TNF-α,IL-6 and IL-8 in 2 groups before and after surgery(±s,n=20,pg/mL)

表4 两组患者手术前后血清TNF-α、IL-6和IL-8的表达结果(±s,n=20,pg/mL)Tab 4 The expression of serum TNF-α,IL-6 and IL-8 in 2 groups before and after surgery(±s,n=20,pg/mL)
注:与术前比较,*P<0.05,**P<0.01;与对照组比较,#P<0.01Note:vs.before operation,*P<0.05,**P<0.01;vs.control group,#P<0.01
组别对照组观察组TNF-α IL-6 IL-8术后24 h 25.82±9.56**13.73±6.15*#术前30.23±10.78 28.56±6.35术后6 h 178.28±38.33**112.58±34.62**#术后12 h 135.46±25.63**75.33±28.59**#术后24 h 88.56±25.48**65.49±22.60**#术前13.51±4.54 15.34±5.12术后6 h 125.35±28.11**62.15±16.46**#术后12 h 98.45±18.37**43.21±11.78**#术后24 h 67.21±18.05**34.78±11.05*#术前10.12±3.85 9.12±2.57术后6 h 55.33±9.67**28.17±5.47**#术后12 h 42.72±10.16**18.62±4.49**#
2.3 乌司他丁诱导表达miR-155与炎症因子表达的相关性
采用Pearson相关系数分析观察组患者术后24 h的miR-155与炎症因子表达的相关性,发现经乌司他丁诱导表达的miR-155水平与TNF-α(r=-0.760,P<0.01)、IL-6(r=-0.726,P<0.01)、IL-8(r=-0.767,P<0.01)的表达水平均呈显著负相关。相关性分析结果见图1。
3 讨论
CPB过程中有大量炎症因子产生,形成复杂的炎症因子网络和级联炎症反应[9]。其中,TNF-α是主要由单核-巨噬细胞产生的早期炎症细胞因子,是CPB围术期炎症反应中最主要的内源性炎症介质,在级联炎症反应中起核心作用[10]。TNF-α可刺激多种炎症细胞产生IL-6,而IL-6是具有代表性的炎症因子,其表达水平变化可作为早期机体损伤的参考指标,与多种心血管疾病的病理生理过程密切相关,也是后续严重临床并发症的预测因子[11]。TNF-α还可诱导单核-巨噬细胞产生IL-8,使中性粒细胞释放活性氧自由基、蛋白水解酶及其他细胞因子,共同引起组织器官损伤[12]。因此,如何降低CPB过程中对机体的损伤成为临床干预及治疗的研究热点。
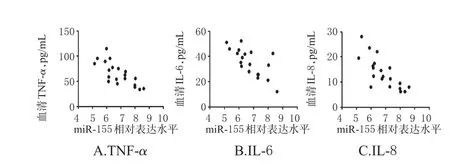
图1 观察组患者术后24 h的miR-155与TNF-α、IL-6、IL-8表达的相关性分析结果Fig 1 Correlation of the expression of miR-155 with the expression of TNF-α,IL-6 and IL-8 in observation group 24 h after surgery
乌司他丁是从男性新鲜尿液中分离纯化而来的一种酸性糖蛋白,是一种广谱的酶抑制剂,对多种蛋白酶、水解酶具有显著抑制作用,可抑制中性粒细胞过度激活、清除氧自由基、抑制炎症介质释放、降低炎症损伤程度[13]。目前临床上常将乌司他丁用于CPB过程中改善器官缺血再灌注损伤和保护心肌,但关于其作用机制尚缺乏相关报道。
miRNA在生物体各个组织器官的生长发育和某些疾病的发病过程中发挥着极其重要的调节作用。目前已经发现众多的miRNA参与了机体多种病理生理的发展过程。其中,miR-155是一个重要的抗炎miRNA,在造血细胞分化、免疫、炎症以及心血管功能方面发挥重要作用[14-16]。本研究发现,心脏手术患者在CPB过程中应用乌司他丁可显著诱导外周血单核细胞中miR-155的表达,并抑制miR-155靶基因MyD88的表达,从而抑制MyD88介导的NF-κB炎症信号通路的活化,减弱炎症因子TNF-α、IL-6和IL-8的表达;进一步的研究发现,经乌司他丁诱导表达的miR-155水平与TNF-α、IL-6、IL-8的表达水平呈显著负相关。这提示乌司他丁抑制炎症因子TNF-α、IL-6、IL-8的表达与诱导抗炎分子miR-155的表达相关。
综上所述,乌司他丁可通过诱导miR-155的表达来抑制炎症因子TNF-α、IL-6、IL-8的释放,这可能是该药在CPB心脏手术中发挥抗炎作用的新机制。但本研究并未检测乌司他丁对其他炎症相关的miRNA的表达以及其他炎症信号通路的作用效应,鉴于miRNA对基因的表达调控是一个复杂的网络调控系统,且炎症信号通路是相互关联的,故今后的研究可进一步探讨乌司他丁对多种miRNA及炎症信号通路串联的调控机制,从而为更加深入地阐明该药对机体多器官的保护作用机制以及指导临床合理用药提供依据。
[1] Landis RC,Brown JR,Fitzgerald D,et al.Attenuating the systemic inflammatory response to adult cardiopulmonary bypass:a critical review of the evidence base[J].J Extra Corpor Technol,2014,46(3):197-211.
[2] Durandy Y.Minimizing systemic inflammation during cardiopulmonary bypass in the pediatric population[J].Artif Organs,2014,8(1):11-18.
[3] Wang L,Huang X,Kong G,et al.Ulinastatin attenuates pulmonary endothelial glycocalyx damage and inhibits endothelial heparanase activity in LPS-induced ARDS[J]. Biochem Biophys Res Commun,2016,478(2):669-675.
[4] Li C,Ma D,Chen M,et al.Ulinastatin attenuates LPS-induced human endothelial cells oxidative damage through suppressing JNK/c-Jun signaling pathway[J].Biochem Biophys Res Commun,2016,474(3):572-578.
[5] Economou EK,Oikonomou E,Siasos G,et al.The role of microRNAs in coronary artery disease:from pathophysiology to diagnosis and treatment[J].Atherosclerosis,2015,241(2):624-633.
[6] Song MA,Paradis AN,Gay MS,et al.Differential expression of microRNAs in ischemic heart disease[J].Drug Discov Today,2015,20(2):223-235.
[7] Gottlieb RA,Pourpirali S.Lost in translation:miRNAs and mRNAs in ischemic preconditioning and ischemia/reperfusion injury[J].J Mol Cell Cardiol,2016,95:70-77.
[8] Tang B,Xiao B,Liu Z,et al.Identification of MyD88 as a novel target of miR-155,involved in negative regulation of Helicobacter pylori-induced inflammation[J].FEBS Lett,2010,584(8):1481-1486.
[9]Passaroni AC,Silva MA,Yoshida WB.Cardiopulmonary bypass:development of John Gibbon’s heart-lung machine[J].Rev Bras Cir Cardiovasc,2015,30(2):235-245.
[10] Gao M,Xie B,Gu C,et al.Targeting the proinflammatory cytokine tumor necrosis factor-α to alleviate cardiopulmonary bypass-induced lung injury:review[J].Mol Med Rep,2015,11(4):2373-2378.
[11] Chiesa C,Pacifico L,Natale F,et al.Fetal and early neonatal interleukin-6 response[J].Cytokine,2015,76(1):1-12.
[12] Yu QB,Li HM,Li LL,et al.Sevoflurane downregulates interleukin-6 and interleukin-8 levels in patients after cardiopulmonary bypass surgery:a meta-analysis[J].Genet Mol Res,2015,14(4):19016-19027.
[13] 肖敏,刘冰琪,万勇.国内乌司他丁治疗脓毒症的疗效的系统评价[J].中国药房,2013,24(36):3401-3404.
[14] Garo LP,Murugaiyan G.Contribution of microRNAs to autoimmune diseases[J].Cell Mol Life Sci,2016,73(10):2041-2051.
[15] Ranganath P.MicroRNA-155 and its role in malignant hematopoiesis[J].Biomark Insights,2015,10:95-102.
[16] Tao L,Bei Y,Zhou Y,et al.Non-coding RNAs in cardiac regeneration[J].Oncotarget,2015,6(40):42613-42622.
(编辑:胡晓霖)
Study on the Mechanism of Ulinastain Inhibiting Inflammatory Reaction of Patients Underwent Cardiopulmonary Bypass Cardiac Surgery by Inducing miR-155
XU Liqing,WEI Jiangqi(Dept.of Cardiothoracic Surgery,Xinxiang First People’s Hospital,Henan Xinxiang 453000,China)
OBJECTIVE:To study the mechianism of inhibitory effect of ulinastain on inflammatory factors of patients during cardiopulmonary bypass(CPB)cardiac surgery.METHODS:Totally 40 patients underwent selective CPB cardiac surgery collected from our hospital during Jul.2012-Jul.2016 were divided into control group and observation group according to random number table,with 20 cases in each group.Observation group was given 300 000 U of ulinastatin at 2.5 mL/min by intravenous pump within 20 min after anesthesia induction,then given 700 000 U of ulinastatin at 0.2 mL/min by continuous intravenous pump until operation finish.Control group was given equal volume of normal saline.Blood samples of patients were collected before anesthesia induction(before surgery)and 6,12,24 h after CPB(after surgery),respectively.The expression of miR-155 and its target gene MyD88 in peripheral blood mononuclear cells of each group were detected by Real-time PCR and Western blot.The expression of TNF-α,IL-6 and IL-8 were measured by ELISA.The correlation of miR-155 with the expression of TNF-α,IL-6 and IL-8 in patients of observation group 24 h after surgery were analyzed by using Pearson correlation analysis.RESULTS:Compared with control group,the expression of miR-155 in observation group was significantly increased,while the expression of its target gene MyD88 was significantly decreased;the expression of TNF-α,IL-6 and IL-8 were reduced significantly,with statistical significance(P<0.01).The expression of miR-155 was significantly negative correlation with the expression of TNF-α,IL-6 and IL-8 in the patients of observation group 24 h after surgery(P<0.01).CONCLUSIONS:Ulinastatin can inhibit the release of inflammatory factors TNF-α,IL-6 and IL-8 by inducing the expression of miR-155,which may be a new mechanism for the anti-inflammatory effect of the drug in CPB cardiac surgery.
Ulinastain;Cardiopulmonary bypass;Cardiac surgery;miR-155;Inflammatory reaction
R614
A
1001-0408(2017)20-2742-04
2017-02-08
2017-04-22)
*副主任医师。研究方向:心肌缺血再灌注损伤。电话:0373-3665261。E-mail:xliqing6997@163.com
DOI10.6039/j.issn.1001-0408.2017.20.02
