他莫昔芬及其代谢产物血药浓度与ER阳性乳腺癌患者子宫内膜增生的相关性研究Δ
2017-08-22朱余兵刘赟心南京医科大学附属南京医院南京市第一医院药学部南京210006
朱余兵,赵 拯,刘赟心(南京医科大学附属南京医院/南京市第一医院药学部,南京 210006)
他莫昔芬及其代谢产物血药浓度与ER阳性乳腺癌患者子宫内膜增生的相关性研究Δ
朱余兵*,赵 拯,刘赟心(南京医科大学附属南京医院/南京市第一医院药学部,南京 210006)
目的:考察他莫昔芬(TAM)及其代谢产物血药浓度与雌激素受体(ER)阳性乳腺癌患者子宫内膜增生的相关性。方法:选取2015年3月-2016年4月我院ER阳性乳腺癌患者69例,均接受TAM持续治疗半年以上(每日2次,每次1片)。根据治疗后其子宫内膜厚度分为异常增生组(40例)和正常组(29例),采用高效液相色谱-荧光法测定其体内TAM及代谢产物[4-羟基他莫昔芬(OHT)、N-去甲基他莫昔芬(DMT)和Endoxifen]的稳态血药浓度,采用Pearson检验和多元回归分析考察血药浓度等因素与子宫内膜厚度的相关性。结果:异常增生组患者的用药时间、Endoxifen稳态血药浓度均显著长于或高于正常组,差异均有统计学意义(P<0.05);而两组患者年龄,体质量指数,并发症以及TAM、OHT、DMT稳态血药浓度比较,差异均无统计学意义(P>0.05)。患者子宫内膜厚度与Endoxifen稳态血药浓度和用药时间呈正相关性(r分别为0.447、0.460,P<0.05);以子宫内膜厚度(y)为因变量,用药时间(x1)和Endoxifen稳态血药浓度(x2)为自变量,进行多元回归分析,得回归方程为y=2.436+0.123x1+0.082x2(F=12.610,r=0.526,P<0.05)。结论:Endoxifen稳态血药浓度和患者用药时间可能与子宫内膜增生有关,可为临床预测TAM致ER阳性乳腺癌患者子宫内膜异常增生提供参考。
他莫昔芬;代谢产物;血药浓度;子宫内膜增生;用药时间;相关性
乳腺癌是女性最常见的恶性肿瘤,我国每年乳腺癌新发病例约27.3万,发病率逐年递增,乳腺癌城市化已呈显著趋势[1]。约70%的乳腺癌患者为雌激素受体(ER)阳性[2]。最新指南明确指出,ER阳性乳腺癌患者的辅助内分泌治疗应首选他莫昔芬(Tamoxifen,TAM)[3-4]。然而,作为选择性雌激素受体调节药,TAM对子宫内膜组织可产生雌激素激动作用,长期使用可导致子宫内膜增生,诱发息肉和子宫内膜癌[5]。由于TAM是乳腺癌内分泌治疗的标准用药,临床用药时间较长,因此其对子宫内膜的影响应当引起足够重视。有研究表明,TAM的雌激素激动作用和代谢产物的细胞毒性可能是引起子宫内膜损伤的重要因素[6],TAM口服后可迅速转化为具有生物活性的代谢产物,主要包括4-羟基他莫昔芬(4-hydroxytamoxifen,OHT)、Endoxifen和N-去甲基他莫昔芬(N-desmethyltamoxifen,DMT)。本研究从药动学角度出发,探讨TAM及其主要代谢产物血药浓度与子宫内膜增生的相关性,确定导致内膜异常增生的高危因素,以期为临床预测TAM可能导致的子宫内膜异常增生、及时规避不良后果提供科学依据。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)ER检查结果呈阳性;(2)服用TAM治疗半年以上;(3)确诊为绝经后乳腺癌患者。
排除标准:(1)对TAM药物成分过敏或不耐受者;(2)服用TAM期间接受刮宫、左炔诺孕酮、戈舍瑞林缓释植入剂或其他激素类药物治疗者;(3)合并严重肝肾功能不全者;(4)依从性差,不配合本项研究者。
1.2 研究对象
选择2015年3月-2016年4月在我院门诊接受治疗的ER阳性乳腺癌患者69例,年龄43~57岁、平均年龄(50.2±3.8)岁,平均体质量指数(BMI)(24.67±3.47)kg/m2。其中,浸润性导管癌56例,其他类型13例。本研究方案经医院医学伦理委员会审核通过,所有患者均签署了知情同意书。
1.3 治疗方法
所有患者均参照《中国抗癌协会乳腺癌诊治指南与规范(2015版)》[4]服用枸橼酸他莫昔芬片[上海复旦复华药业有限公司,批准文号:国药准字H31021545,规格:10 mg(以他莫昔芬计)],每日2次,每次1片,持续治疗半年以上。
1.4 TAM及其代谢产物血药浓度测定
TAM及其代谢产物(OHT、DMT、Endoxifen)的稳态血药浓度采用本课题组前期建立的高效液相色谱-荧光(HPLC-FLU)法测定[7]:所有患者均空腹抽取静脉血5 mL,于4℃下以离心半径9.2 cm、转速4 000 r/min离心10 min,分离血浆,血浆样品经1 mmol/L氢氧化钠溶液碱化后,用正己烷-正丁醇(98∶2,V/V)5 mL提取;取有机相于40℃水浴中以氮气流吹干,残渣用流动相复溶,以离心半径6.2 cm、转速16 000 r/min离心2 min后,取上清液置于自动进样分析小瓶中,经紫外灯(254 nm)垂直照射10.5 min后,进样分析。色谱柱为Agilent Extend C18(150 mm×4.6 mm,5 μm),流动相为甲醇-1%三乙胺水溶液(82∶18,V/V),流速为1 mL/min,柱温为50℃,激发波长(λex)为260 nm、发射波长(λem)为375 nm,进样量为10 μL。
1.5 子宫内膜厚度测定及分组情况
所有患者均采用阴道超声波检查(Transvaginal ultrasonography,TVS)测定子宫内膜厚度:从纵切面检查子宫内口至宫底内膜轮廓,测量内膜最厚部分即为总的内膜厚度,当内膜被腔内液体分隔开时,分别测定两层厚度后求总和。依据王惠群[8]对绝经后子宫内膜TVS测量值的观察结果,将子宫内膜厚度 5 mm的患者判定为异常增生组,厚度<5 mm的患者归为正常组。
1.6 统计学方法
采用SPSS 21.0软件对数据进行统计分析。计量资料以±s表示,采用两独立样本t检验;计数资料以率表示,采用χ2检验;采用Pearson检验考察各因素与子宫内膜厚度的相关性,同时对影响子宫内膜增生的相关因素进行多元回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基本资料比较
69例受试患者中,正常组患者29例,平均子宫内膜厚度为(4.32±0.51)mm;异常增生组患者40例,平均子宫内膜厚度为(7.43±1.96)mm。两组患者的年龄、BMI、并发症等一般资料比较,差异均无统计学意义(P>0.05)。正常组患者平均用药时间为(13.80±4.92)个月,显著短于异常增生组的(27.53±19.86)个月,差异有统计学意义(P<0.05),详见表1。

表1 两组患者基本资料比较Tab 1 Comparison of general information between 2 groups
2.2 两组患者体内稳态血药浓度比较
方法学考察结果显示,TAM、DMT、OHT和Endoxifen峰形良好,基线平稳,血浆内源性物质不干扰待测物的测定,各待测物线性范围分别为0.5~200 ng/mL(TAM)、0.5~300 ng/mL(DMT)、0.1~10 ng/mL(OHT)、0.5~100 ng/mL(Endoxifen)。该方法精密度、方法回收率、稳定性等均符合生物样品定量分析的基本要求[7]。
69例患者体内TAM、DMT、OHT和Endoxifen血药浓度分别为61.27~120.38、121.33~284.45、2.93~6.86、4.60~51.05 ng/mL。其中,异常增生组患者Endoxifen稳态血药浓度显著高于正常组,差异有统计学意义(P<0.05),但两组患者TAM、DMT、OHT稳态血药浓度比较,差异均无统计学意义(P>0.05),详见表2。
表2 两组患者体内稳态血药浓度比较(±s,ng/mL)Tab 2 Comparison of steady state concentrations between 2 groups(±s,ng/mL)
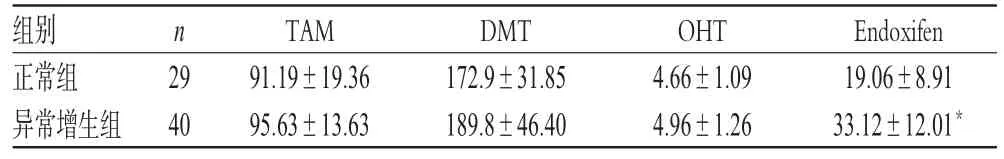
表2 两组患者体内稳态血药浓度比较(±s,ng/mL)Tab 2 Comparison of steady state concentrations between 2 groups(±s,ng/mL)
注:与正常组比较,*P<0.05Note:vs.control group,*P<0.05
Endoxifen 19.06±8.91 33.12±12.01*组别正常组异常增生组n 29 40 TAM 91.19±19.36 95.63±13.63 DMT 172.9±31.85 189.8±46.40 OHT 4.66±1.09 4.96±1.26
2.3 影响子宫内膜厚度相关因素的回归分析
Pearson检验结果显示,患者子宫内膜厚度与其体内Endoxifen稳态血药浓度及用药时间呈正相关(r分别为0.447和0.460,P<0.05)。以子宫内膜厚度(y)为因变量,用药时间(x1)及Endoxifen稳态血药浓度(x2)为自变量,进行多元回归分析,得最佳回归方程为y=2.436+ 0.123x1+0.082x2(F=12.610,r=0.526),具有显著性(P<0.05)。
3 讨论
TAM作为选择性雌激素受体调节药,用于治疗乳腺癌疗效显著,可有效降低乳腺癌患者的复发率和病死率[9]。美国临床肿瘤学会2014年公布的一项临床实践指南更是推荐将ER阳性乳腺癌患者接受TAM治疗的时间由当前的5年延长到10年[3]。然而,由于TAM对子宫和骨骼可产生雌激素激动作用,长期使用可造成子宫内膜增生、引发息肉甚至子宫内膜癌,再加之用药时间长,因此探讨其引发内膜异常增生的高危因素对于临床预测息肉或子宫内膜癌的发生、及时规避不良后果具有重要意义。
为排除绝经前患者子宫内膜厚度生理性波动对检查结果的影响,本研究纳入了绝经后乳腺癌患者。同时,由于左炔诺孕酮可下调雌激素和孕酮受体,抑制子宫内膜细胞增殖,促进内膜萎缩,具有较强的内膜增生拮抗作用[10];戈舍瑞林缓释植入剂可用于治疗子宫内膜异位症,可抑制子宫内膜生长,减少子宫内膜损伤[11]。因此,本研究将联合使用上述药品或在使用TAM期间接受刮宫治疗的患者予以排除,以避免这些治疗对TAM致子宫内膜增生作用的影响。
肥胖、糖尿病、高血压等系子宫内膜癌的危险因素[12],合并以上症状者为“宫体癌综合征”。因此,本研究首先比较了这些危险因素在子宫内膜正常组和异常增生组患者中的发生率。结果显示,两组高血压、糖尿病的患者比例、BMI比较,差异均无统计学意义(P>0.05)。
根据相关研究表明,当服用TAM时间超过48个月时,子宫内膜息肉的发生率明显增加,与未使用TAM治疗的患者相比,服用TAM的患者罹患子宫内膜癌的几率要高出2~3倍,同时此几率会随用药时间的延长而增加[13]。本研究结果表明,子宫内膜异常增生组患者的用药时间显著长于正常组[(27.53±19.86)个月vs.(13.80±4.92)个月,P<0.05],表明用药时间是导致内膜异常增生的高危因素。
TAM口服后可迅速转化为具有生物活性的代谢产物,主要包括OHT、Endoxifen和DMT。DMT对于雌激素受体的结合能力虽略小于TAM,但稳态血药浓度高于TAM本身,且半衰期长(14 d),具有一定的蓄积作用;OHT消除较快,稳态血药浓度低,但与雌激素的结合能力约是TAM的100倍;Endoxifen和雌激素受体结合的能力与OHT相近,但稳态血药浓度高于OHT[14]。当前研究表明,内膜组织含有细胞色素P450(CYP)混合功能氧化酶系(该酶系参与了TAM的体内代谢过程,可将其代谢为OHT、DMT和Endoxifen),TAM的代谢产物在子宫内膜组织中仍然存在,其雌激素激动作用和代谢产物的细胞毒性可能是引起子宫内膜损伤的重要因素[15],但究竟是TAM本身、某种代谢产物还是多种物质共同作用导致子宫内膜增生目前尚未有定论。本研究探讨了TAM及其代谢产物稳态血药浓度与子宫内膜增生的相关性。结果显示,异常增生组患者Endoxifen稳态血药浓度显著高于正常组,差异有统计学意义(P<0.05),而两组患者TAM、DMT、OHT稳态血药浓度比较,差异均无统计学意义(P>0.05)。Schweikart KM等[16]研究发现,Endoxifen具有促进大鼠子宫增生的作用,因此Endoxifen可能是导致内膜异常增生的高危因素之一。
由相关性分析结果可见,Endoxifen稳态血药浓度及用药时间两个高危因素与子宫内膜厚度均存在显著正相关(r>0.9,P<0.05);多元回归分析拟合的最佳回归方程为y=2.436+0.123x1+0.082x2(y为内膜厚度,x1为患者用药时间,x2为Endoxifen稳态血药浓度),提示Endoxifen稳态血药浓度和患者用药时间可为临床预测子宫内膜厚度提供参考,以便及时发现内膜异常增生,规避息肉或子宫内膜癌等不良后果的发生。
综上所述,Endoxifen稳态血药浓度和患者用药时间与子宫内膜厚度呈正相关,两者可为临床预测TAM致子宫内膜异常增生提供参考。但由于本试验样本量较小,研究尚有不足之处,还有待于开展大样本量的前瞻性研究,以便获得更明确的结论以更好地指导临床用药。
[1] 陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.
[2]Oosterkamp HM,Hijmans EM,Brummelkamp TR,et al. USP9X downregulation renders breast cancer cells resistant to tamoxifen[J].Cancer Res,2014,74(14):3810-3820.
[3] Burstein HJ,Temin S,Anderson H,et al.Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer:American society of clinical oncology clinical practice guideline focused update[J].J Clin Oncol,2014,32(21):2255-2269.
[4] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范:2015版[J].中国癌症杂志,2015,25(9):692-754.
[5] Hu R,Hilakivi-Clarke L,Clarke R.Molecular mechanisms of tamoxifen-associated endometrial cancer:review [J].Oncol Lett,2015,9(4):1495-1501.
[6] Potter GA,McCague R,Jarman M.A mechanistic hypothesis for DNA adduct formation by tamoxifen following hepatic oxidative metabolism[J].Carcinogenesis,1994,15(3):439-442.
[7] Zhu YB,Zhang Q,Zou JJ,et al.Optimizing high-performance liquid chromatography method with fluorescence detection for quantification of tamoxifen and two metabolites in human plasma:application to a clinical study[J].J Pharm Biomed Anal,2008,46(2):349-355.
[8] 王慧群.绝经后妇女子宫内膜阴道超声测值观察分析[J].中国伤残医学,2014,22(23):22-23.
[9] Early Breast Cancer Trialists’Collaborative Group(EBCTCG),Davies C,Godwin J,et al.Relevance of breast cancer hormone receptors and other factors to the efficacy ofadjuvant tamoxifen:patient-level meta-analysis of randomised trials[J].Lancet,2011,378(9793):771-784.
[10] 戴黎华,万玉萍,谢春伟,等.左炔诺孕酮宫内缓释系统对乳腺癌患者子宫内膜的保护作用[J].医药导报,2015,34(1):71-73.
[11] 庄惠娜,李林娜,余燕学.醋酸戈舍瑞林缓释植入剂治疗内异症的临床研究[J].临床医学工程,2012,20(1):43-44.
[12] 高婉丽,冯力民,王伟娟,等.绝经后乳腺癌患者服用他莫昔芬发生子宫内膜息肉危险因素的探讨[J].现代妇产科进展,2005,14(4):289-292.
[13] 江布英.他莫昔芬对绝经后乳腺癌患者子宫内膜的影响相关性研究进展[J].现代诊断与治疗,2014,25(7):1529-1531.
[14] Hennig EE,Piatkowska M,Karczmarski J,et al.Limited predictive value of achieving beneficial plasma(Z)-endoxifen threshold level by CYP2D6 genotyping in tamoxifen-treated Polish women with breast cancer[J].BMC Cancer,2015,doi:10.1186/S12885-015-1575-4.
[15] Rizkalla HF,Higgins M,Kelehan P,et al.Pathological findings associated with the presence of a mirena intrauterine system at hysterectomy[J].Int J Gynecol Pathol,2008,27(1):74-78.
[16] Schweikart KM,Eldridge SR,Safgren SL,et al.Comparative uterotrophic effects of endoxifen and tamoxifen in ovariectomized Sprague-Dawley rats[J].Toxicol Pathol,2014,42(8):1188-1196.
Study on Correlation of Blood Concentrations of Tamoxifen and Its Metabolites with Endometrial Hyperplasia in ER-positive Breast Cancer Patients
ZHU Yubing,ZHAO Zheng,LIU Yunxin(Dept.of Pharmacy,the Affiliated Nanjing Hospital of Nanjing Medical University/Nanjing First Hospital,Nanjing 210006,China)
OBJECTIVE:To investigate the correlation of blood concentrations of tamoxifen(TAM)and its metabolites with endometrial hyperplasia in estrogen receptor(ER)-positive breast cancer patients.METHODS:A total of 69 patients with ER-positive breast cancer selected from our hospital during Mar.2015-Apr.2016
TAM(twice a day,one tablet each time)for more than 6 months.According to endometrial thickness,they were divided into abnormal hyperplasia group(40 cases)and normal group(29 cases).The steady state concentrations of TAM and its metabolites[4-OH-tamoxifen(OHT),N-demethylation tamoxifen(DMT),Endoxifen]were determined by HPLC-FLU.The correlation of blood concentration and other factors with endometrial thickness were investigated by Pearson test and multiple regression analysis.RESULTS:The medication time and Endoxifen steady state concentration in abnormal hyperplasia group were both significantly longer or higher than normal group,with statistical significance(P<0.05).There was no statistical significance in age,BMI,complication and steady state concentrations of TAM,OHT and DMT between 2 groups(P>0.05).The endometrial thickness was positively correlated with Endoxifen steady state concentration and medication time(r=0.447,0.460,P<0.05).Using endometrial thickness(y)as dependent variable,medication time(x1)and Endoxifen steady state concentration(x2)as independent variable,multiple regression analysis was conducted.Multiple regression equation was calculated as follows:y=2.436+0.123x1+0.082x2(F=12.610,r=0.526,P<0.05).CONCLUSIONS:Medication time and Endoxifen steady state concentration may be related to endometrial hyperplasia,which can provide reference for predicting TAM induced endometrial abnormal hyperplasia in ER-positive breast cancer patients.
Tamoxifen;Metabolites;Blood concentration;Endometrial hyperplasia;Medication time;Correlation
R711.74;R969.1
A
1001-0408(2017)20-2768-04
2016-08-23
2017-05-17)
(编辑:张元媛)
江苏省药学会奥赛康临床药学立项课题(No.201209)
*副主任药师,硕士。研究方向:临床药理学、医院药学。电话:025-86862684。E-mail:zyb86052002@163.com
DOI10.6039/j.issn.1001-0408.2017.20.09
