核桃酶解提取物对大鼠记忆力的影响
2017-08-22赵宏艳潘静华李岳泽鞠大宏刘梅洁
梁 明,张 婷,郑 侠,赵宏艳,潘静华,李岳泽,鞠大宏,刘梅洁 △
(1. 无限极(中国)有限公司,广州 510665; 2. 中国中医科学院中医基础理论研究所,北京 100700;3. 中国中医科学院医学实验中心,北京 100700)
【实验研究】
核桃酶解提取物对大鼠记忆力的影响
梁 明1,张 婷1,郑 侠1,赵宏艳2,3,潘静华2,3,李岳泽2,鞠大宏2,3,刘梅洁2,3△
(1. 无限极(中国)有限公司,广州 510665; 2. 中国中医科学院中医基础理论研究所,北京 100700;3. 中国中医科学院医学实验中心,北京 100700)
目的:探讨核桃酶解提取物对老年大鼠记忆力衰退的作用及其机理。方法:将15月龄SD雌性大鼠按随机数字表法分为LN组、 LN-HTMJ低、高剂量组3组各10只。LN-HTMJ低、高剂量组分别灌胃给予 0.071 g/kg体质量和0.142 g/kg体质量的核桃酶解提取物。共给药6个月。在给药结束前1个月选用16只2月龄SD雌性大鼠作为QN组,在大鼠处死前9 d进行八臂迷宫实验。给药结束后,取大鼠的外周血浆和血清、左侧大脑以及剥离右侧大脑皮层和海马,用于各项指标检测。结果:核桃酶解提取物(0.142 g/kg体质量)能明显延缓21月龄老年大鼠的记忆力衰退。与青年大鼠比较,老年大鼠海马中尼氏体减少、AchE水平增高以及大脑皮质中DA、NE含量降低,同时其外周血浆中ACTH和血清中CORT含量增加,而核桃酶解提取物能在一定程度上使上述指标发生逆转。结论:核桃酶解提取物对老年大鼠的记忆力衰退具有明显的延缓作用,能提高老年大鼠大脑皮质中DA、NE含量而降低海马中AchE水平以及外周血中ACTH和CORT含量,是其作用机理之一。
核桃酶解提取物;老年大鼠;记忆衰退
1 材料与方法
1.1 材料
1.1.1 实验动物 采用SPF级SD雌性老年大鼠30只,15月龄,体质量(433±60) g;采用SPF级SD青年雌性大鼠8只,2月龄,体质量(210±6) g,均由中国人民解放军军事医学科学院实验动物中心提供(许可证号SCXK-(军)2012-0004)。饲养于中国中医科学院中医基础理论研究所清洁级实验动物室(实验动物使用许可证号SYXK-(京)2010-0032)。
1.1.2 药品 核桃酶解提取物由无限极(中国)有限公司提供(批号为2014-08-21)。临用前,用纯净水将核桃酶解提取物分别配制成浓度为0.0071 g/ml和0.0142 g/ml的溶液。
1.1.3 主要试剂 甲苯胺蓝染色液(批号0513A15)为北京雷根生物技术有限公司产品。大鼠多巴胺(DA)ELISA试剂盒(批号15102703)、大鼠乙酰胆碱酯酶(AchE)ELISA试剂盒(批号15102702)、大鼠去甲肾上腺素(NE)ELISA试剂盒(批号15102704)、大鼠促肾上腺皮质激素(ACTH)ELISA试剂盒(批号15102304),均为北京科盈美科技有限公司产品。
1.1.4 主要仪器 ZS-3000八臂迷宫分析系统:中国北京众实迪创科技发展有限责任公司;Multiskan Mk3酶标仪:美国Thermo公司;Tissue-Tek TECTM组织包埋机、Tissue-Tek IVS-410 切片机:日本樱花公司;DM 6000B正置显微镜、Qwin Pro V3.5.0图像分析系统:德国,Leica公司。
1.2 方法
1.2.1 动物分组及处理 采用Excel软件,按照随机数字表法将老年大鼠随机分为老年组(LN组)、老年核桃酶解低剂量组(LN-HTMJ低剂量组)和老年核桃酶解高剂量组(LN-HTMJ高剂量组)3组各10只,然后各给药组开始灌胃给药。LN-HTMJ低剂量组和高剂量组分别灌胃给予浓度0.0071 g/ml、0.0142 g/ml的核桃酶解提取物溶液,给药体积均为10 ml/kg体质量,给药剂量分别为 0.071 g/kg体质量和0.142 g/kg体质量。以上给药每日1次,连续6 d,休息1 d后,再连续给药6 d,如此给药6个月。LN组按同法灌胃给予等体积的纯净水。在给药结束前1个月,选取8只青年大鼠作为青年组(QN组)。QN组按上述方法也灌胃给予等体积的纯净水。每周大鼠称重1次,据此调整给药量。在大鼠处死前9 d,进行八臂迷宫实验,以检测各组大鼠的记忆能力。在给药过程中,大鼠LN组和LN-HTMJ低剂量组各死亡2只, LN-HTMJ高剂量组死亡1只。
在末次给药1.5 h后,将各组大鼠以45 mg/kg 体质量剂量的戊巴比妥钠腹腔注射麻醉。沿腹中线打开腹腔,腹主动脉取血,一部分放入促凝管中静置2 h,3000 r/min离心15 min取血清;另一部分放入抗凝管(事先进行预冷处理,K2-EDTA 抗凝)中,用冷冻离心机离心3000 r/min,离心15 min取血浆,然后将血清、血浆放入-80℃冰箱中保存待测。将大鼠处死取大鼠全脑,于冰上迅速分离右侧大脑皮层和海马,称重后放入EP管中,置于液氮中保存待测。取左侧大脑放入福尔马林中固定。
1.2.2 指标检测 大鼠记忆力的检测:参照文献[1]和[2]的方法,采用八臂迷宫实验对各组大鼠的记忆力进行检测。在训练完后第1天开始检测,每次1只。大鼠进入有食饵的臂,且摄取了食饵为一次正确选择,否则为错误选择,记录参数为错误选择的次数。错误选择的次数分为参考记忆错误(Reference memory error,RME)、工作记忆错误(Working memory error,WME)和总记忆错误(Total error,TE)。RME:大鼠进入不放食物臂的次数;WME:大鼠重新进入放食物臂或第一次进入放食物臂而不摄取食物的次数;TE:WME与RME之和。
在每天训练以及检测完后,对各给药组大鼠灌胃给予相应的药物(给药浓度及体积同1.2.1),QN组、LN组则灌胃给予等体积的纯净水。
海马尼氏体积分光密度(IOD)的检测:将固定后的左侧大脑组织在视交叉后2 mm处行冠状切开,取其后3 mm厚的脑组织,梯度乙醇脱水,二甲苯透明,石蜡包埋,用切片机进行冠状切片,厚度5 μm;尼氏(Nissel)染色(甲苯胺蓝法),光学树脂封片。
在20倍物镜下,沿海马CA1区、CA2区、CA3区、DG区的顺序,取5个连续不重叠视野,采用Qwin Pro V3.5.0图像分析系统,检测每个视野内的尼氏体IOD,取其平均值。
大脑皮质中DA、NE以及海马中AchE水平的检测:将大脑皮质和海马分别用预冷的PBS(pH 7.2)于冰浴下快速匀浆静置10 min,14000×g低温离心20 min,取上清液-80℃保存待测。
检测前,从冰箱中取出冻存的上清液室温下复温。采用ELISA法,按照试剂盒所附说明书,用酶标仪分别检测大鼠大脑皮质中DA、NE含量以及海马中AchE的水平。
外周血浆中ACTH和血清中CORT含量的检测:检测前,从冰箱中取出冻存的大鼠血浆、血清室温下复温。采用ELISA法,按照试剂盒所附说明书,用酶标仪检测外周血浆中ACTH和血清中CORT的含量。

2 结果
2.1 核桃酶解提取物对老年大鼠记忆力影响
表1显示,迷宫实验结果显示,与QN组比较LN组以及各给药组大鼠的RME、WME和TE均明显增多。与LN组比较,LN-HTMJ高剂量组的RME、WME和TE均明显减少,而LN-HTMJ低剂量组的3个指标比较差异无统计学意义。

表1 各组老年大鼠RME、WME和TE的变化
注:与QN组比较:*P<0.05,**P<0.01;与LN组比较:△P<0.05,△△P<0.01;LN-HTMJ高剂量组与其低剂量组比较:#P<0.05,##P<0.01(下同)
2.2 核桃酶解提取物对老年大鼠海马尼氏体IOD以及海马中AchE水平的影响
2.2.1 核桃酶解提取物对老年大鼠海马尼氏体IOD的影响 表2图a-图f显示,LN组以及各给药组大鼠海马尼氏体IOD皆显著低于QN组。LN-HTMJ高剂量组的海马尼氏体IOD皆明显高于LN组;LN-HTMJ低剂量组的海马尼氏体IOD与LN组比较差异无统计学意义。

表2 各组老年大鼠海马尼氏体IOD的变化

图a-f分别为QN组、LN组、LN-NLT低剂量组、LN-NLT高剂量组、LN-HTMJ低剂量组和LN-HTMJ高剂量组大鼠的海马组织。甲苯胺蓝染色(×20)
2.2.2 核桃酶解提取物对老年大鼠海马AchE水平的影响 图1显示,LN组以及各给药组大鼠海马中AchE水平与QN组比较均明显增高。LN-HTMJ高剂量组与LN组比较,AchE水平皆明显降低,而与LN-HTMJ低剂量组比较差异无统计学意义。
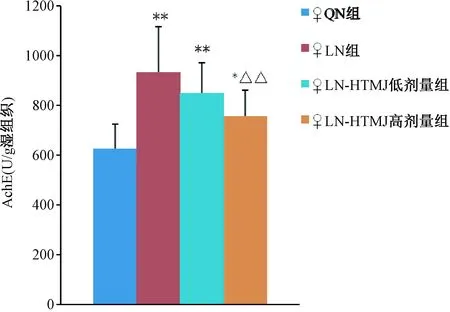
图1 各组雌性老年大鼠海马AchE水平的变化
2.3 核桃酶解提取物对老年大鼠大脑皮质DA和NE含量的影响
图2显示,LN组以及各给药组大鼠大脑皮质中DA和NE含量皆明显降低于QN组。LN-HTMJ高剂量组DA和NE含量皆明显高于LN组,而LN-HTMJ低剂量组DA和NE含量与LN组比较差异无统计学意义。

图2 各组雌性老年大鼠大脑皮质DA和NE含量的变化
2.4 核桃酶解提取物对老年大鼠外周血浆中ACTH和血清CORT含量的影响
图3、4显示,LN组以及各给药组大鼠外周血浆中ACTH和血清中CORT含量均明显高于QN组。LN-HTMJ高剂量组ACTH和CORT含量与LN组比较均明显降低,而LN-HTMJ低剂量组与之比较差异无统计学意义。

图3 各组雌性老年大鼠外周血浆中ACTH含量的变化

图4 各组雌性老年大鼠外周血清中CORT含量的变化
3 讨论
随着年龄的增长,机体的不断老化,其学习记忆能力也逐渐下降。本研究迷宫实验结果显示, LN组大鼠的RME、WME和TE与QN组比较均明显增多。参考记忆(Reference memory,RM)代表长期记忆,工作记忆(Working memory,WM)代表短期记忆[1]。这一结果表明,老年大鼠(SD21月龄)无论是长期记忆能力,还是短期记忆能力均较青年大鼠(SD3月龄)显著降低。给药6个月后,迷宫实验结果显示,LN-HTMJ高剂量组大鼠的RME、WME和TE均明显少于LN组。以上结果表明,核桃酶解提取物对老年大鼠的记忆力衰退具有明显的延缓作用。
大鼠边缘系统-海马是参与哺乳动物学习记忆的主要脑区之一,若各种原因导致其内神经元密度降低、或脱失、或变性坏死等,皆可造成学习记忆能力衰退或障碍。尼氏体是由神经元胞质内发达的粗面内质网和分布其间的游离核糖体构成,是神经元的特征性结构之一,具有活跃的蛋白质合成功能,主要合成更新细胞器所需的结构蛋白、合成神经递质所需的酶类以及肽类的神经调质[3],它是反映神经元功能活性的形态指标。海马中尼氏体的多少能反映学习记忆能力的变化情况,有研究显示,在大鼠海马神经元胞体中的尼氏体含量明显减少的同时,其记忆能力下降[4]。本实验结果显示,LN组大鼠海马中尼氏体IOD与QN组比较显著下降;LN-HTMJ高剂量组海马中尼氏体IOD与LN组比较均显著增加。这一结果表明,大鼠长到老年,其海马中尼氏体明显减少;而核桃酶解提取物能明显延缓它的减少。乙酰胆碱(Ach)是中枢胆碱能系统中重要的神经递质,在学习记忆中起着非常重要的作用,海马组织中的Ach更是如此。当大脑内Ach水平提高时,记忆能力则会增加[5],Ach与AchE的活性呈负相关[6]。因为Ach性质不稳定,容易水解,直接准确检测其含量难度较大,所以通过检测AchE以间接地反映Ach的水平[7]。本实验结果显示,LN组大鼠海马中AchE水平皆显著高于QN组,而LN-HTMJ高剂量组的AchE水平皆明显低于LN组。这一结果表明,老年大鼠海马中的AchE水平较青年大鼠显著增高,而核桃酶解提取物能使其降低;由此也说明,老年大鼠海马中的Ach水平显著低于青年大鼠,而核桃酶解提取物具有提高其水平的作用。
大脑皮质是参与哺乳动物学习记忆的另一个主要脑区,其中的单胺类神经递质在这一过程发挥着非常重要的作用。业已证实,NE在记忆保持方面起重要作用,而改善记忆与DA密切相关[8],它们含量的降低是导致学习记忆能力衰退的主要原因之一[9]。本实验结果显示: LN组大鼠大脑皮质中DA和NE含量较QN组显著降低,从而进一步验证了这一点。与LN组比较,LN-HTMJ高剂量组大鼠大脑皮质中DA和NE含量皆明显增高。这一结果表明,核桃酶解提取物能够提高老年大鼠大脑皮质中的NE和DA含量,由此达到延缓其记忆力衰退的作用。
下丘脑-垂体-肾上腺(HPA)轴在机体衰老过程中起重要作用。业已证实,该轴功能紊乱与衰老关系密切。如有研究表明,老年人基础皮质醇水平升高[10],降低垂体激素的分泌,可延长实验动物的寿命;老年大鼠外周血中CORT水平增高[11]。海马对HPA轴的活性具有抑制作用[12]。有研究显示,随着大鼠衰老,脑内神经递质代谢发生紊乱,海马呈稳态下降,进而使其对HPA轴的抑制作用减弱,导致HPA轴功能亢进[13]。海马存在高密度糖皮质激素受体,是糖皮质激素(GC)作用的敏感部位;长期高水平的GC会对海马区域神经元产生损伤[12-14],所以衰老机体GC的长期增高会进一步损害海马,因此也就进一步减弱了其对HPA轴的抑制作用,由此导致HPA轴的进行性和持久性亢进,形成GC损伤的放大效应[13]。继而进一步导致学习记忆能力衰退,也就是为什么老年人出现皮质醇和老年大鼠出现CORT含量增加的原因所在。本实验结果显示:LN组大鼠外周血浆中ACTH和血清中CORT含量均显著高于QN组;与LN组比较, LN-HTMJ高剂量组的ACTH和CORT含量均明显降低。这一结果表明,21月龄SD大鼠HPA轴出现了明显的功能亢进,而核桃酶解提取物能使其外周血浆中ACTH和血清中CORT含量降低,表现出两者对衰老所致HPA轴功能亢进具有一定的对抗作用。
中医认为心藏神,主神志,目前公认,心的这一生理功能当属于脑,即中医的心包含有脑的功能。正如清·王清任所言“灵机记性在脑”。本实验研究显示,老年大鼠在记忆力衰退的同时,其海马中尼氏体减少、AchE水平增高以及大脑皮质中DA、NE含量降低,表明海马以及上述神经递质是“心主神志”的物质基础,它们发生异常改变是“心主神志”功能减退的原因之一。而核桃酶解提取物能使上述指标在一定程度上发生逆转,说明它们能通过对“心”的调节而达到延缓记忆力衰退的作用。中医的“肾”在维持记忆功能的过程中也起着重要的作用,这是因为肾藏精、精生髓而脑为髓之海有赖髓之滋养。肾精充实则髓之化生充沛,脑得其充分滋养,灵机记忆则强;若肾精亏虚则髓之化生缺乏,脑失其充分滋养,灵机记忆则弱。随着年龄的增长,肾中精气也随之由盛转衰,学习记忆也就逐渐衰退,因此“肾虚”在衰老过程中起着非常重要的作用。本实验结果说明,21月龄SD老年大鼠记忆力明显衰退,呈现出“肾虚”状态。长期研究表明,中医的“肾”与现代医学的“神经内分泌系统功能”密切相关,这其中尤与“中枢神经递质-HPA轴功能”关系密切,其功能发生紊乱是“肾虚证”的表现形式之一。本实验结果显示,与青年大鼠比较,老年大鼠海马中尼氏体减少、AchE水平增高以及大脑皮质中DA、NE含量降低;与此同时,老年大鼠外周血浆中ACTH和血清中CORT含量增加,而核桃酶解提取物能在一定程度上使上述指标发生逆转。这表明老年大鼠中枢神经递质-HPA轴功能发生了紊乱,并由此进一步证明老年“肾虚证”与中枢神经递质-HPA轴功能紊乱密切相关;而核桃酶解提取物能通过“补肾”,使老年肾虚大鼠紊乱的中枢神经递质-HPA轴功能得到一定程度的恢复,进而达到延缓记忆力衰退的作用。
由上观之,“心”与“肾”密切相关,海马以及大脑皮质中的DA、NE等神经递质是两者联系的纽带;并提示核桃酶解提取物可通过“调补心肾”达到延缓记忆力衰退的作用。
[1] 吴俊芳,刘忞.现代神经科学研究方法[M].北京:中国协和医科大学出版社,2006:698-700.
[2] 乔之龙,郭蕾,李菲.补肾益智汤对老年痴呆模型大鼠中枢神经递质的影响[J].中华中医药学刊,2009,27(12):2565-2568.
[3] 邹仲之,李继承.组织学与胚胎学[M].8版.北京:人民卫生出版社,2014:61.
[4] 刘肖,左红艳,王德文,等.极低频电磁场曝露对大鼠认知功能和海马形态结构的影响[J].高电压技术,2013,39(1):156-162.
[5] GONG Y,LIU L,XIE B,et al. Ameliorative effects of lotus seedpod proanthocyanidins on cognitive deficits and oxidative damage in senescence-accelerated mice[J]. Behav Brain Res, 2008, 194(1) : 100-107.
[6] 李利平,王全胜,武变瑛,等.高纯度银杏黄酮对衰老小鼠学习记忆功能的影响[J].中国临床康复,2005,9(44):97-99.
[7] 张泰鹏,莫雪安,刘金萍,等.甘露醇对骨髓间充质干细胞治疗血管性痴呆大鼠行为学及海马胆碱能系统的影响[J].中风与神经疾病杂志,2011,28(4):317-320.
[8] NOWAKOWSKA E, CHODERA A, KUS K, et al. Reversal of stress-induced memory changes by moclobemide: the role of neurotransmitters[J]. Pol J Pharmacology, 2001, 53(3): 227-233.
[9] DE LA FUENTE M, HERNANZ A, MEDINA S, et al. Characterization of monoamine systems in brain regions of prematurely ageing mice[J]. Neurochemistry Int, 2003, 43(2): 165-172.
[10] SEEMAN TE. Gender differences in age-related changes in HPA axis reactivity[J]. Psychoneuroendocrinology,2001, 26(3):225-240.
[11] MOBBS CV. Not wisely but too well: aging as a cost of neuroendocrine activity[J]. Sci Aging Knowledge Environ, 2004(35): 33-39.
[12] 姚建平,金国琴.神经内分泌免疫网络的老龄化变化及调控[J].国外医学:老年医学分册,2004,25(4):160-166.
[13] 金国琴,戴薇薇,张学礼,等.大鼠大脑边缘系统-下丘脑-垂体-肾上腺皮质轴和胸腺依赖性免疫功能的老年性变化及补肾方药的作用[C].上海:华东六省一市生物化学与分子生物学会2003年学术交流会论文集,2003:34-35
[14] 顾翠英,金国琴,赵新永,等.皮质酮损伤大鼠海马神经细胞病理模型的建立及补肾方药的作用[J].中药药理与临床,2010,26(2):10-12.
梁 明(1978 -),女,湖北人,生药学硕士,从事中药学的研究。
△通讯作者:刘梅洁(1981-),女,河南南阳人,医学博士,Tel:010-64089528,E-mail:meimei64571@sina.com。
R285.5
B
1006-3250(2017)05-0638-04
2016-11-15
