临床病理讨论:胰腺多发囊肿,间断腹部不适
2017-08-21高鹤丽金凯舟汪晓红陈治宇卢仁泉虞先濬
高鹤丽 金凯舟 汪晓红 陈治宇 卢仁泉 黄 丹 虞先濬△
(复旦大学附属肿瘤医院-复旦大学上海医学院肿瘤学系,1胰腺外科,2放射诊断科,3肿瘤内科,4检验科,5病理科 上海 200032)
临床病理讨论:胰腺多发囊肿,间断腹部不适
高鹤丽1金凯舟1汪晓红2陈治宇3卢仁泉4黄 丹5虞先濬1△
(复旦大学附属肿瘤医院-复旦大学上海医学院肿瘤学系,1胰腺外科,2放射诊断科,3肿瘤内科,4检验科,5病理科 上海 200032)
病史摘要
入院病史 患者女性,60岁。因“发现胰腺多发囊肿5年,间断腹部不适5个月”于2016年9月就诊于复旦大学附属肿瘤医院。患者2010年外院体检查肿瘤标志物AFP、CEA、CA199、CA125、CA724(-),腹部CT提示胰腺多发囊肿(图1A),双肾多发囊肿。患者无腹痛腹胀、腹泻黑便、腰背痛、尿频尿急、下肢肿胀等症状。未治疗,每年定期随访腹部病灶无变化。2015年于当地医院复查肿瘤标志物AFP、CEA、CA199、CA125、CA724(-),PET/CT示胰腺钩突旁肿瘤(SUVmax4.6),多囊胰腺,双肾多发囊肿。与患者解释后建议继续随访。2016年4月患者出现无诱因间断腹部不适感,伴腰背部酸痛,与进食、活动无关,无腹胀腹泻、呕血黑便等。当地医院复查肿瘤标志物CA199:40.68 U/mL;MRI示多囊胰腺,胰腺钩突富血供结节(图1B)。PET/CT示胰腺多发囊肿伴钙化,腹膜后、胰腺钩突下方占位(SUVmax 6.7),双肾多发囊肿。超声胃镜下细针穿刺病理:少数腺上皮,部分退变细胞,未见肯定恶性。现为进一步诊治收入我院。起病以来,患者精神睡眠可,二便无殊,体重无明显改变。
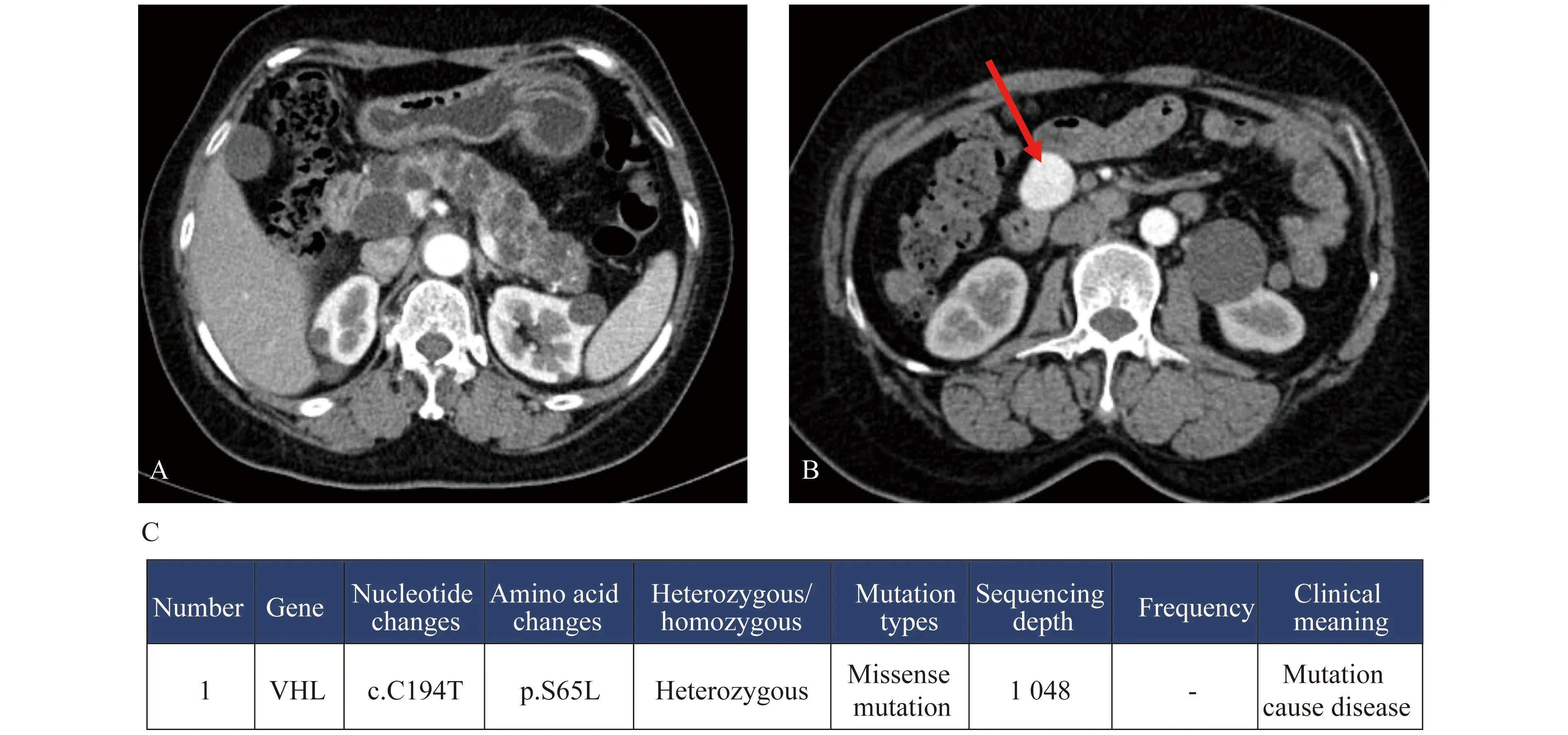
图1 胰腺多发囊肿(A),胰腺钩突下强化结节(B,箭头所示)及VHL基因检测结果(C)
既往史 1997年行小脑血管母细胞瘤切除术。
家族史 女儿2005年行小脑血管母细胞瘤切除术。
体格检查 生命体征平稳,全身淋巴结无肿大,双肺呼吸音清,心律齐,各瓣膜区无杂音,腹软,腹部未及包块,全腹无压痛、反跳痛、肌紧张。肝、脾、双肾区无叩痛,肝脾肋下未及,双下肢无水肿。
辅助检查 血常规、肝肾全、血淀粉酶(-),肿瘤标志物CA199:43.44 U/mL,CA242:23.79 U/mL,AFP,CEA,CA125,CA724,NSE(-) 。腹部CT:全胰腺多发囊性占位,另见胰腺钩突下方富血供占位(2.5 cm×2.8 cm),考虑神经内分泌肿瘤可能。生长抑素受体显象:胰头下方结节,放射性浓聚,生长抑素受体高表达。
入院诊断Von Hippel-Lindau 综合征(VHL综合征) 入院后外送基因检测:VHL错义突变,p.S65L (图1C)。再次行超声内镜(endoscopic ultrasonopraphy,EUS),示全胰探及弥漫性无回声结构,部分融合,呈蜂窝样改变,无法探查主胰管与无回声病变的关系。十二指肠降段与胰腺钩突之间探及一椭圆性团块影,边界清,包膜完整,大小2.5 cm×2.8 cm,血流信号极丰富,考虑神经内分泌肿瘤可能,胰腺多囊性病变;EUS细针穿刺(fine-needle aspiration,FNA)术,穿刺病理:符合神经内分泌瘤,Ki-67:2%,AE1/AE3(+),CgA(+),Syn(+)。经多学科讨论,予口服舒尼替尼。
临床与病理讨论
陈治宇副主任医师(肿瘤内科) VHL综合征是一种较常见的常染色体显性遗传性肿瘤综合征,主要受累的器官为视网膜、脑干、小脑或脊髓的血管母细胞瘤,肾多发囊肿、胰腺囊肿。根据受累器官不同将VHL分为3种类型:I型为视网膜/中枢神经系统血管母细胞瘤、肾囊肿和胰腺囊肿,无嗜铬细胞瘤; II型为视网膜/中枢神经系统血管母细胞瘤、嗜铬细胞瘤和胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor,pNET),无胰腺囊肿及肾囊肿; III型为视网膜/中枢神经系统血管母细胞瘤、嗜铬细胞瘤、胰腺肿瘤。因此VHL综合征的诊断标准为:(1)有VHL家族史加任一VHL相关肿瘤,如视网膜或小脑血管母细胞瘤、肾细胞癌等;(2)无VHL家族史者,诊断需要两个以上视网膜或小脑血管母细胞瘤,或一个血管母细胞瘤合并内脏肿瘤(除外附睾囊肿和肾囊肿)[1]。患者为非特异性临床表现,无明显阳性体征,体检发现胰腺、双肾多发囊肿5年,结合既往小脑血管母细胞瘤切除术史,及女儿患小脑血管母细胞瘤的家族史,考虑患者临床诊断为VHL综合征。并且通过基因检测进一步证实了含有VHL突变,故VHL综合征诊断明确。建议患者补充眼底检查,是否合并视网膜血管母细胞瘤。VHL综合征易合并其他腹腔脏器肿瘤,常见的有嗜铬细胞瘤、肾细胞癌、pNET等。该患者半年前发现胰腺钩突占位,我院病理活检证实为NET。VHL相关的pNET异质性大,总体而言较散发pNET恶性程度低,但也需要治疗和密切监测。当pNET直径>3 cm或肿瘤生长迅速时,手术切除是首选治疗手段;不接受手术的患者需要密切随访、定期复查CT或MRI检查,也可选择药物治疗,如生长抑素类似物舒尼替尼,依维莫司等[2]。
汪晓红副主任医师(放射科) 随着pNET的发病率逐年升高[3]。临床需要提高对此病的认识,从影像学来讲,pNET的典型CT表现为富血供征象,即动脉期病灶多明显强化,强化程度高于正常胰腺,门脉期强化程度与胰腺相近;CT检查提示病灶边界较清且呈富血供的胰腺肿物要考虑到pNET可能。当pNET体积较大时,可出现囊变、出血、坏死、钙化等表现。同时,核医学科的检查也有助于区分pNET,pNET在Ga68-PET/CT及生长抑素受体显象(somatostatin receptor scintigraphy,SRS)中多表现为代谢异常摄取增高。该患者在我院的胰腺增强CT示胰腺内见弥漫多发大小不等囊性结节影,边界尚清,强化不明显,胰管全程扩张,胰腺实质萎缩,胰尾部见多发钙化结节影,胰头下方富血供占位,边界清晰,可见明显均匀强化,符合神经内分泌肿瘤可能。此外,患者SRS提示胰头钩突下方结节为生长抑素受体高表达,更加支持神经内分泌肿瘤的诊断。除pNET外,胰腺囊性病变和实性结节还需考虑如下鉴别诊断:(1)浆液性囊腺瘤,是VHL常见的胰腺病变。CT表现为成簇的葡萄串样、蜂窝状微囊,边界清楚的分叶状囊实性肿物,囊腔直径多小于2 cm,囊壁较薄,中心可见星状瘢痕,增强时囊壁、实性部分和纤维间隔可强化。(2) 黏液性囊腺瘤,多位于胰尾,单发,黏稠黏液,囊壁较厚,有壁结节,钙化或分隔。(3)实性假乳头状瘤,青年女性多见,CT呈囊实性肿物,有包膜,早期强化明显,较少引起胆胰管扩张,其内密度不均,可有出血(造成囊液信号密度的相应变化)、坏死和钙化。(4)导管内乳头状黏液肿瘤(intraductal papillary mucinous neoplasm,IPMN)不是VHL相关胰腺肿瘤,但在影像学提示胰腺囊性病变时需警惕此病可能。IPMN起源于导管,乳头状生长,产生大量黏液导致胰管扩张,囊呈葡萄样,边界清楚,可有壁结节,钙化少见。判断主要通过主胰管和囊性病变是否相通,胰管是否扩张。(5) 副神经节瘤,副神经节瘤与嗜铬细胞瘤属同一类肿瘤,位于肾上腺髓质的称为嗜铬细胞瘤,位于肾上腺外的称为副神经节瘤。嗜铬细胞瘤是VHL综合征的特征表现之一,但副神经节瘤在VHL中并不多见。CT表现为边界清,强化明显的实性或囊性,有坏死或囊变时密度不均。总体来说,pNET由于临床少见,CT表现缺乏特异性,难与其他胰腺肿瘤鉴别,还需要病理明确。
黄丹副主任医师(病理科) 对于VHL综合征而言,2/3的VHL患者合并胰腺病变。最常见的胰腺肿瘤主要有无症状性囊肿(30%~91%),浆液性囊腺瘤(10%~12%),多发高分化无功能性pNET (5%~17%)[4]。其中胰腺囊肿是VHL综合征最常见的胰腺类型,平均发生率47% (7%~72%),且多发囊肿比单发囊肿更常见。腺胰囊肿是良性病变,基本不需要干预。VHL综合征的胰腺实性占位多为pNET,平均发生率15% (9%~17%),且通常是非功能性的。此外,超过50%的VHL相关pNET是胰腺多发的[5]。有的pNET呈囊性表现,但目前没有报道在VHL相关pNET中有囊性pNET或混合性腺神经内分泌瘤。在鉴别诊断中需要强调的是实性微囊性浆液性腺瘤有时在影像上难以与pNET区分,但两者的治疗方案是不同的,具体明确诊断还需要根据病理结果。该患者的病理符合神经内分泌瘤的表现,故VHL相关的pNET诊断明确。嗜铬细胞瘤/副神经节瘤是VHL综合征常见的肿瘤,均起源于神经嵴,与胰腺无关。部分肿瘤分泌儿茶酚胺等激素造成内分泌症状,如高血压、心悸、多汗等。病理学特征为肿瘤呈器官样结构排列,免疫组织化学染色有肿瘤细胞血清嗜铬粒蛋白A (chromogranin,CgA),神经元特异性烯醇化酶(neuron-specific enolase,NSE),Syn阳性,支持细胞S-100阳性。此患者超声内镜明确结节与胰腺关系密切,故不考虑为副神经节瘤。EUS-FNA是胰腺肿瘤病理学诊断的常用检查手段,其创伤性小,但细针穿刺所取的组织样本少,可能有漏诊等局限性,需要多点穿刺,取得足够多的样本量,才能完善诊断。此患者共行2次EUS-FNA,第一次EUS-FNA结果未见恶性证据,在我院再次行EUS-FNA,第二次穿刺找到了典型的神经内分泌瘤细胞,明确了病理诊断。
卢仁泉副主任技师(检验科) VHL综合征是由VHL基因的突变引起。VHL基因是一个抑癌基因,位于3号染色体短臂(3p25-26)。其发病可以用“二次打击”学说解释,即遗传单个VHL等位基因突变的个体,当出现第二个VHL拷贝丢失或失活时可造成肿瘤发生。VHL体细胞突变与很多散发性癌症的发生发展相关,如几乎所有肾透明细胞癌、约40%散发性中枢神经系统血管母细胞瘤和10%散发性嗜铬细胞瘤[6]。VHL基因编码的蛋白参与负性调节低氧诱导的血管内皮生长因子(vascular endothelial growth factor,VEGF) mRNA表达。VHL基因突变可造成其编码蛋白的功能丧失,使VEGF表达升高,从而导致富含血管的血管母细胞瘤的发生。根据临床检查结果及基因检测提示VHL突变,此患者的VHL综合征诊断明确。对患者及家族中可能患此病的家属有条件者可再次进行VHL基因检测。此外,常见的肿瘤标志物,如癌胚抗原(CEA),糖链抗原(CA)系列等在NET中升高的比例并不多,NSE及CgA对pNET的监测意义更大,我科目前已开展CgA的科研项目检测。该患者胰腺钩突占位经过病理明确为胰腺神经内分泌肿瘤,患者目前有CA199升高,NSE正常,可加做CgA检测,同时在后续随访过程中定期复查CA199,CgA等,用作疗效评估及影像学检查的辅助监测复发指标。
虞先濬主任医师(胰腺外科) 患者曾患有小脑血管母细胞瘤、胰腺囊肿、肾囊肿及阳性家族史,临床诊断VHL综合征成立。同时进一步VHL基因检测在分子学水平明确了VHL综合征的诊断。VHL综合征患者平均寿命为49岁,其主要死亡原因是中枢神经系统血管母细胞瘤破裂出血(60%~80%)和肾细胞癌(24%~45%)[7],其他的如嗜铬细胞瘤引起的恶性高血压也是死亡原因之一。现患者已行小脑血管母细胞瘤切除术,但临床观察到VHL综合征的肾囊肿经过3~7年有恶变为肾癌的可能,所以肾囊肿应视为细胞癌前病变给予严密观察。胰腺囊肿无恶变倾向,可不予处理。pNET是VHL综合征较常见的并发症之一,治疗可参考神经内分泌肿瘤的治疗。pNET的恶性潜能是手术切除的关键原因。VHL相关的胰腺实性病变的手术干预率为36%~64%[8]。但是VHL相关pNET手术切除的指征目前仍证据不足。一般而言,位于胰腺体尾部的直径≥3 cm的pNETs有转移的高风险,应当行手术切除;位于胰头的直径≥2cm的肿瘤也应当用于手术切除术,特别是观察到肿瘤在迅速生长时。如果肿瘤负荷大或有淋巴结转移或远处转移时,当手术能够去除>90%的肿瘤负荷时,可以考虑减瘤手术。内科治疗并没有VHL相关pNET的数据,目前仍参考散发性pNET的治疗方案。此类患者的随访与分期和治疗选择而定,对术后患者可每6~12个月行CT和/或MRI检查;对于低分化或III-IV期的患者,根据疾病进展情况在第1年内每3~6个月行影像学检查,此后每6~12个月1次;此外,68Ga-DOTATATE-PET-CT(对于中高分化)和/或FDG-PET-CT(对于低分化)可有助于评估疾病复发。目前针对VHL胰腺相关病灶的外科处理并没有确凿的指南推荐,本例VHL患者神经内分泌肿瘤近半年来无明显变化,肿瘤位于胰腺钩突,直径>2 cm,根据2016年Keutgen等[3]综述推荐手术切除,但证据等级低。由于患者故虑手术风险等原因,暂不考虑手术治疗,经多学科讨论接受了舒尼替尼靶向药物治疗。向该患者及家族中可能患此病的家属进行宣教,嘱其密切随访。
VHL综合征; 神经内分泌肿瘤; 诊断
[1] NIELSEN SM,RHODES L,BLANCO I,etal.Von Hippel-Lindau disease:genetics and role of genetic counseling in a multiple neoplasia syndrome[J].JClinOncol,2016,34(18):2172-2181.
[2] KEUTGEN XM,HAMMEL P,CHOYKE PL,etal.Evaluation and management of pancreatic lesions in patients with von Hippel-Lindau disease[J].NatRevClinOncol,2016,13(9):537-549.
[3] FRAENKEL M,KIM MK,FAGGIANO A,etal.Epidemiology of gastroenteropancreatic neuroendocrine tumours [J].BestPractResClinGastroenterol,2012,26(6):691-703.
[4] CHARLESWORTH M,VERBEKE CS,FALK GA,etal.Pancreatic lesions in von Hippel-Lindau disease?A systematic review and meta-synthesis of the literature [J].JGastrointestSurg,2012,16(7):1422-1428.
[5] WEISBROD AB,KITANO M,THOMAS F,etal.Assessment of tumor growth in pancreatic neuroendocrine tumors in von Hippel Lindau syndrome [J].JAmCollSurg,2014,218(2):163-169.
[6] GOSSAGE L,EISEN T,MAHER ER.VHL,the story of a tumour suppressor gene[J].NatRevCancer,2015,15(1):55-64.
[7] LONSER RR,GLENN GM,WALTHER M,etal.von Hippel-Lindau disease [J].Lancet,2003,361(9374):2059-2067.
[8] IGARASHI H,ITO T,NISHIMORI I,etal.Pancreatic involvement in Japanese patients with von Hippel-Lindau disease:results of a nationwide survey [J].JGastroenterol,2014,49(3):511-516.
R736.7
B
10.3969/j.issn.1672-8467.2017.04.024
2017-01-03;编辑:王蔚)
△Corresponding author E-mail:yuxianjun@fudanpci.org
