丝状真菌的快速鉴定及药敏试验
2017-08-17彭阳许超王玉月何彩珍许昕毛易捷史伟峰
彭阳,许超,王玉月,何彩珍,许昕,毛易捷,史伟峰
(苏州大学附属第三医院检验科,江苏常州 213003)
·临床检验技术研究·
丝状真菌的快速鉴定及药敏试验
彭阳,许超,王玉月,何彩珍,许昕,毛易捷,史伟峰
(苏州大学附属第三医院检验科,江苏常州 213003)
目的 评估基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)技术在丝状真菌鉴定中的作用,分析常用抗菌药物对丝状真菌的药敏试验结果。方法 收集100株丝状真菌,采用MALDI-TOF MS进行快速鉴定,并与显微镜检查结果进行比对;用E-test法进行丝状真菌药敏试验。结果 MALDI-TOF MS对100株丝状真菌鉴定达到种鉴定水平的有61株(得分≥2.000),达到属鉴定水平的有36株(1.700~1.999),未能鉴定的有3株(<1.700);与镜检结果不一致的有1株。两性霉素B对絮状表皮癣菌的90%最低抑菌浓度(MIC90)为0.19 μg/mL,而对黄曲霉的MIC90>32 μg/mL。伊曲康唑对断发毛癣菌、犬小孢子菌和絮状表皮癣菌的MIC90均<0.38 μg/mL,而对黑曲霉的MIC90>32 μg/mL。氟康唑对大部分受试菌株的MIC90均>256 μg/mL。伏立康唑和卡泊芬净对烟曲霉、黄曲霉、黑曲霉、红色毛癣菌、断发毛癣菌和犬小孢子菌的MIC90分别≤0.38 μg/mL和≤1 μg/mL。结论 MALDI-TOF MS技术可快速、准确、高通量检测临床分离的丝状真菌。伏立康唑和卡泊芬净对丝状真菌具有较好的抗菌活性。
基质辅助激光解吸电离飞行时间质谱;丝状真菌;真菌药敏试验
近年来,由于器官移植、免疫抑制剂使用、侵入性治疗、恶性肿瘤、HIV感染等患者逐年增多,以及广谱抗菌药物的广泛应用,丝状真菌的感染比例呈上升趋势。很多丝状真菌生长缓慢,传统的基于培养的形态学鉴定方法耗时长,操作繁琐且鉴定能力有限[1-2],给临床早期诊断和抗真菌治疗带来困难。基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization-time-of-flight mass spectrometry, MALDI-TOF MS)是近年来发展起来的一种新的鉴定技术,具有敏感性高和特异性强的特点,可快速、准确鉴定细菌和真菌[3-5]。目前国际上对于抗真菌体外药物敏感试验结果的判读缺乏解释标准,通常用50%最低抑菌浓度(50% minimal inhibitory concentration, MIC50)和MIC90来反映抗真菌药物的活性。本研究主要评估MALDI-TOF MS技术鉴定多种丝状真菌的性能,并应用E-test法检测伊曲康唑等5种抗真菌药物对丝状真菌的抗菌活性。
1 材料与方法
1.1 菌株来源 实验所用菌株有100株。标准菌19株,包括烟曲霉(ATCC 3626)、黄曲霉(CBS13161)、土曲霉(ATCC 3633)、黑曲霉[CMCC(F)A3]、杂色曲霉(CBS 245.65)、构巢曲霉[CMCC(F)A7a]、溜曲霉[CMCC(F)A13]、棒曲霉[CMCC(F)A4a]、薛氏曲霉[CMCC(F)A28]、构巢曲霉[CMCC(F)A7]、焦曲霉[CMCC(F)A15a]、红色毛癣菌(ATCC 4438)、断发毛癣菌(CBS 171.65)、球孢白浆菌[CMCC(F)B13b]、马尔尼菲蓝状菌[CMCC(F)B33r]、产黄青霉[CMCC(F)B31]、淡紫拟青霉(CMCC 35539)、小孢根霉[CMCC(F)B46]、石膏样小孢子菌(CBS 118893)和申克孢子丝菌(ATCC 49.12)各1株,购自中国医学真菌保藏中心;临床分离菌株共81株,包括烟曲霉19株,黄曲霉14株,黑曲霉4株,红色毛癣菌22株,絮状表皮癣菌5株,犬小孢子菌5株,断发毛癣菌5株,石膏样小孢子菌5株,申克孢子丝菌2株,来自苏州大学附属第三医院、南京军区总医院和江苏省人民医院。
1.2 仪器与试剂 Microflex质谱仪(德国布鲁克公司)。马铃薯葡萄糖琼脂(PDA)培养基、棉蓝染色液(珠海贝索公司),无水乙醇、乙腈及甲酸(Sigma公司)。氟康唑(FCA)、两性霉素B(AMB)、伏立康唑(VRC)、伊曲康唑(ITR)和卡泊芬净(CAS)5种E-test药敏纸片(郑州安图生物公司),真菌药敏试验培养基(温州康泰公司)。
1.3 丝状真菌鉴定
1.3.1 棉蓝染色检查 将丝状真菌点种在PDA培养基上,30 ℃培养4~10 d,取一清洁载玻片,滴加棉蓝染液1滴,然后挑取少许培养物于其中,用接种针将其摊开,加盖玻片微微加温并稍压以除去气泡,在显微镜下观察孢子和分生孢子的形态、生长方式及菌丝特征,同时结合菌落生长速度、形态、质地和颜色等进行形态学鉴定。
1.3.2 质谱仪鉴定 将丝状真菌点种在PDA培养基上,30 ℃培养3 d,挑取少量微生物培养物于营养肉汤培养基中,然后置于摇床内28 ℃增菌培养,曲霉属培养24 h,非曲霉属培养48 h,取出离心2 min,收集沉积样本移入Ep管中,13 000 r/min离心2 min,吸弃上清液,向离心管中添加1 mL去离子水,漩涡振荡1 min,13 000 r/min离心2 min,吸弃上清液,向沉淀中加入300 μL去离子水涡旋,再加入900 μL无水乙醇涡旋,13 000 r/min离心2 min,弃上清液,在超净台中干燥2 min;根据沉淀的体积,按比例加入适量的70%甲酸溶液,充分混匀后加等体积乙腈溶液并充分混匀,13 000 r/min离心2 min。吸取1 μL上清液点在MALDI靶板上,待液滴干燥后取1 μL基质溶液(50%乙腈、2.5%三氟乙酸和α-氰基-4-羟基肉桂酸饱和溶液)覆盖其上,在室温下晾干,用质谱仪进行鉴定。使用FlexControl 3.0 软件采集图谱,采用正线性模式,激光频率为60 Hz,加速电压19.98 kV,延迟提取电压17.98 kV,聚焦电压5.99 kV,延迟时间为150 ns,每个靶点设激光随机射击6个点,每次射击40次。用MALDI Biotyper 3.0系统进行数据库比对,得出鉴定结果。鉴定得分在2.000~3.000之间表示准确鉴定到种, 1.700~1.999表示鉴定到属,0.000~1.699表示不能可靠鉴定。每株菌点3 个靶点,进行平行检测,取评分最高的点计入数据统计。
1.4 抗真菌药物敏感性测定
1.4.1 菌悬液的制备 将丝状真菌点种在PDA培养基上,30 ℃培养7 d,用无菌生理盐水冲洗菌落表面的菌丝和孢子。将含有菌丝和孢子的冲洗液静置5~10 min,去除沉淀的颗粒,取上层液体涡旋15 s成孢子悬液。将曲霉属孢子悬液用生理盐水调至0.5麦氏浊度单位,非曲霉孢子悬液调至0.5~1.0麦氏浊度单位。
1.4.2 E-test真菌药敏试验 挑选79株丝状真菌,包括19株烟曲霉、14株黄曲霉、5株黑曲霉、18株红色毛癣菌、5株絮状表皮癣菌、5株犬小孢子菌和6株断发毛癣菌以及构巢曲霉、土曲霉、溜曲霉、棒曲霉、焦曲霉、杂色曲霉、石膏样小孢子菌各1株,采用E-test方法进行药敏试验。操作及结果判读方法按照说明书进行。质控菌为近平滑念珠菌(ATCC 22019)。
2 结果
2.1 丝状真菌鉴定结果 丝状真菌在PDA培养基上培养4~10 d后菌落形态较典型,见图1。曲霉属菌落生长较快,结构相对疏松,不同的曲霉菌可产生不同颜色的色素,如黄曲霉表面呈灰绿色,背面无色或略呈褐色;黑曲霉表面为黑色,呈粉末状;烟曲霉开始为白色,2~3 d后转为绿色,数日后变为深绿色并呈粉末状;土曲霉表面为淡褐色或褐色;杂色曲霉颜色有数环,从青绿到红绿,呈绒毛状。青霉属菌落生长速度较曲霉菌属慢,一般需培养7 d左右,可产生色素,如产黄青霉菌质地绒状,有辐射状皱纹,边缘菌丝体白色,菌落反面呈浅黄褐色;马尔尼菲蓝状菌在30 ℃时呈现为菌丝型,并可产生红色色素,而在37 ℃时则为酵母型,不产生色素。申克氏孢子丝菌为双相型真菌性,在25 ℃时呈菌丝状,表面有皱纹,颜色从白色转成深棕色,在37 ℃时则呈灰棕色酵母菌状。皮癣菌属一般于第2~4天开始有菌落生长,第7~12天菌落较快生长,除了可产生特征性色素的菌株如红色毛癣菌、紫色毛癣菌外,大多呈白色绒毛状,肉眼较难区分。根霉菌属一般会从中心向周围辐射生长成圆形菌落,初形成时为灰白色或黄白色,成熟后变成黑色,生长迅速的菌株可在2~3 d长满整个平板。100株丝状真菌的MALDI-TOF MS鉴定得分:评分≥2.000,达到种鉴定水平的有61株;1.700~1.999,达到属水平的有36株;<1.700的有3株,见表1。19株标准菌株中,棉蓝染色镜检结果与质谱鉴定结果相符合的有15株;质谱鉴定无结果的有3株,分别为薛氏曲霉[CMCC(F)A28]、球孢白浆菌[CMCC(F)B13b]和马尔尼菲蓝状菌[CMCC(F)B33r];与质谱鉴定结果不相符的有1株,为产黄青霉[CMCC(F)B31]。质谱鉴定标准菌株的准确率为78.95%(15/19)。81株常见临床分离菌株中,棉蓝染色镜检结果与质谱结果均相符合。

注:A,烟曲霉;B,黄曲霉;C,黑曲霉;D,棒曲霉;E,构巢曲霉;F,杂色曲霉;G,马尔尼菲蓝状菌;H,申克孢子丝菌;I,石膏样小孢子菌;J,小孢根霉;K,产黄青霉菌;L,断发毛癣菌。

图1 12种丝状真菌菌落形态
2.2 E-test药敏试验结果 79株丝状真菌采用E-test方法检测药敏试验。对于曲霉属等生长较快的丝状真菌24 h即可判读结果,而对于申克孢子丝菌、石膏样小孢子菌、犬小孢子菌、毛癣菌属则需48~96 h才能判读。两性霉素B对絮状表皮癣菌的MIC90为0.19 μg/mL,而对黄曲霉的MIC90>32 μg/mL。伊曲康唑对断发毛癣菌、犬小孢子菌和絮状表皮癣菌的MIC90均<0.38 μg/mL,而对黑曲霉的MIC90>32 μg/mL。氟康唑对大部分受试菌株的MIC90均>256 μg/mL;伏立康唑和卡泊芬净对烟曲霉、黄曲霉、黑曲霉、红色毛癣菌、断发毛癣菌和犬小孢子菌的MIC90分别≤0.38 μg/mL和≤1 μg/mL。见表2。
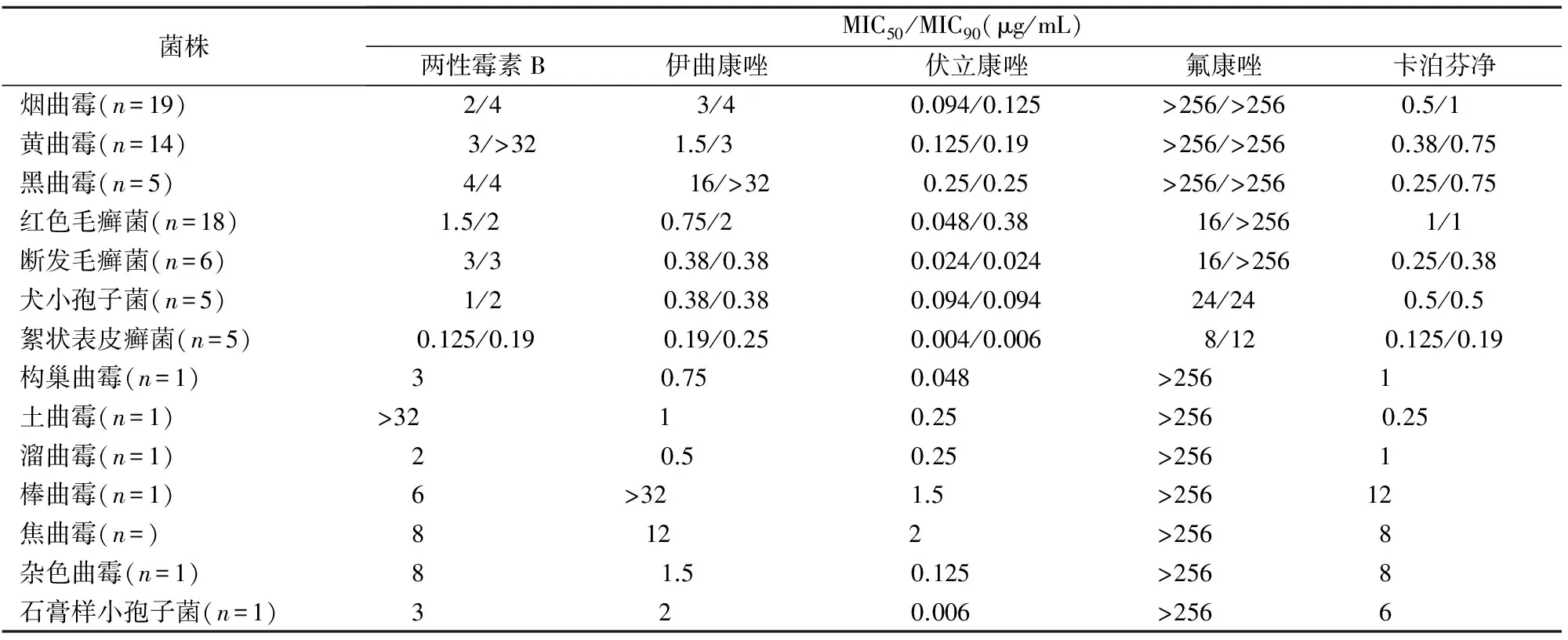
表2 79株丝状真菌体外药敏结果
3 讨论
丝状真菌的鉴定方法包括直接镜检法、血清学方法、组织病理学检查、分子生物学方法等。其中丝状真菌形态学鉴定需要数天的时间对菌落的生长速度、色素变化及镜下菌丝和孢子结构进行观察,要求检验人员有专业的技术和丰富的鉴定经验,易产生较大的人为误差;组织病理学检查和血清学方法不能将丝状真菌鉴定到种的水平;分子生物学方法对操作人员技术要求高,操作复杂,费用昂贵,且对于一些基因序列高度同源的真菌如黄曲霉和米曲霉不能很好地区分,亦不适合成为实验室常规的检测方法。近年来,MALDI-TOF MS技术已广泛用于酵母菌的鉴定,操作简便、快速、高通量、成本低廉,且准确性高,临床应用取得良好效果[6],因此我们选用质谱仪鉴定法对21种丝状真菌进行鉴定,同时与棉蓝染色检查的鉴定结果进行比对。目前,此技术并未普及至丝状真菌的鉴定,主要是因为丝状真菌的胞壁坚韧、难以破碎,常规处理方法难以提取出足量的蛋白质。真菌蛋白质的提取方法包括匀浆法、研磨法、超声破碎法及酶溶法等。有研究表明玻璃珠研磨法和超声破碎法可提高真菌蛋白质的分离效率[7-8]。考虑到玻璃珠研磨法操作复杂、超声破碎法成本高且热效应太大等缺点,我们设计了液体培养的方法,对丝状真菌进行甲酸萃取等特殊处理,有助于快速、简便地提取更多的蛋白质。此外,本研究菌株种类多,而Biotyper 2.0数据库中包含的丝状真菌库较少,无法满足临床需要,因此我们引进了布鲁克公司提供的最新丝状真菌数据库。其涵盖127种丝状真菌的图谱,但仍缺少个别种类,如本研究鉴定无结果的薛氏曲霉和马尔尼菲蓝状菌。因此,丝状真菌的数据库图谱需继续完善。
丝状真菌进行棉蓝染色检查时,需要将真菌接种在PDA培养基培养至少7 d至成熟后才能在镜下看到理想的形态,而质谱仪鉴定法只需将丝状真菌接种于肉汤中培养24 h即可鉴定,并且可以同时检测多个菌株,鉴定单株的过程大约需要20 min。由此可见,质谱仪鉴定法不仅大大缩短了丝状真菌鉴定的时间,而且具有高通量、高准确性的优势。按照质谱评分标准,丝状真菌鉴定达到种水平的鉴定率为61.00%(61/100),达到属水平为97.00%(97/100),与国内报道[9]相似;曲霉菌鉴定达到种水平的鉴定率为97.83%(45/46),达到属水平为100%(46/46),与国内外报道[4,9]相似。由此可见,质谱仪鉴定的方法具有快速、操作简便、高通量、成本低廉等优势,有助于尽早鉴定出真菌类别,提高鉴定速度,尤其在鉴定曲霉菌上优势更突出。
近年来,新的抗菌药物如卡泊芬净、伏立康唑给临床治疗真菌感染提供了更多的选择,如何有针对性地选择抗菌药物是临床医生最为关注的问题,而真菌的体外药敏试验可评估临床上常见的真菌对经典和新型抗菌药物的抗菌活性,为临床提供一定的药敏依据。临床实践中,丝状真菌的体外药敏试验方法主要包括美国临床和实验室标准化协会(CLSI)推荐的M38-A肉汤稀释法、琼脂扩散法和E-test法。其中CLSI推荐的标准化方案重复性好,但是操作繁琐,成本较高,需时较长,不适合实验室常规运用;琼脂扩散法测定真菌对抗真菌药物的敏感性仅限于定性,目前较少使用。国外最新研究报道,E-test法和CLSI推荐的液基稀释法针对两性霉素、卡泊芬净和伏立康唑等抗真菌药物药敏结果的符合率具有很好的一致性[10]。E-test法不仅具有操作简便、结果易判读、重复性好和定量检测MIC值等优点,而且有成熟的商品供应,是我们选择该方法的重要原因。国内外均有研究报道E-test法检测抗真菌药物的抗菌活性,但是对于抗真菌药物的类别和霉菌种类的选择依旧存在一定的局限性[11-13]。本实验利用E-test法检测了79株丝状真菌对AMB、FCA、ITR、VRC和CAS 5种抗真菌药物的活性。CLSI对近平滑念珠菌(ATCC 22019)具有MIC范围标准,本次质控试验结果在范围标准内,符合质控标准。由于CLSI对于判断不同丝状真菌体外药敏试验敏感和耐药的折点尚未明确规定,我们用MIC50和MIC90来反映5种抗真菌药物对不同丝状真菌的抑菌程度。本研究显示,两性霉素B对多数丝状真菌有抗菌活性,对黄曲霉的MIC90>32 μg/mL,对土曲霉的MIC>32 μg/mL,与研究报道的土曲霉对两性霉素B天然耐药,黄曲霉可以出现获得性耐药的情况相符[12];氟康唑对绝大多数丝状真菌的抗菌活性较弱,提示对大多数真菌可能无效;卡泊芬净对绝大多数丝状真菌有抗菌活性,但在体外药敏试验中有拖尾现象,圈内有菌生长,可能会影响结果的判读;伏立康唑和伊曲康唑均为三唑类抗真菌药,对大多数丝状真菌均有抗菌活性,但结果显示伏立康唑对丝状真菌的抗菌活性优于伊曲康唑。以往两性霉素常作为抗真菌感染的一线用药,而本实验结果表明伏立康唑和卡泊芬净对丝状真菌有更好的抗菌活性。此外,需要注意药敏结果与临床疗效常遵循的“90-60”原则[14],即体外药敏试验结果敏感者约有90%临床疗效较好,而耐药者约有60%仍然对治疗有效,这一规律说明了体外药敏试验与临床疗效之间的相关性。因此,检验科室需与临床加强沟通,这就要求我们能够正确理解药敏试验结果的临床应用价值和局限性,以便更准确、快速地为临床筛选药物。
综上所述,MALDI-TOF MS技术可快速、准确、高通量检测临床分离的丝状真菌,同时结合快速的药敏试验,便能在很短的治疗时间窗口内提供诊断和治疗意见,既能够避免选用天然不敏感的抗真菌药物以减少临床药物治疗成本,又能减少了严重感染病患者的住院时间并降低发病率和死亡率。E-test法重复性好,操作简便,敏感性高,可以为指导临床医师合理选择用药及检测病原真菌对抗真菌药物的耐药趋势等方面提供参考。故推荐MALDI-TOF MS鉴定法和E-test法作为临床实验室的常规检测方法。
[1]Chen JH,Yam WC,Ngan AH,etal. Advantages of using matrix-assisted laser desorption ionization-time of flight mass spectrometry as a rapid diagnostic tool for identification of yeasts and mycobacteria in the clinical microbiological laboratory[J]. J Clin Microbiol,2013,51(12): 3981-3987.
[2]Del Chierico F,Masotti A,Onori M,etal. MALDI-TOF MS proteomic phenotyping of filamentous and other fungi from clinical origin[J]. J Proteomics,2012,75(11): 3314-3330.
[3]Chen YS,Liu YH,Teng SH,etal. Evaluation of the matrix-assisted laser desorption/ionization time-of-flight mass spectrometry Bruker Biotyper for identification ofPenicilliummarneffei,Paecilomycesspecies,Fusariumsolani,Rhizopusspecies, andPseudallescheriaboydii[J]. Front Microbiol,2015,6: 679.
[4]Bille E,Dauphin B,Leto J,etal. MALDI-TOF MSAndromasstrategy for the routine identification of bacteria, mycobacteria, yeasts,Aspergillusspp. and positive blood cultures[J]. Clin Microbiol Infect,2012,18(11): 1117-1125.
[5]Posteraro B,De Carolis E,Vella A,etal. MALDI-TOF mass spectrometry in the clinical mycology laboratory: identification of fungi and beyond[J]. Expert Rev Proteomics,2013,10(2): 151-164.
[6]Cherkaoui A,Hibbs J,Emonet S,etal. Comparison of two matrix-assisted laser desorption ionization-time of flight mass spectrometry methods with conventional phenotypic identification for routine identification of bacteria to the species level[J]. J Clin Microbiol,2010,48(4): 1169-1175.
[7]李敏惠,潘克俭,宋丽萍. 用SDS-PAGE和Vorum银染法比较真菌菌丝体破壁效果[J]. 生物技术通讯,2011,22(6): 867-869.
[8]王爽,姜兰香,张宇. 真菌胞内蛋白质提取方法的建立[J]. 吉林大学学报(医学版),2012,38(3): 590-594.
[9]王欢,贾天野,鲍春梅. 质谱仪在真菌鉴定中的应用与评价[J]. 传染病信息,2015,28(4): 210-214.
[10]Lamoth F,Alexander BD. Comparing Etest and Broth Microdilution for Antifungal Susceptibility Testing of the Most-Relevant Pathogenic Molds[J]. J Clin Microbiol,2015,53(10): 3176-3181.
[11]Fuller J,Schofield A,Jiwa S,etal. Caspofungin Etest endpoint forAspergillusisolates shows poor agreement with the reference minimum effective concentration[J]. J Clin Microbiol,2010,48(2): 479-482.
[12]王澎,陈翠珠,徐英春. 4种抗真菌药对82株丝状真菌体外抗菌活性的临床研究[J]. 中国实用内科杂志(临床版),2006,26(7): 547-549.
[13]朱焱,游晓意,王丽纳. E-test法测定两种抗真菌药物对皮肤癣菌敏感性评价[J]. 临床检验杂志,2013,31(9): 718-719.
[14]Kanafani ZA,Perfect JR. Antimicrobial resistance: resistance to antifungal agents: mechanisms and clinical impact[J]. Clin Infect Dis,2008,46(1): 120-128.
(本文编辑:刘群)
Rapid identification and antifungal susceptibility testing of filamentous fungi
PENGYang,XUChao,WANGYu-yue,HECai-zhen,XUXin,MAOYi-jie,SHIWei-feng
(DepartmentofLaboratoryMedicine,theThirdAffiliatedHospitalofSoochowUniversity,Changzhou213003,Jiangsu,China)
Objective To evaluate the application of matrix-assisted laser desorption ionization-time-of-flight mass spectrometry(MALDI-TOF MS) technology in the identification of filamentous fungi, and analyze the susceptibility of filamentous fungi to commonly used antibiotics. Methods A total of 100 strains of filamentous fungi were collected and identified rapidly by MALDI-TOF MS. The obtained results were compared with those from microscopic examination. The susceptibility of filamentous fungi was detected by the E-test method. Results Among 100 strains of filamentous fungi identified by MALDI-TOF MS, 61 reached to the species level(score≥2.000), 36 to the genus level(score between 1.700 and 1.999), and 3 failed to be identified(score<1.700). There was inconsistent results for one strain of filamentous fungi between MALDI-TOF MS and microscopic examination. The MIC90of amphotericin B againstEpidermophytonfloccosumwas 0.19 μg/mL, while that againstAspergillusflavuswas above 32 μg/mL. The MIC90of itraconazole againstTrichophytontonsurans,MicrosporumcanisandEpidermophytonfloccosumwere all below 0.38 μg/mL, while that againstAspergillusnigerwas above 32 μg/mL. The MIC90of fluconazol were above 256 μg/mL for most of strains. The MIC90of voriconazole and caspofungin againstAspergillusfumigatus,Aspergillusflavus,Aspergillusniger,Trichophytonrubrum,TrichophytontonsuransandMicrosporumcaniswere ≤0.38 μg/mL and ≤1 μg/mL, respectively. Conclusion The MALDI-TOF MS technology may be used to identify the filamentous fungi isolated from clinical specimens quickly, accurately and high-throughput. Voriconazole and caspofungin have effective anti-filamentous fungi activity.
matrix-assisted laser desorption ionization-time-of-flight mass spectrometry; filamentous fungi; antifungal susceptibility testing
10.13602/j.cnki.jcls.2017.07.02
国家自然科学基金(81572052);江苏省自然科学基金(BK20151178);常州市医学领军人才项目(20101368)。
彭阳,1992年生,女,硕士研究生,主要从事临床微生物与免疫研究。
史伟峰,主任技师,教授,硕士研究生导师,E-mail:swf67113@163.com。
R446.5
A
2017-06-01)
