托珠单抗治疗难治性视神经脊髓炎谱系疾病的疗效与安全性初步观察☆
2017-08-17李静常艳宇卢婷婷钟晓南方羚陆正齐胡学强邱伟
李静常艳宇卢婷婷钟晓南方羚陆正齐胡学强邱伟
·论 著·
托珠单抗治疗难治性视神经脊髓炎谱系疾病的疗效与安全性初步观察☆
李静*常艳宇*卢婷婷*钟晓南*方羚*陆正齐*胡学强*邱伟*
目的观察托珠单抗治疗难治性视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)的疗效与安全性。方法纳入6例血清水通道蛋白抗体(anti-aquaporin-4 antibody,AQP4-IgG)阳性且经糖皮质激素联合硫唑嘌呤治疗疗效不佳的NMOSD患者,予托珠单抗治疗(8 mg/kg,每个月1次静脉滴注,连续治疗1年以上),前瞻性评估患者的年复发率(annualized relapse rate,ARR)、扩展残疾状态量表评分(expanded disability status scale score,EDSS)及疼痛数字评价量表(numerical rating scales,NAS),评价托珠单抗的疗效及副作用。结果5例女性和1例男性,年龄34~63岁,病程16~96个月,托珠单抗治疗6~16次,经治疗后平均ARR由1.28±0.58降为0(P<0.05),平均EDSS评分由5.50±2.81降为3.83±3.48(P>0.05),平均NAS评分由5.83±3.06降为2.5±2.07(P<0.05),无严重不良反应发生。结论托珠单抗可改善难治性NMOSD患者的年复发率及神经病理性疼痛,可能是一种治疗难治性NMOSD的有效药物。
托珠单抗 视神经脊髓炎谱系疾病 治疗
视神经脊髓炎谱系疾病 (neuromyelitis optica spectrum disorders,NMOSD)是一组主要累及视神经、脊髓和大脑特殊部位的中枢神经系统炎性脱髓鞘疾病,以复发性视神经炎和长节段脊髓炎为主要临床特点。NMOSD与视神经脊髓炎(neuromyelitis optica,NMO)在生物学特性及免疫治疗策略上相似,目前已将NMO整合入更广义的NMOSD疾病范畴中[1]。水通道蛋白4抗体(antiaquaporin-4 antibody,AQP4-IgG)是NMOSD特异性生物免疫标志物,在体内与表达AQP4的星形胶质细胞结合,从而导致星形胶质细胞溶解、破坏,产生临床症状。近年来有研究报道NMOSD患者外周血浆母细胞(plasmablasts,PB)水平升高,而PB是外周血B细胞产生AQP4-IgG的主要来源[2]。体外实验研究发现外源性白介素-6(interleukin6,IL-6)可增强PB存活能力,促进AQP4-IgG产生,NMO患者在复发期血清和脑脊液IL-6水平均有升高[2],这提示阻断IL-6受体通路可能会抑制NMOSD疾病活跃程度。托珠单抗(Tocilizumab,TCZ)为重组人源化抗IL-6受体单克隆抗体,可特异性地与可溶性及膜性IL-6受体结合阻断信号传导,从而抑制IL-6活性。目前国外已有研究报道TCZ治疗NMO及NMOSD可改善扩展残疾状态量表评分(expanded disability status scale score,EDSS)并降低年复发率(annualized relapse rate,ARR)[3-5],但目前尚无TCZ治疗国人NMOSD的资料。本研究对6例难治性NMOSD患者使用TCZ后的长期疗效进行报道,以期对临床难治性NMOSD患者的治疗提供参考。
1 对象与方法
1.1 研究对象收集2015年4月至2016年3月作者医院神经内科经常规免疫抑制剂治疗,近2年复发频率≥2次的难治性NMOSD患者6例。入组标准:①年龄18~65岁;②诊断符合2015年国际NMO诊断小组制定的NMOSD诊断标准[1];③血清AQP4-IgG(+);④患者或直系亲属签署知情同意书。排除标准:①WBC<4×109/L,HGB<80 g/L, PLT<100×109/L;②肌酐超过正常值上限者;③转氨酶超过正常上限2倍者;④有严重心血管、肝脏、肾脏等重要器官病变;⑤有免疫缺陷、未控制的感染等;⑥育龄妇女尿妊娠检测阳性。
1.2 研究方法
1.2.1一般临床资料收集 收集患者性别、年龄、病程、TCZ治疗前的EDSS评分、ARR、疼痛数字评价量表(numerical rating scales,NAS)评分、实验室检查及影像学检查结果,曾使用的免疫抑制剂等。每个患者均行血清AQP4-IgG检测 (细胞间接免疫荧光法),结果为阳性。
1.2.2给药方案 由医疗专业人员以无菌操作方法将TCZ(雅美罗-罗氏制药,瑞士)按剂量8 mg/kg,用0.9%的无菌生理盐水稀释至100 mL静脉滴注,时间在1 h以上,给药前30 min予苯海拉明20 mg肌肉注射,同时给予心电监护测量心率、呼吸、血压等生命体征变化,每4周静脉滴注1次,连续治疗1年以上。
1.2.3EDSS、NAS评分及副作用观察 于TCZ治疗后每个月1次门诊随访进行EDSS及NSA评分,并间隔1~3月复查血常规、肝肾功能。于2016年11月对6例患者进行门诊或电话随访,对患者目前情况进行EDSS及NSA评分。
1.2.4ARR统计TCZ治疗前后的ARR,复发的定义为与上一次发作间隔时间大于30 d,出现新的神经系统恶化的症状,并且症状持续至少24 h,该症状可以使EDSS评分增加至少0.5分。ARR为平均每年复发的次数。
1.3 统计学方法采用SPSS 17.0进行分析。计量资料以(±s)表示,治疗前后疗效分析采用两相关样本非参数检验(Wilcoxon符号秩和检验)。检验水准α=0.05,双侧检验。
2 结果
2.1 临床资料6例患者(女5例,男1例),发病年龄31~60岁(平均45.3岁),病程16~96个月,临床类型包括复发型NMO(3例),复发型长节段脊髓炎(1例),复发型视神经炎(1例),脊髓炎合并颅内病灶(1例)。TCZ治疗前曾用免疫抑制剂:小剂量糖皮质激素、硫唑嘌呤、干扰素、环磷酰胺。见表1。
2.2 用药情况及疗效观察病例1因经济原因在治疗满1年后每次用药剂量减为6 mg/kg,并延长用药时间间隔(≥50 d);病例2在用药13次后中断治疗5个月;病例3用药6次后,因经济原因停止TCZ治疗,其余3例患者按疗程足量使用TCZ超过1年,并继续使用。
TCZ治疗前患者平均 ARR为 1.28±0.58,EDSS评分为5.50±2.81,NAS评分为5.83±3.06;经TCZ治疗6~16次,末次随访时,ARR为0(P<0.05),EDSS评分降为3.83±3.48(P>0.05),NAS评分降为2.5±2.07(P<0.05),用药情况及疗效详见表2,部分患者随访时行MRI检查,见图1。
2.3 药物副作用6例患者在静脉滴注TCZ过程中及随访期间均未出现明显副作用,间隔1~3月复查血常规及肝肾功能未见异常。

表1 6例NMOSD患者基本临床资料
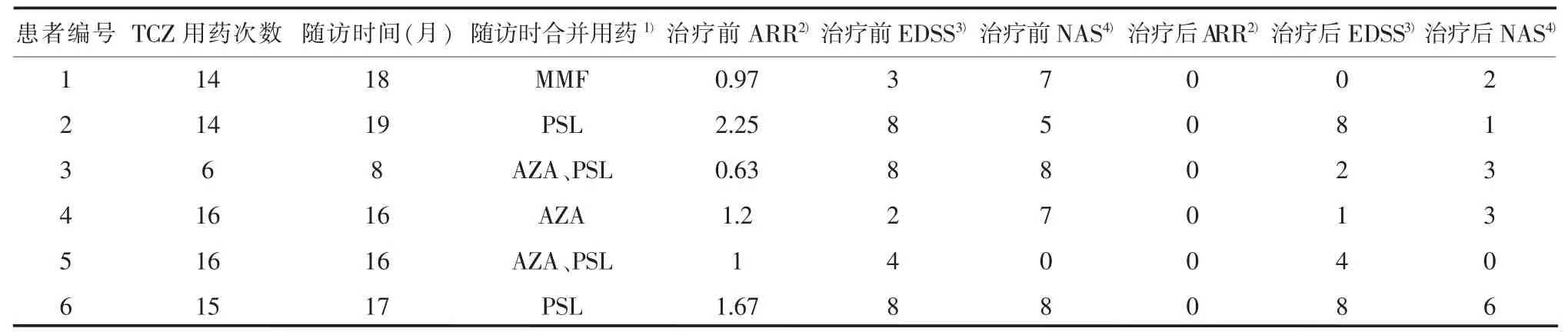
表2 6例NMOSD患者治疗情况及治疗效果
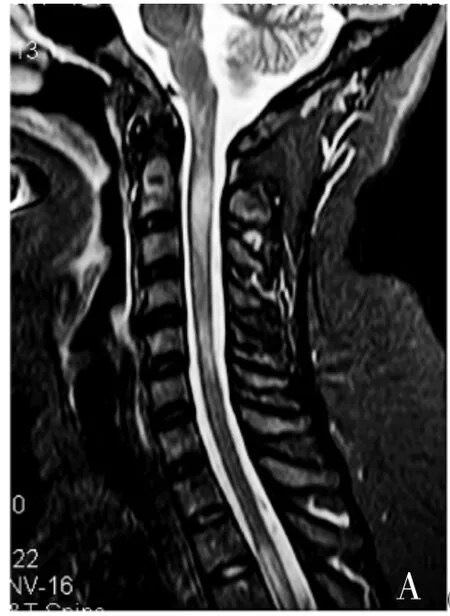
图1 ATCZ治疗前MRI可见脊髓肿胀,片状长T2信号影
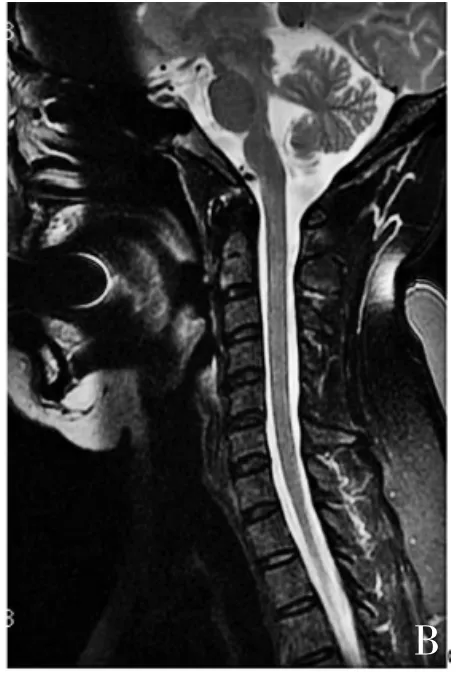
图1 B TCZ治疗1年后脊髓肿胀明显减轻,见片状稍长T2信号影
3 讨论
NMOSD的治疗分为急性期治疗、序贯治疗(免疫抑制治疗)。免疫抑制治疗目的为预防复发,减少神经功能残障积累,一线药物包括硫唑嘌呤(azathioprine AZA)、吗替麦考酚酯、甲氨蝶呤等。目前已有报道AZA联合小剂量泼尼松可改善NMOSD患者ARR及EDSS评分[6]。生物制剂疗法近年也被推荐使用,单克隆抗体与常规免疫抑制剂相比,具有治疗高度选择性、起效快、长期副作用少等优点,目前报道可用于治疗NMOSD的单克隆抗体有作用于B细胞的利妥昔单抗,IL-6受体阻滞剂TCZ和作用于补体的依库珠单抗[7]。本研究为首次在国人难治性NMOSD中使用TCZ治疗,尽管TCZ为超适应症使用,但根据国外报道,TCZ安全且可能有效。
本研究中,患者接受TCZ治疗时间为8~19个月,使用TCZ次数为6~16次。结果显示,患者平均 ARR显著下降 (由 1.28±0.58降为 0,P<0.05),与国外文献报道一致[5,8],提示TCZ在抑制国人NMOSD疾病活跃程度,减少年复发率上可能有效。但本研究中,患者在TCZ治疗过程中均继续联合使用了小剂量激素和/或免疫抑制剂,因此尚不能排除ARR下降与合并使用激素及免疫抑制剂有关。但在RINGELSTEIN等[8]的研究中,8例NMOSD患者使用TCZ治疗,除2例使用过大剂量激素冲击治疗并加用AZA外,其余病例在TCZ治疗的整个过程中未联合使用其他免疫抑制,结果显示ARR仍显著降低,这提示TCZ在减少NMOSD年复发率上也许可以不用联合其他免疫抑制剂。有研究发现[5,8],在TCZ治疗过程中,复发容易出现在TCZ治疗初期(2.5个月内),复发原因可能是TCZ治疗间隔时间延长 (≥40 d)或TCZ用量较低(6 mg/kg),然而这些患者在随后的TCZ治疗过程中,虽然再次出现治疗间隔时间延长(≥40 d)的情况,也未出现复发表现。本研究中,有两例患者在TCZ治疗后期减少了每次治疗剂量(6 mg/kg)或延长了用药间隔时间(≥50 d),但随访过程中未见复发。这提示在TCZ治疗NMOSD过程中,早期应按疗程足剂量使用,治疗满12个月后,也许适当延长治疗间隔时间或减少每次用量不影响控制年复发率。
NMOSD患者的神经功能残障程度与每次复发时缓解是否充分有关,RINGELSTEIN等[8]报告,8例患者中有6例经TCZ治疗后EDSS显著改善,这源于TCZ的治疗开始于疾病复发早期,复发得到了充分缓解,而本研究中部分病例是在复发后数月才开始接受TCZ治疗,EDSS评分改善不显著,与国外研究结果有差异,因此在复发期尽早使用TCZ可能减轻神经功能残障。
慢性神经病理性疼痛是NMOSD常见的伴随症状,且较难控制,其病理机制目前还不甚明确,潜在的早期痛觉细胞因子释放 (包括肿瘤坏死因子,IL-1β、IL-17、IL-6)也许是NMOSD神经性疼痛难以控制的原因之一[9-10]。ARAKI等[5]的研究报道,TCZ可能通过抑制IL-6受体,减轻NMOSD患者的神经病理性疼痛。本研究采用NAS评分来评估患者慢性疼痛,经治疗后NMOSD患者NAS显著降低(5.83±3.06 vs.2.5±2.07,P<0.05),与国外研究报道一致。
TCZ的副作用主要是轻微增加感染机会,例如上呼吸道感染、潜在的结核病灶复活等,还可能会出现转氨酶及血脂升高,以及中性粒细胞数和C反应蛋白降低[11]。本研究中,在静脉滴注TCZ过程中及之后的随访时没有发现明显的副作用,患者耐受良好。
综上所述,长疗程使用TCZ治疗难治性NMOSD是一种可能有效的方法,TCZ可减少难治性NMOSD年复发率,显著减轻慢性神经病理性疼痛,在复发早期使用可减轻神经功能残障,临床使用副作用小。目前关于TCZ治疗NMOSD这方面的文献仅限于少数的病例报道,本研究也存在病例数较少,没有响应对照组等局限,因此我们尚需要多中心、大规模、随机对照的临床试验,进一步深入研究TCZ治疗NMOSD中的具体作用机制、用药方案、临床疗效、远期副作用等问题。
[1]WINGERCHUK DM,BANWELL B,BENNETT JL,et al.International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J].Neurology,2015,85(2):177-189.
[2]CHIHARA N,ARANAMI T,SATO W,et al.Interleukin 6 signaling promotes anti-aquaporin 4 autoantibody production from plasmablasts in neuromyelitis optica[J].Proc Natl Acad Sci U S A,2011,108(9):3701-3706.
[3]KIESEIER BC,STUVE O,DEHMEL T,et al.Disease Amelioration With Tocilizumab in a Treatment-Resistant Patient With Neuromyelitis Optica[J].JAMA Neurol,2013,70(3):390-393.
[4]ARAKI M,ARANAMI T,MATSUOKA T,et al.Clinical improvement in a patient with neuromyelitis optica following therapy with the anti-IL-6 receptor monoclonal antibody tocilizumab[J].Mod Rheumatol,2013,23(4):827-831.
[5]ARAKI M,MATSUOKA T,MIYAMOTO K,et al.Efficacy of the anti-IL-6 receptor antibody tocilizumab in neuromyelitis optica:a pilot study[J].Neurology,2014,82(15):1302-1306.
[6]QIU W,KERMODE AG,LI R,et al.Azathioprine plus corticosteroid treatment in Chinese patients with neuromyelitis optica [J].J Clin Neurosci,2015,22(7):1178-1182.
[7]李静,邱伟.视神经脊髓炎谱系疾病单克隆抗体治疗新进展[J].中国神经免疫学和神经病学杂志,2016,23(4):277-279,280.
[8]RINGELSTEIN M,AYZENBERG I,HARMEL J,et al.Longterm Therapy With Interleukin 6 Receptor Blockade in Highly Active Neuromyelitis Optica Spectrum Disorder[J].JAMA Neurol,2015,72(7):756-763.
[9]BRADL M,KANAMORI Y,NAKASHIMA I,et al.Pain in neuromyelitis optica--prevalence,pathogenesis and therapy[J].Nat Rev Neurol,2014,10(9):529-536.
[10]UZAWA A,MORIM,KUWABARA S.Cytokinesand chemokines in neuromyelitis optica:pathogenetic and therapeutic implications[J].Brain Pathol,2014,24(1):67-73.
[11]SMOLEN JS,BEAULIEU A,RUBBERT-ROTH A,et al.Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study):a double-blind, placebo-controlled,randomised trial[J].Lancet,2008,371(9617):987-997.
R744.5+2
A
2016-12-29)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2017.06.010
☆国家自然科学基金(编号:81471218);广东省自然科学基金(编号:2014A030313014);广东省科技计划项目(编号:2013B051000 037)
* 中山大学附属第三医院(广州 510630)
