铁皮石斛胚胎发生相关基因DoEMB8的克隆及表达分析
2017-08-16安红强王万军
安红强, 王万军
(西南交通大学 生命科学与工程学院, 成都 610031)
铁皮石斛胚胎发生相关基因DoEMB8的克隆及表达分析
安红强, 王万军
(西南交通大学 生命科学与工程学院, 成都 610031)
采用RACE和巢式PCR技术克隆出铁皮石斛胚胎发生相关基因DoEMB8(Embryogenesis-associated protein EMB8)序列。序列分析表明该基因全长2077 bp,包含一个1824 bp的CDS,编码608个氨基酸残基。分子进化分析显示,DoEMB8与海枣(Phoenixdactylifera)、油棕(Elaeisguineensis)、小果野芭蕉(Musaacuminatasubsp.malaccensis)等单子叶植物的亲缘关系较近。跨膜区分析显示DoEMB8蛋白含有两个跨膜螺旋结构,亚细胞定位显示该基因可能存在于线粒体。RT-qPCR分析表明,DoEMB8在原球茎不同发育时期表达量较为恒定,在PLB(Protocorm like body)中的表达量较原球茎不同时期要高,在组织表达分析中,种子中的表达量最高,较根中的表达量上升了3.16倍,表明该基因在胚胎发育时期有着持续稳定且较高的表达,可能对植物胚胎发育起着重要作用。
铁皮石斛; 胚胎发育相关基因; RACE; RT-qPCR
在大多数绿色植物中,胚胎发生在植物的生命周期中扮演着重要作用[1-2]。植物的胚胎发生是指从单细胞的受精卵到多细胞种胚的发育分化过程,胚胎形成包含两个明显的阶段:早期形态学事件和后期生殖细胞的形成[3-4]。在植物胚胎发育过程中,成熟的植株都会经过一个基本的形体发育过程,这包括芽、根端分生组织、子叶、幼根和子叶下胚轴的形成,之后,植物基底端轴线、径向元素、表皮、基本组织和维管结构会随之形成;这些要素在植物胚胎发育的早期形成,并在植物整个生命周期中稳定存在[5-9]。植物胚胎形成是一个非常复杂和有序的生物学过程,受到一些独特基因群组的调控[10-12],它是基因在机体内外因素协同作用下,在时间和空间上顺序表达的过程[13]。受精卵极性的建立是胚胎发育的第一步,而第一个发现与极性建立有关的基因是GNDM/EMB30(GN),该基因的突变体造成胚胎失去根部和下胚轴[14-15]。因而EMB可能对植物胚胎发生过程具有重要的调控作用。
铁皮石斛(DendrobiumofficinaleKimuraetMigo)为兰科石斛属多年生附生草本植物,通常生长于悬崖和林中覆盖有苔藓的树干上[16-17],由于其在自然环境中萌发率极低,因而对该植物的研究通常通过人工组培的方式进行。其种胚发育过程要经过原球茎时期,由于其种胚较小,因而对其种胚发育的研究比较困难,且原球茎发育的分子机理尚不清楚。本研究拟根据铁皮石斛转录组序列片段,采用RACE技术对胚胎发育相关基因DoEMB8进行克隆扩增,并采用生物信息学手段对该基因的编码蛋白进行理化性质分析和功能预测,再通过实时荧光定量PCR(RT-qPCR)和2-△△Ct方法对该基因在原球茎不同发育时期及不同组织的表达情况进行分析,推测该胚胎发育相关基因在原球茎时期的功能,为后续研究该基因调控铁皮石斛胚胎发育分子机制奠定基础。
1 材料与方法
1.1 材料
铁皮石斛种子源自云南,接种于含1.07 μmmol/L NAA的1/2MS培养基上,在种子发育的不同阶段分别取原球茎形成、原分生组织形成、顶端分生组织形成、椭球形原球茎、叶原基维管系统形成、根端分生组织形成和原球茎退化共7个时期材料;从体胚诱导而来的材料中取类原球茎(protocorm-like body, PLB);从接种于1/2MS培养基上的幼苗取根、茎、叶3种组织材料;从实验室花盆栽培的成熟的铁皮石斛植株上取整个花朵和种子,取材后液氮速冻保存于-80℃冰箱备用。
1.2 方法
1.2.1 RNA提取及cDNA合成
取上述冻存的材料,用液氮研磨进行组织破碎,采用Plant RNA Kit (OMEGA BIO-TEK)试剂盒提取铁皮石斛总RNA,通过RNase-free DNase I (TaKaRa, 大连)在膜上消化去除总RNA中的基因组污染。提取的总RNA经1%琼脂糖凝胶电泳来鉴定完整性,D260 nm/280 nm比值法进行RNA纯度鉴定,取1 μg电泳条带完整,D260 nm/280 nm比值位于1.8~2.1的总RNA进行逆转录,逆转录酶采用TaKaRa的Reverse Transcriptase M-MLV(RNase H-)进行cDNA第一链的合成,cDNA稀释10倍后冻存于-80℃用于后续RT-qPCR实验。
1.2.2 RACE克隆及测序分析
以实验室已经测过的转录组序列片段为模板,采用Primer Premier 5.0设计3′RACE巢式引物,在模板序列3′端设计两个上游引物EMB8-3R和EMB8-3RN,送交成都擎科生物公司合成,并与下游通用引物3RP和3RNP配对使用进行巢式PCR扩增,PCR克隆产物经1%琼脂糖凝胶电泳检测后进行胶回收,构建重组载体并转化至大肠杆菌DH5α,摇菌活化后进行蓝白斑筛选,最终挑取阳性单克隆送交成都擎科生物公司测序。测序得到的序列经NCBI中的Blastn比对分析确认为EMB8目的基因后,与原转录组序列拼接得到DoEBM8序列。
1.2.3 生物信息学分析
使用NCBI的BlastP进行蛋白相似性比对,并取排名靠前的前15个物种的相似序列进行系统发育分析,选取最大分值667分以上,序列覆盖度87%以上的25个物种EMB同源序列,用于后续构建系统发育树,采用ClustalX进行序列比对,MEGA6.0构建系统发育树。采用NCBI中的Open Reading Frame Finder (ORF Finder) 进行开放阅读框(ORF)查找,Conserved domains(CDD)进行蛋白结构域分析,bioXM用于编码区(CDS)蛋白翻译,采用DNAStar中的Protean进行蛋白质二级结构分析,DNAMAN进行多重序列比对分析。使用ProtParam 进行蛋白理化性质分析,TMHMM进行跨膜区分析,SignalP进行信号肽分析,用TargetP预测DoEMB8蛋白的亚细胞定位。
1.2.4 实时荧光定量PCR分析
为了研究铁皮石斛不同原球茎发育时期及不同组织中DoEMB8的表达量情况,本文采用RT-qPCR方法来对其表达量情况进行研究。以克隆拼接得到的基因序列为模板,根据荧光定量PCR引物设计原则,在基因3′端设计RT-qPCR引物,Tm值为55℃~65℃,引物长度介于18~30 bp之间,引物扩增长度为100~300 bp(表1)。以Actin作为内参基因,RT-qPCR实验采用TaKaRa的SYBR Premix ExTaqTMII (Tli RNaseH Plus) (TaKaRa, 大连),在Roche公司的LightCycler®96荧光定量PCR仪上进行,反应体积为10 μL: 5 μL SYBR Premix,0.8 μL (5 μmol)每个引物,2.9 μL ddH2O,0.5 μL cDNA,反应条件为:95℃预变性30 s;95℃变性5 s,60℃退火10 s,72℃延伸25 s,共40个循环;最后95℃ 10 s,65℃ 60 s,97℃ 1 s用于生成M值熔解曲线。同一样本反应设立3个技术重复孔,每种样本设立3次生物学重复实验,并设立阴性对照实验。技术重复误差采用仪器配套软件LightCycler®96 SW 1.1分析,所有技术重复误差均≤0.25,采用2-△△Ct计算方法进行相对表达量分析。

表1 RACE克隆及RT-qPCR引物
2 结果与分析
2.1DoEMB8序列结构分析
3′RACE克隆得到了348 bp的3′末端序列(图1),与转录组片段拼接后共得到2077 bp的基因序列,采用NCBI中的ORF Finder查找到最长的ORF位于14~1837 bp之间,编码608aa的氨基酸残基序列。利用DNASTAR中的Protean对DoEMB8蛋白质二级结构进行预测,结构分析如图2所示,该蛋白含有21个α螺旋,45个β折叠,33个γ转角及26个无规卷曲。NCBI的CDD结构域分析显示,该基因在124~445位氨基酸残基之间含有一个Abhydrolase super family结构域,在187~428位氨基酸残基之间含有一个Abhydrolase_1结构域特征,多重序列比对分析发现(图3),DoEMB8蛋白序列较为保守,尤其在结构域中保守性更高。

图1 RNA电泳图及DoEMB8 3′RACE扩增结果
A:泳道1~13分别代表原球茎形成、原分生组织形成、顶端分生组织、椭球形原球茎、叶原基维管系统形成、根端分生组织形成、原球茎退化、类原球茎PLB、根、茎、叶、花和种子RNA电泳图;B:表示3′RACE扩增结果
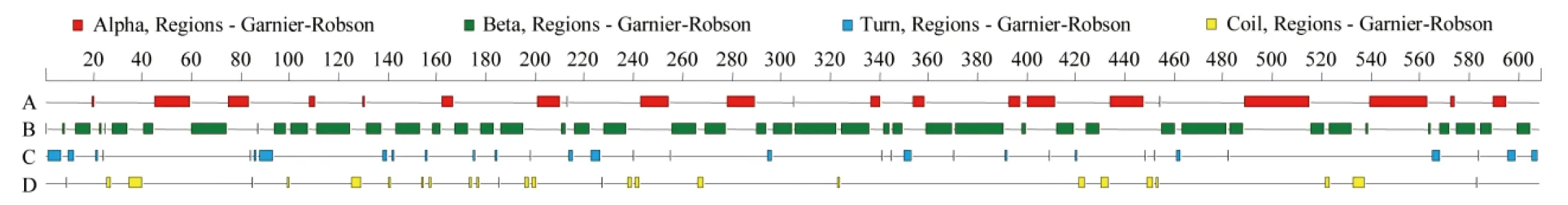
图2 铁皮石斛DoEMB8蛋白质二级结构预测
Fig 2 The secondary structure ofD.officinaleDoEMB8 protein
2.2 系统发育分析
从图4中可以看出,青梨(Pyrusxbretschneideri)、梅花(Prunusmume)、草莓(Fragariavescasubsp.vesca)、落花生(Arachisipaensis)、绿豆(Vignaradiatavar.radiata)、大豆(Glycinemax)聚为一支A;陆地棉(Gossypiumhirsutum)、麻风树(Jatrophacurcas)、蓖麻(Ricinuscommunis)聚为一支B;葡萄(Vitisvinifera)、巨桉(Eucalyptusgrandis)聚为一支C;甜菜(Betavulgarissubsp.vulgaris)、猴面花(Erythrantheguttata)、芝麻(Sesamumindicum)聚为一支D;荷花(Nelumbonucifera)单成一支E,以上几支A-E同属双子叶植物(I类)。铁皮石斛单成一支G;海枣(Phoenixdactylifera)、油棕(Elaeisguineensis)、小果野芭蕉(Musaacuminatasubsp.malaccensis)聚为一支H;菠萝(Ananascomosus)、狗尾草(Setariaitalica)、水稻(OryzasativaJaponicaGroup)、二穗短柄草(Brachypodiumdistachyon)、玉米(Zeamays)和甘蔗(SaccharumhybridcultivarR570)聚为一支I,且H和I两支与铁皮石斛情缘关系较近,它们们同属单子叶植物(II类)。而无油樟(Amborellatrichopoda)单成一支F,处于I类与II类之间,这与其在植物进化关系中自成一目一科一属的植物学分类特征相一致。
2.3 生物信息学分析
利用ProtParam在线软件对DoEMB8蛋白质进行理化性质分析,分子质量为67 049.9 u,等电点为6.55,带负电荷残基数(Asp+Glu)62,带正电荷残基数(Arg+Lys)59,分子式为C3013H4715N813O872S24,脂肪系数为96.83,亲水系数为0.062,不稳定系数为46.56,属于不稳定蛋白。采用TMHMM在线软件对DoEMB8蛋白的跨膜结构进行预测,结果如图5所示,该蛋白存在跨膜结构,在第60~82和571~593位氨基酸处含有两个跨膜螺旋结构,1~59位氨基酸和594~608位氨基酸处于细胞膜内,83~570位氨基酸处于细胞膜外(图5)。SignalP在线软件分析显示该蛋白不含信号肽(图6)。亚细胞定位分析表明,DoEMB8蛋白最有可能分布在线粒体中(0.165),存在与分泌通路的可能性为0.060,叶绿体为0.038,在其他地方的可能性为0.491。
2.4 表达量分析
根据2-△△Ct方法计算得到的DoEMB8的相对表达量如图7所示。从图7-A可以看出,DoEMB8在原球茎的7个不同原球茎发育时期表达量较为恒定,只是在根端分生组织形成(p7)时期表达量有所上升,而在由体胚诱导而来的类原球茎PLB中表达量较高,是种子萌发的原球茎形成时期(p2)的2.05倍,说明该基因在整个原球茎发育时期持续稳定表达。在不同组织中,DoEMB8在种子中的表达量最高(图7-B),较根中的表达量上升了3.16倍,在花中表达量最低,较根下降了4.32倍,叶中的表达量较根下降了1.45倍,茎和根的表达量较为一致,表明该基因在种子时期表达较不同组织中要高,也从侧面说明该胚胎发育相关基因在种胚及胚胎发育时期有着较高的表达量,可能在胚胎发育中起着重要作用。

图3 不同物种EMB蛋白多重序列比对分析

图4 不同植物EMB蛋白系统发育分析
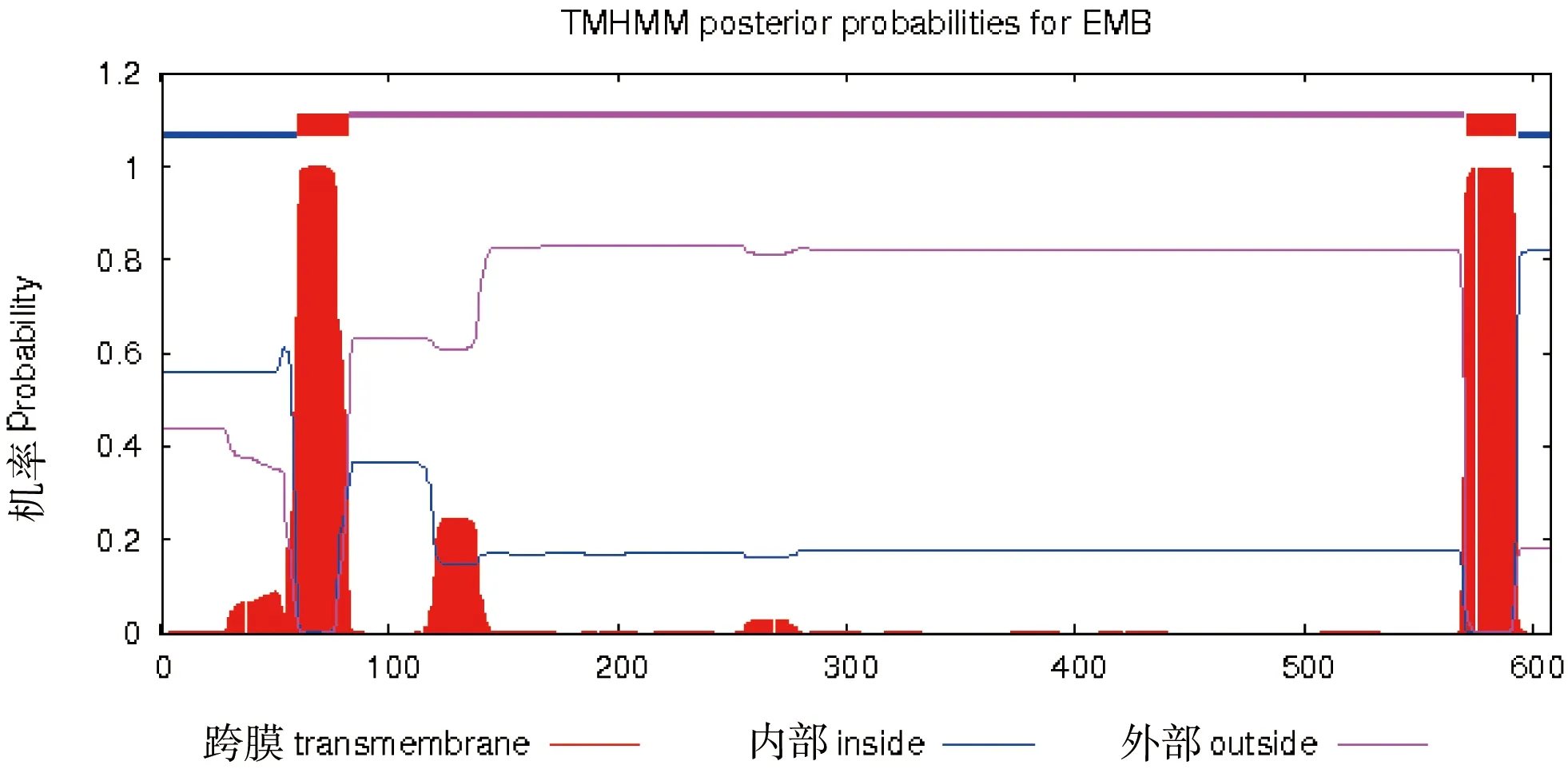
图5 DoEMB8蛋白跨膜结构预测
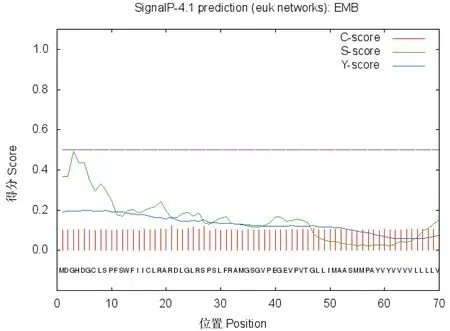
图6 DoEMB8蛋白信号肽预测
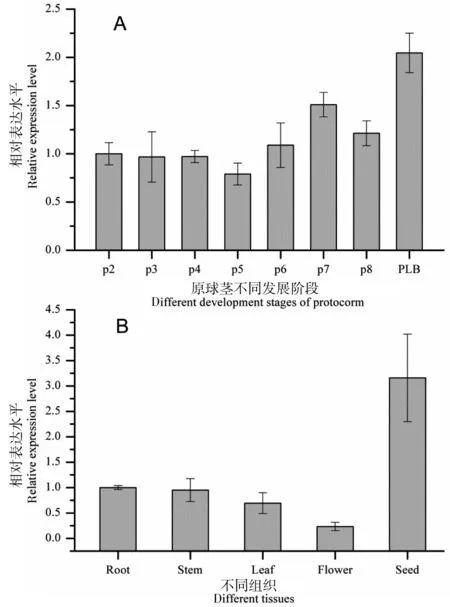
图7原球茎不同发育时期及不同组织中DoEMB8的表达量
A中p2~p8分别代表原球茎形成、原分生组织形成、顶端分生组织、椭球形原球茎、叶原基维管系统形成、根端分生组织形成、原球茎退化;PLB代表类原球茎时期
3 讨论
胚胎发生是植物生命周期中关键的阶段[8, 19],是一个精细和复杂的调控过程,按照预设的步骤进行一系列的生物学进程以完成胚胎发育[19]。虽然植物胚胎发生通常是在种子萌发的情况下研究的,但是植物胚胎的萌发也有其他可行的方法,如体细胞胚胎发生、小孢子胚胎发生、合子胚萌发等[20-21],这些胚胎发生模式是开花植物生命周期中重要的发育阶段[21-23]。最近,有研究证实,基于几个关键的胚胎发育过程标记,早期的胚胎发生可以当作研究植物发育的微型模型[24-25],但是与植物的其他生物学过程相比,由于植物早期胚胎材料太小难以获取,植物早期胚胎发生相关的分子机制仍有待继续探索研究[22]。
目前,拟南芥[22-23]、欧洲油菜[26]、水稻[25]、陆地棉[27]和黄瓜[28]中均已鉴定出胚胎发生相关基因,例如:Tzafrir等采用胚胎缺损突变体方法在拟南芥中鉴定出244个正常胚胎发育所需的EMB基因[29],但有关铁皮石斛胚胎发育相关基因的研究还鲜见报道。本研究中克隆得到的DoEMB8编码一个跨膜蛋白,含有两个跨膜螺旋结构,该蛋白含有自水解酶超家族结构域,且较为保守。分子进化分析显示DoEMB8同海枣(Phoenixdactylifera)、油棕(Elaeisguineensis)、小果野芭蕉(Musaacuminatasubsp.malaccensis)等单子叶植物的亲缘关系最近,能较好地反映植物分类学特征。
胚胎发生相关基因是植物胚胎发育阶段重要的基因,对该基因在胚胎不同发育时期的表达量进行定量分析,有助于预测该基因在植物整个胚胎发育期可能具有的功能。本研究中,DoEMB8在铁皮石斛原球茎不同发育时期表达量较为恒定,只是在根端分生组织形成时期表达量较其他时期较高,说明该基因在原球茎的发育历程中有着稳定的表达,对维持原球茎的生长可能具有重要作用,这也与Skevell成功地利用T-DNA标签技术分离到EMB30,且该基因在整个发育过程中持续表达所揭示的结果相一致[14]。而在由体胚诱导而来的类原球茎中,该基因的表达水平较种胚发育而来的原球茎要高出许多,说明虽然有着相似的形态特征,但体胚诱导的类原球茎与原球茎在基因表达方面却有着一定的差异。不同组织的表达水平分析显示,DoEMB8在根、茎、叶和花中的表达量都较低,且有着相似的表达水平,而在种子中的表达水平较高,明显高于前4种组织,表明DoEMB8在种子时期可能具有重要的作用,这也与该基因属于胚胎发育相关基因的注释信息相一致。
[1]ZHANG H, OGAS J. An epigenetic perspective on developmental regulation of seed genes[J]. Mol Plant, 2009, 2(4): 610-627.
[2]XIANG D, VENGLAT P, TIBICHE C, et al. Genomewide analysis reveals gene expression and metabolic network dynamics during embryo development in Arabidopsis[J]. Plant Physiol, 2011, 156(1): 346-356.
[3]YAZAWA K, TAKAHATA K, KAMADA H. Isolation of the gene encoding carrot leafy cotyledon1 and expression analysis during somatic and zygotic embryogenesis[J]. Plant Physiol Biochem, 2004, 42(3): 215-223.
[4]ZHANG J H, ZHANG S G, HAN S Y, et al. Genome-wide identification of microRNAs in larch and stage-specific modulation of 11 conserved microRNAs and their targets during somatic embryogenesis[J]. Planta, 2012, 236(2): 647-657.
[5]MAGIOLI C, BARRCO R M, ROCHA C A B, et al. Somatic embryo formation in Arabidopsis and eggplant is associated with expression of a glycine-rich protein gene (Atgrp-5 )[J]. Plant Science, 2001, 161(3): 559-567.
[6]BOWMAN J. Embryogenesis: Arabidopsis: an atlas of morphology and development[M]. New York: Springer-Verlag, 1993: 350-401.
[7]WEST M, HARADA J J. Embryogenesis in higher plants: an overview[J]. Plant Cell, 1993, 5(10): 1361-1369.
[8]GOLDBERG R B, DE PAIVA G, YADEGARI R. Plant embryogenesis: zygote to seed[J]. Science, 1994, 266(5158): 605-614.
[9]YADEGARI R, PAIVA G, LAUX T, et al. Cell differentiation and morphogenesis are uncoupled on Arabidopsis raspberry embryos[J]. Plant Cell, 1994, 6(12): 1713-1729.
[10]DONG J Z, DUNSTAN D I. Cloning and characterization of six embryogenesis-associated cDNAs from somatic embryos ofPiceaglaucaand their comparative expression during zygotic embryogenesis[J]. Plant Molecular Biology, 1999, 39(4): 859-864.
[11]GOLDBERG R B, BARKER S J, PEREZ-GRAU L. Regulation of gene expression during plant embryogenesis[J]. Cell, 1989, 56(2): 149-160.
[12]THOMAS T L. Gene expression during plant embryogenesis and germination: an overview[J]. Plant Cell, 1993, 5(10): 1401-1410.
[13]梁文裕, 陈 伟, 吕柳新. 植物胚胎发育时期特异蛋白的研究进展[J]. 福建农林大学学报(自然科学版), 2003, 32(1): 98-103.
[14]SHEVELL D E, LEU W M, GILLMOR C S, et al. Emb30 is essential for normal-cell division, cell expansion, and cell-adhesion in Arabidopsis and encodes a protein that has similarity to Sec 7[J]. Cell, 1994, 77(7): 1051-1062.
[15]陈金军, 张学文. 植物胚胎发生基因调控的研究进展[J]. 西北植物学报, 2004, 24(11): 2183-2187.
[16]FAN H H, LI T C, GUAN L, et al. Effects of exogenous nitric oxide on antioxidation and DNA methylation ofDendrobiumhuoshanensegrown under drought stress[J]. Plant Cell, Tissue and Organ Culture, 2012, 109(2): 307-314.
[17]FAN H, WU Q, WANG X, et al. Molecular cloning and expression of 1-deoxy-D-xylulose-5-phosphate synthase and 1-deoxy-D-xylulose-5-phosphate reductoisomerase inDendrobiumofficinale[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2016, 125(2): 381-385.
[18]BRAYBROOK S A, HARADA J J. LECs go crazy in embryo development[J]. Trends Plant Sci, 2008, 13(12): 624-630.
[19]PALOVAARA J, SAIGA S, WEIJERS D. Transcriptomics approaches in the early Arabidopsis embryo[J]. Trends Plant Sci, 2013, 18(9): 514-521.
[20]RADOEVA T, WEIJERS D. A roadmap to embryo identity in plants[J]. Trends Plant Sci, 2014, 19(11): 709-716.
[21]ZHAI L, XU L, WANG Y, et al. Transcriptional identification and characterization of differentially expressed genes associated with embryogenesis in radish (RaphanussativusL.)[J]. Scientific Reports, 2016, 6: 21652.
[22]XIANG D, VENGLAT P, TIBICHE C, et al. Genome-wide analysis reveals gene expression and metabolic network dynamics during embryo development in Arabidopsis[J]. Plant Physiology, 2011, 156(1): 346-356.
[23]SMERTENKO A, BOZHKOV P V. Somatic embryogenesis: life and death processes during apical-basal patterning[J]. Journal of Experimental Botany, 2014, 65(5): 1343-1360.
[24]PALOVAARA J, SAIGA S, WEIJERS D. Transcriptomics approaches in the early Arabidopsis embryo[J]. Trends Plant Sci, 2013, 18(9): 514-521.
[25]YANG X Y, ZHANG X L. Regulation of somatic embryogenesis in higher plants[J]. Critical Reviews in Plant Sciences, 2010, 29(1): 36-57.
[26]MALIK M R, WANG F, DIRPAUL J M, et al. Transcript profiling and identification of molecular markers for early microspore embryogenesis inBrassicanapus[J]. Plant Physiol, 2007, 144(1): 134-154.
[27]HU L, YANG X, YUAN D, et al. GhHmgB3 deficiency deregulates proliferation and differentiation of cells during somatic embryogenesis in cotton[J]. Plant Biotechnol J, 2011, 9(9): 1038-1048.
[28]WISNIEWSKA A, GRABOWSKA A, PIETRASZEWSKA-BOGIEL A, et al. Identification of genes up-regulated during somatic embryogenesis of cucumber[J]. Plant Physiol Biochem, 2012, 50(1): 54-64.
[29]TZAFRIR I, PENA-MURALLA R, DICKERMAN A, et al. Identification of genes required for embryo development in Arabidopsis[J]. Plant Physiol, 2004, 135(3): 1206-1220.
Cloning and expression analysis of embryogenesis-associated protein EMB8 (DoEMB8) inDendrobiumofficinaleKimuraetMigo
AN Hong-qiang, WANG Wan-jun
(School of Life Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China)
The embryogenesis-associated protein EMB8 (DoEMB8) inDendrobiumofficinaleKimuraetMigo was achieved by RACE and nest PCR technologies. The full length ofDoEMB8 was 2077 bp, contained an open reading frame (ORF) of 1824 bp that encoded 608 amino acid residues. Phylogenetic analysis showed that DoEMB8 had the closest relationship withPhoenixdactylifera,Elaeisguineensis,Musaacuminatasubsp.malaccensisand some other monocotyledon. DoEMB8 had 2 transmembrane helix structures and probably existed in mitochondrion analyzed by TMHMM and TargetP, respectively. RT-qPCR analysis showed that the expression level ofDoEMB8 was relatively constant in different development stages of protocorm, while it was higher in PLB(Protocorm like body) compared to that in protocorm. In different tissues, the expression level ofDoEMB8 was highest in seed and was 3.16 times higher than that in root, indicating thatDoEMB8 had relatively constant and higher expression level in embryonic development and may play an important role in plant embryonic development.
DendrobiumofficinaleKimuraetMigo; embryogenesis-associated protein EMB8; RACE; RT-qPCR
2016-08-01;
2016-08-10
国家自然科学基金委员会(31371232)
安红强,硕士研究生,主要从事植物发育生物学研究,E-mail:1528241699@qq.com
王万军,教授,主要从事植物发育生物学研究,E-mail:wanjunwang@home.swjtu.edu.cn
Q78
A
2095-1736(2017)04-0001-05
doi∶10.3969/j.issn.2095-1736.2017.04.001
