蛋白激酶C抑制剂GF109203X诱导角质形成细胞去分化形成表皮干细胞的初步研究
2017-08-16刘德伍付尚峰李梦芸李勇铁
叶 华,周 芬,刘德伍,付尚峰,李梦芸,李勇铁
蛋白激酶C抑制剂GF109203X诱导角质形成细胞去分化形成表皮干细胞的初步研究
叶 华,周 芬,刘德伍,付尚峰,李梦芸,李勇铁
目的 探讨蛋白激酶C(PKC)抑制剂GF109203X诱导角质形成细胞去分化形成表皮干细胞的可能性。方法 采用酶消化法结合Ⅳ型胶原快速贴壁法获得人原代表皮干细胞及角质形成细胞,倒置相差显微镜下观察细胞生长状况,免疫细胞化学染色法检测GF109203X诱导培养后角质形成细胞的表型及功能改变。同期分离培养的人在体表皮干细胞作为本次实验的阳性对照,原代角质形成细胞培养2 d后加等体积二甲基亚砜为阴性对照。结果 表皮干细胞快速黏附,培养4 d后细胞呈圆形,形态规则,折光性强,明显克隆,β1整合素、CK19及CK14呈阳性表达,CK10阴性表达;已分化角质形成细胞不能快速黏附,培养4 d细胞呈类圆形,大小不一,折光性较差,无明显克隆,β1整合素、CK19及CK14呈阴性表达,CK10呈阳性表达。角质形成细胞经GF109203X诱导培养2 d后,实验组与阳性对照组细胞群β1整合素、CK19、CK14均呈阳性表达,但实验组较阳性对照组中细胞β1整合素、CK19、CK14阳性细胞数少,CK10均呈阴性表达;阴性对照组中细胞群β1整合素、CK19及CKl4呈阴性表达,CKl0呈阳性表达。结论 GF109203X能够诱导角质形成细胞去分化形成表皮干细胞。
角质形成细胞;去分化;蛋白激酶C抑制剂;表皮干细胞
[J Pract Dermatol, 2017, 10(3):132-135]
去分化又称逆分化,是指已分化成熟的细胞和组织倒退分化,返回原始幼稚的状态,也就是细胞沿着与发育相反的方向从相对高分化的状态转变为低分化的状态,已分化成熟的终末细胞也可以转变为具有分化潜能的干细胞[1]。最近研究表明,miR-203被称为是皮肤特异性miRNA,与皮肤发育及其增殖分化特性改变密切相关。本课题组前期研究证实miR-203在表皮干细胞中表达明显低于角质形成细胞[2],而miR-203的表达依赖于蛋白激酶C(protein kinase C,PKC)通路的激活[3]。抑制PKC活性是否对角质形成细胞去分化有影响,目前少见文献报道。本研究以人角质形成细胞为研究对象,初步探讨PKC特异性抑制剂GF109203X诱导角质形成细胞去分化形成表皮干细胞的可能性,为进一步采用非转基因方法诱导角质形成细胞去分化形成诱导多能干细胞(induced pluripotent stem cells,iPSC)提供理论依据。
1 材料与方法
1.1 材料
湿法浮选脱炭是山东煤机装备集团利用新型高效浮选工艺进行脱炭的一种方法。由于残余的炭粒子是高度分散的疏水性颗粒,当粉煤灰浆体中加入浮选剂后,一方面,浮选剂与煤粒的亲和力比灰强;另一方面,由于浮选剂是一种异极性物质,能改变水中煤粒表面湿润性,使炭粒表面疏水性增强,从而附着于气泡上浮到水面,而使煤和灰分离,分别经浓缩、脱水后即得到有用的精煤和湿粉煤灰。湿粉煤灰经烘干、分选、粉磨之后,即得到优质粉煤灰。浮选废液循环利用。
包皮标本取材于2014年3—6月在本院泌尿外科行包皮环切术的青年男性,年龄16~30岁,所有取材经患者知情同意。
1.2.1 主要仪器与试剂 Sw-CJ-1F无菌超净工作台(苏州安泰空气技术有限公司);CX40型普通光学显微镜,Leica CTR6000荧光倒置相差显微镜,二氧化碳培养箱(美国Thermo Fisher Scientific公司);Anke TDL-50B自动平衡离心机(上海安亭科学仪器制造厂)。PKC抑制剂GF109203X购自美国Selleck公司,Ⅳ型胶原、DMSO购自Sigma公司,角质细胞无血清培养基Defined K-SFM、0.25%胰蛋白酶-EDTA、胎牛血清购自美国Gibco公司,鼠抗人β1整合素(1:100)、CK19(1:100)、CK14(1:100)、CK10(1:100)购自美国Abgent公司,PV-9000二步法免疫组化检测试剂盒及二氨基联苯胺(DAB)显色试剂盒购自北京中山金桥生物技术公司,PBS、D-HANK'S液购自美国Solarbio公司。
1.2 方法
利用测井资料的全部频率成分对地震时间剖面进行分析,补充了地震数据中缺失的低频成分,使得反演结果的分辨率可以突破地震分辨率的限制。该技术能够把地震资料与测井资料有机地结合起来,充分发挥地震横向分辨率高、测井在纵向上分辨率高的优势,将一般意义上的地震资料转换成与地层岩性信息密切相关的岩性地质剖面,便于进行储层预测。
倒置相差显微镜下观察,刚接种时实验组与阴性对照组角质形成细胞呈类圆形,大小不一,折光性较差。阳性对照组表皮干细胞分散较均匀,细胞呈圆形,形态规则,折光性强。孵育2 d后实验组(图1a)与阴性对照组(图1b)未见明显细胞克隆,细胞贴壁不牢固,细胞数量减少;阳性对照组(图1c)可见部分细胞克隆,细胞聚集成团。GF109203X诱导培养2 d后,实验组(图2a)部分细胞形成克隆,贴壁牢固;阴性对照组
1.2.3 PKC抑制剂GF109203X诱导角质形成细胞去分化形成表皮干细胞 将角质形成细胞分为PKC抑制剂实验组和阴性对照组,表皮干细胞组为阳性对照组。分别于分离培养2 d后换液,吸出培养基,1%双抗D-HANK'S冲洗3遍,实验组加含10 μmol/L GF109203X的Defined K-SFM培养基,阴性对照组加含同等剂量DMSO (4.1 μl) 的Defined K-SFM培养基,阳性对照组常规换液。37℃、5% CO2、饱和湿度孵箱中继续培养,每2天更换一次培养基,并观察细胞的生长情况。
1.2.2 在体表皮干细胞与角质形成细胞的分离与培养 ①Ⅳ型胶原包被培养皿的制备:Ⅳ型胶原溶于体积分数为0.1%的醋酸溶液至终浓度为100 mg/L,滤过除菌,4℃保存备用。将2张直径25 mm盖玻片放入直径60 mm培养皿中,细胞贴壁培养前40 min用配制好的Ⅳ型胶原溶液1~2 ml平铺其中,超净工作台内吹干。②表皮干细胞的分离与培养:采用胰蛋白酶消化法分离表皮,Ⅳ型胶原快速黏附法分离人表皮干细胞及角质形成细胞[4]。分别在由表皮生长因子、Defined K-SFM等组成的培养基中进行体外培养,倒置相差显微镜下观察两组细胞形态。
1.2.4 免疫细胞化学染色分析 各组细胞培养4 d后,吸去培养基,从培养皿中取出细胞爬片,PBS洗3次,每次5 min,4℃冰丙酮固定30 min,风干后PBS洗3次,每次5 min,0.3%TritonX-100破膜20 min,3%H2O2去离子水室温孵育10 min,以消除内源性过氧化物酶的活性,PBS洗3次,每次2 min。5%BSA封闭液,室温20 min,甩去多余液体,不洗。每张爬片滴加50 μl一抗(鼠抗人β1整合素、CK19、CK14、CK10,每次实验完成一个指标的测定),4℃孵育过夜,并分别设置PBS对照,PBS洗3次,每次2 min。滴加试剂1各50 μl,37℃孵育20 min,PBS洗3次,每次2 min;滴加试剂2各50 μl,37℃孵育20~30 min,PBS洗3次,每次2 min。DAB显色,自来水冲洗、复染、脱水、透明、封片。
3)同时在管道的两端安装配件是很好的操作。如果不能实现,只拆开配件包装的一端,将配件安装到管端。可将包装袋固定,将暴露的配件端遮盖住,使配件孔不受污染。
2 结果
2.1 GF109203X对角质形成细胞表型变化的影响
1.2.1 PKC抑制剂GF109203X的配制 PKC抑制剂GF109203X瓶装粉剂1 mg,充分溶解于200 μl DMSO,终浓度为10 μmol/L;分装,-80℃保存备用。诱导前将分装的PKC抑制剂GF109203X 4.1 μl与Defined K-SFM混合配成5 ml备用。
去分化是一个由核酸、酶、蛋白质等多层次调控网络参与的复杂生物学过程[5]。胚胎干细胞的自我更新基因Oct-4、Sox2、Nanog[6-8],锌指转录因子Klf4[9]及原癌基因c-myc[10]等均被报道与细胞去分化的调控密切相关。大量研究表明,去分化现象在不同等级的生物中普遍存在,只是表现水平不同而已。
免疫细胞化学染色显示,实验组细胞群β1整合素、CK19、CK14呈棕黄色阳性表达,而CK10染色未见明显阳性表达,具有表皮干细胞特征。阴性对照组细胞群β1整合素、CK19、CK14呈棕黄色阴性表达,而CK10阳性表达,符合角质形成细胞特征。阳性对照组细胞群β1整合 素、CK19、CK14呈棕黄色阳性表达细胞数目较实验组更多,CK10阴性表达(图3-图6)。
2.2 免疫细胞化学染色结果
线形生产建设项目产生的水土流失多发生在建设期,主要是临时堆土堆渣区和线路穿越区等。线形生产建设项目一般线路长达几百甚至几千公里,有些会跨越很多无人区或人迹罕至区,施工单位容易产生侥幸心理,因而在施工时图方便而肆意破坏植被的现象时有发生。
3) 凸轮偏心率mb越大,则ψ、ψ、ψ、μ的最大绝对值越大(图2和表1),γ、λ、σ、β的最大绝对值越大(式(8)和式(18)),Γm、Λm、Σm、Tm的值越大(式(19)),从而机构动力学性能越差。因此mb值不宜过大。
3 讨论
(图2b)细胞较前数量减少,未见明显细胞克隆,贴壁不牢固。阳性对照组(图2c)细胞常规换液,细胞形成明显克隆,贴壁牢固。

图1 接种2 d后表皮干细胞形态学观察(倒置相差微镜×100)
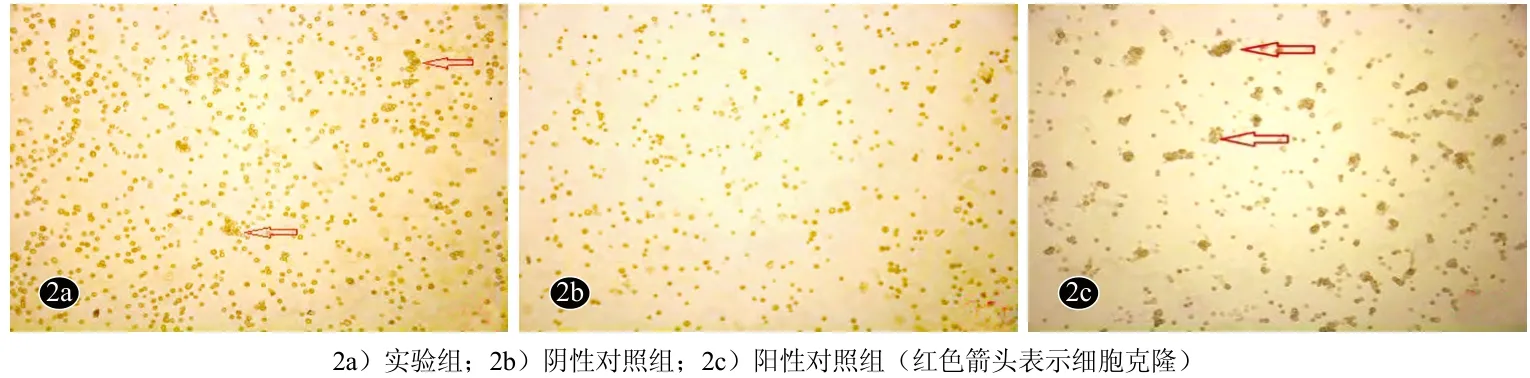
图2 GF109203X诱导培养2 d后表皮干细胞形态学观察(倒置相差微镜×100)

图3 GF109203X诱导培养后角质形成细胞β1整合素表达变化(SP法×100)

图4 GF109203X诱导培养后角质形成细胞CK19表达变化(SP法×100)
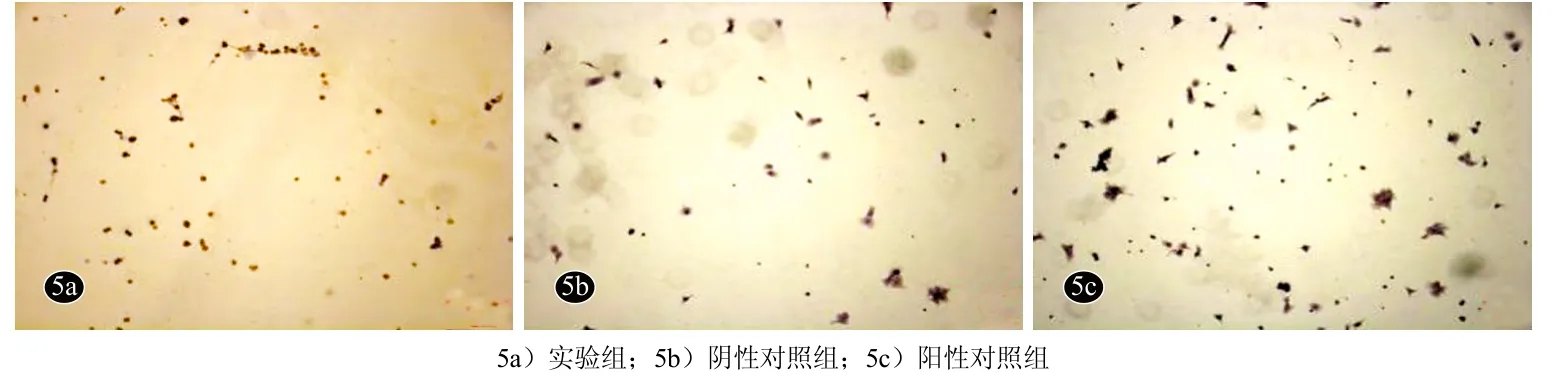
图5 GF109203X诱导培养后角质形成细胞CK14表达变化(SP法×100)

图6 GF109203X诱导培养后角质形成细胞CK10表达变化(SP法×100)
表皮干细胞(epidermal stem cells,ESCs)是皮肤组织特异性干细胞,增殖能力强,可以增殖分化为各种角质形成细胞,具有维持表皮自我更新、保持正常表皮结构以及促进创面修复等作用[11,12]。它的多向分化潜能在皮肤组织工程学中有着诱人的应用前景,是构建组织工程皮肤的重要种子细胞。表皮干细胞的表面标志是其分离鉴别的关键,目前常用的标志物有整合素、角蛋白、p63、p75EL角质形成细胞表面转铁蛋白受体CD71等。其中角蛋白是角质形成细胞的结构蛋白,随着细胞分化程度表达不同,可用于鉴别表皮干细胞、短暂扩增细胞及终末细胞。目前干细胞在皮肤组织中含量很少,尤其大面积皮肤缺损的患者,表皮干细胞数量进一步减少,这大大限制了其临床应用。研究表明利用角质形成细胞去分化途径来制造表皮干细胞,可以作为机体自身来源表皮干细胞的替代细胞应用于皮肤损伤重建和再生的相关研究[13]。若能将角质形成细胞逆向分化为表皮干细胞,可为皮肤组织工程提供丰富来源的种子细胞,为临床急、慢性创面和瘢痕的修复治疗带来新的希望。
表皮干细胞的终末分化是一个需要协调的基因表达程序的多步骤过程。宋志芳等[2]采用miRNA芯片检测技术比较表皮干细胞与角质形成细胞miRNA的表达差异,发现153个miRNA明显下调,而miRNA-203在表皮干细胞中下调最显著,31个miRNA在表皮干细胞中表达明显上调,靶基因预测提示miRNA与细胞的增殖和分化、凋亡和衰老等生物学特性变化密切相关。Yi等[14]发现miRNA-203通过限制表皮干细胞增殖潜能、诱导其退出细胞周期,从而促进角质形成细胞分化,下调miRNA-203则抑制细胞分化。miRNA-203上调诱导人角质形成细胞的分化依赖PKC/AP-1通路的激活,这一过程可被PKC特异性抑制剂GF109203X阻断[2]。
目前认为PKC至少有12种亚型,通常分为3类:①钙依赖型或经典型PKC(classical,cPKCs):由α、β1 、β2 、γ组成,激活时需依赖Ca2+,二酰甘油(DG)和磷脂酰丝氨酸(PS)或佛波酯(PMA);② 钙不敏感型或新型PKC(novel,nPKCs):由δ,ε,η和θ组成,它不需要Ca2+,但需要DG、PS或PMA;③非典型PKC(a typical,aPKCs):由ξ、λ、τ组成,仅需磷脂类物质激活而不依赖Ca2+、DG及PMA。GF109203X是一个高选择性的PKC抑制剂,其与PKCα、PKCβ1、PKCβ2及PKCγ结合后,竞争性抑制ATP与PKC的结合,从而高度抑制PKC的活性,导致PKC功能显著降低。
本研究实验组采用GF109203X终浓度为10 μmol/L,诱导培养原代角质形成细胞48 h后,部分细胞形成克隆,呈圆梭形,核浆比大,贴壁牢固;免疫细胞化学染色显示,实验组细胞群β1整合素、CK19、CK14呈棕黄色阳性表达,而CK10染色未见明显阳性表达,具有表皮干细胞特征。这可能与GF109203X抑制PKC活性,阻断miRNA-203上调依赖的PKC/AP-1通路使miRNA-203表达下调有关,从而使角质形成细胞逆分化为表皮干细胞。阴性对照组以DMSO替代F109203X,排除了溶媒导致假阳性结果的可能。然而这些细胞的功能与安全性仍有待研究,GF109203X诱导角质形成细胞逆分化为表皮干细胞相关机制也还需要进一步的深入研究。
基层党群工作要从基层党支部建设、思想政治工作和创新工作机制等方面入手。通过加强思想建设、组织建设、作风建设、廉政建设、班子建设等方面的建设统一思想认识,从而发挥出党支部的战斗堡垒作用。
GF109203X能够诱导角质形成细胞去分化形成表皮干细胞,为角质形成细胞去分化形成表皮干细胞提供了一条非转基因途径,促使我们去思考一种新的创伤愈合机制,从而提高皮肤组织内源性的再生能力,实现皮肤创伤由解剖修复到功能修复提供新的思路。
[1] 蔡飒, 付小兵, 盛志勇. 去分化:一种新的干细胞来源 [J]. 中华医学杂志, 2007(8):573-575.
[2] 宋志芳, 刘德伍, 李津. 不同发育阶段表皮细胞微小RNA的差异表达谱分析 [J]. 中华创伤杂志, 2014, 30(5):394-399.
[3] Deppe J, Steinritz D, Santovito D, et al. Upregulation of miR-203 and miR-210 affect growth and differentiation of keratinocytes after exposure to sulfur mustard in normoxia and hypoxia [J]. Toxicol Lett, 2016, 244:81-87.
[4] Greenwood-Goodwin M, Yang J, Hassanipour M, et al. A novel lineage restricted, pericyte-like cell line isolated from human embryonic stem cells [J]. Sci Rep, 2016, 6:24403.
[5] Hikichi T, Matoba R, Ikeda T, et al. Transcription factors interfering with dedifferentiation induce cell type-specific transcriptional profiles [J]. Proc Natl Acad Sci USA, 2013, 110(16):6412-6417.
[6] Okahara-Narita J, Umeda R, Nakamura S, et al. Induction of pluripotent stem cells from fetal and adult cynomolgus monkey fibroblasts using four human transcription factors [J]. Primates, 2012, 53(2):205-213.
[7] Buitrago W, Roop DR. Oct-4: the almighty POUripotent regulator? [J]. J Invest Dermatol, 2007, 127(2):260-262.
[8] Darr H, Mayshar Y, Benvenisty N. Overexpression of NANOG in human ES cells enables feeder-free growth while inducing primitive ectoderm features [J]. Development, 2006, 133(6):1193-1201.
[9] Nakatake Y, Fukui N, Iwamatsu Y, et al. Klf4 cooperates with Oct3/4 and Sox2 to activate the Lefty1 core promoter in embryonic stem cells [J]. Mol Cell Biol, 2006, 26(20):7772-7782.
[10] Buchholz DE, Pennington BO, Croze RH, et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium [J]. Stem Cells Transl Med, 2013, 2(5):384-393.
[11] 梅雪岭, 连石. p53蛋白在UVB诱导凋亡的富集表皮干细胞的角质形成细胞中的表达 [J]. 实用皮肤病学杂志, 2011, 4(4):197-199.
[12] Lewis CJ. Stem cell application in acute burn care and reconstruction [J]. J Wound Care, 2013, 22(1):7-8
[13] 孙晓艳, 卫勃, 付小兵, 等. 去分化来源表皮干细胞的分离与鉴定[J]. 解放军医学杂志, 2009, 34(3):293-296.
[14] Yi R, Poy MN, Stoffel M, et al. A skin microRNA promotes differentiation by repressing 'stemness' [J]. Nature, 2008, 452(7184):225-229.
A preliminary experimental study on dedifferentiation of epidermal keratinocytes into epidermal stem cells induced by protein kinase C inhibitor GF109203X
YE Hua,ZHOU Fen,LIU De-wu,et al
Institute of Burns, the First Affiliated Hospital of Nanchang University, Nanchang 330006, China
Objective To investigate the feasibility of dedifferentiation of epidermal keratinocytes into epidermal stem cells induced by protein kinase C inhibitor GF109203X. Methods Human primary epidermal stem cells and epidermal keratinocytes were obtained by enzyme digestion method and typeⅣcollagen coated chosen method. The cells were divided into 3 groups as follow: experimental group: primary epidermal keratinocytes were cultured for 2 days before treated with GF109203X, of which the final concentration was 10 μM; negative controlled group: the same volume of DMSO was given instead of GF109203X as in experimental group; positive controlled group: human primary epidermal stem cells cultured in the same period without any intervention except for changing medium every other day. Growth of the cells cultured in vitro was observed by inverted microscope. Monoclonal antibody of integrinβ1, keratin 19 (CK19), CK14, and CK10 were detected by immunocytochemical staining. Results Epidermal stem cells exhibited rapid adherence to typeⅣ collagen, the morphology of the cells was round, which had refractivity and formed distinct clones after 4 days culture, the expressions of integrinβ1, CK19 and CK14 were positive. Epidermal keratinocytes could not adhere rapidly to typeⅣ collagen, the morphology of the cells was close round, with different size, which had no refractivity and formed few clones after 4 days culture, the expression of CK10 was positive. Immunocytochemical staining showed that the expressions of integrinβ1, CK19 and CK14 were positive in experimental group and negative in negative controlled group, but the former exhibited less positive cells after being treated with GF109203X for 2 days, for the both of the two groups, CK10 expression was negative. Positive controlled group showed the opposite result: the expressions of integrinβ1, CK19 and CK14 were negative and CK10 was positive. Conclusion GF109203X may induce the epidermal keratinocytes to convertinto epidermal stem cells, which provide a nontransgenic approach for dedifferentiation of epidermal keratinocytes into epidermal stem cells. On the other hand, the result of the study may offer a new idea for dedifferentiation of epidermal keratinocytes into induced pluripotent stem cells (iPSC).
Keratinocytes epidermal;Dedifferentiation;Protein kinase C inhibitor;Epidermal stem cells
R329.2
A
1674-1293(2017)03-0132-04
2016-12-12
2017-05-13)
(本文编辑 耿建丽)
10.11786/sypfbxzz.1674-1293.20170302
330006 南昌,南昌大学第一附属医院烧伤研究所(叶华,刘德伍,付尚峰,李梦芸);江西省赣州市人民医院烧伤科(叶华);江西省上饶县妇幼保健院(周芬);江西省吉安市中心人民医院烧伤整形科(李勇铁)
叶华,硕士,住院医师,研究方向:创面修复,E-mail: yuyan8902@qq.com
刘德伍,E-mail: dewuliu@126.com
