脓肿分枝杆菌经Toll样受体2介导的JNK/ERK信号通路诱导巨噬细胞表达肿瘤坏死因子α和白细胞介素8
2017-08-16桂静王峰李青李金莉
桂静,王峰,李青,李金莉
深圳市慢性病防治中心病原检验科,深圳 518020
·论著·
脓肿分枝杆菌经Toll样受体2介导的JNK/ERK信号通路诱导巨噬细胞表达肿瘤坏死因子α和白细胞介素8
桂静,王峰,李青,李金莉
深圳市慢性病防治中心病原检验科,深圳 518020
为探讨脓肿分枝杆菌脓肿亚种和马赛亚种经Toll样受体2(Toll-like receptor 2,TLR2)介导的c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)诱导THP-1巨噬细胞内肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白细胞介素8(interleukin 8,IL-8)表达的相关分子机制,本研究将脓肿分枝杆菌脓肿亚种和马赛亚种感染THP-1巨噬细胞,细菌与巨噬细胞最佳感染之比为感染复数(multiplicity of infection,MOI)=3,用荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测THP-1巨噬细胞感染两细菌亚种6 h后的胞内TNF-α和IL-8 mRNA水平,以及分别阻断TLR2、JNK 和ERK信号蛋白后TNF-α和IL-8 mRNA水平的变化。结果显示,脓肿分枝杆菌脓肿亚种和马赛亚种作用于THP-1巨噬细胞6 h后,均可诱导细胞内TNF-α和IL-8 mRNA水平显著上调,差异有统计学意义(P<0.05);分别阻断TLR2、JNK和ERK信号蛋白,脓肿亚种感染THP-1巨噬细胞后胞内TNF-α和IL-8 mRNA上调水平出现明显抑制,差异有统计学意义(P<0.05);分别阻断TLR2和JNK信号蛋白,马赛亚种感染THP-1巨噬细胞后胞内TNF-α和IL-8 mRNA上调水平均出现明显抑制,差异有统计学意义(P<0.05);而阻断ERK信号蛋白后,马赛亚种组仅见IL-8 mRNA水平明显抑制,差异有统计学意义(P<0.05),而TNF-α mRNA水平未见明显变化,差异无统计学意义(P>0.05)。本研究提示,脓肿分枝杆菌脓肿亚种和马赛亚种均可作用于TLR2,诱导THP-1细胞内TNF-α和IL-8 mRNA水平上调,脓肿亚种可经JNK和ERK信号蛋白诱导TNF-α mRNA上调,马赛亚种可经JNK信号蛋白诱导TNF-α mRNA上调;脓肿亚种和马赛亚种诱导IL-8 mRNA上调可能与JNK和ERK信号蛋白相关。
分枝杆菌;Toll样受体;c-Jun氨基末端激酶;细胞外信号调节激酶
脓肿分枝杆菌是快速生长分枝杆菌中毒力最强的病原体。在快速生长分枝杆菌所致肺部疾病中,脓肿分枝杆菌肺部感染占65%~80%,在部分沿海地区占70%~80%,且感染率呈上升趋势[1-3]。目前,脓肿分枝杆菌划分为3个亚种:脓肿亚种(Mycobacteriumabscessussubsp.abscessus, Mabs)、马赛亚种(Mycobacteriumabscessussubsp.massiliense, Mmass)和bolletii亚种[4]。脓肿亚种和马赛亚种是近年来从深圳市脓肿分枝杆菌肺部感染病例中分离出的最主要亚种[5],由于对绝大多数临床使用的抗生素耐药,有效抗生素对其所致肺部感染主要起抑菌作用,导致感染往往迁延多年,成难治之症[2,6]。机体的免疫力状况在脓肿分枝杆菌感染的治疗和转归中起关键作用[7],但脓肿分枝杆菌脓肿亚种和马赛亚种对人体所致免疫反应与临床症状及转归之间的关系目前仍不清楚。
研究显示[7-9],脓肿分枝杆菌可诱导巨噬细胞内不同信号转导途径激活,从而在不同水平影响免疫细胞的激活,阻止脓肿分枝杆菌的体内扩散。Toll样受体(Toll-like receptor,TLR)可经丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径激活核因子κB(nuclear factor κB,NF-κB)基因,促进多种炎症细胞因子〔如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白细胞介素8(interleukin 8,IL-8)〕基因表达,调节巨噬细胞吞噬体-溶酶体融合反应,致炎性肉芽肿形成[10]。但TLR下游调节过程和机制还不清楚。巨噬细胞TLR2被认为与脓肿分枝杆菌诱导的巨噬细胞激活反应相关[7-10],本研究将探讨脓肿分枝杆菌脓肿亚种和马赛亚种诱导THP-1巨噬细胞表达TNF-α和IL-8的作用,分析TLR2和胞质MAPK中两种主要信号蛋白c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)对TNF-α和IL-8表达的调控作用,了解脓肿亚种与马赛亚种诱发的宿主天然免疫反应是否存在差异,为临床针对不同亚种开发有效治疗方案提供一定的理论依据。
1 材料与方法
1.1 细胞株和菌种
THP-1细胞株购自中国科学院干细胞库,脓肿分枝杆菌标准菌株ATCC 19977购自美国ATCC菌种保藏中心,脓肿亚种和马赛亚种由本实验室分离鉴定及保存[5]。
1.2 主要仪器和试剂
Roche Cobas Z480型实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪购自罗氏公司,Eppendorf高速低温离心机购自德国Eppendorf公司,7H9液体培养基干粉、7H10琼脂干粉和OADC购自美国BD公司,PRMI 1640培养液和胎牛血清购自美国Gibco公司,脂多糖(lipopolysaccharide,LPS)粉剂购自美国Life Technologies公司,佛波脂(phorbol 12-myristate 13-acetate,PMA)粉剂和anti-TLR2 mAb购自英国Abcam公司,RNAiso Plus、PrimeScript®Ⅱ 1st Strand cDNA 合成试剂盒和SYBR Premix Ex TaqTMⅡ购自TaKaRa公司。
1.3 菌株选择和培养
共11株菌株,包括参考标准菌株ATCC 19977 1株、脓肿亚种临床株和马赛亚种临床株各5株,均接种于7H9 液体培养基(含10% OADC),37 ℃培养增菌3 d。收集菌株,参照文献[11],80 ℃热灭活30 min,接种于7H10琼脂培养基,37 ℃培养4~5 d,进行菌落计数,要求99%以上细菌为死菌。
1.4 THP-1巨噬细胞培养、诱导转化和实验分组
用PRMI 1640+10%胎牛血清培养液培养THP-1细胞,每3 d传代1次,以密度(2~4)×105个/mL接种,取5×106个/mL进行实验与传代。用终浓度100 ng/mL的PMA作用于THP-1细胞48 h后,换无血清培养液继续培养2 d,约85% THP-1细胞转化为THP-1巨噬细胞,用于后续实验。调整细菌密度约1×108cfu/mL,细菌与THP-1巨噬细胞之比为感染复数(multiplicity of infection,MOI)=3,每株菌均单独感染THP-1巨噬细胞,并分为脓肿亚种组、马赛亚种组和ATCC 19977组,设LPS(作用浓度为100 ng/mL)组为阳性对照,设生理盐水(normal saline,NS)组为阴性对照。
1.5 荧光定量PCR检测THP-1巨噬细胞中TNF-α和IL-8 mRNA的表达
收集细菌感染6 h后的THP-1巨噬细胞,按RNAiso Plus说明书提取总RNA,检测总RNA浓度,纯度要求A260/280为1.8~2.0;反转录及PCR反应条件分别按PrimeScript®Ⅱ 1st Strand cDNA 合成试剂盒和SYBR Premix Ex TaqTMⅡ说明书进行。用2-△△Ct方法计算RNA相对表达量[12]。TNF-α、IL-8和内参基因β-actin mRNA引物参照文献[13-14]设计,由生工生物工程(上海)股份有限公司合成。引物序列如下:TNF-α-F:5′-AAGCC-TGTAGCCCATGTTGT-3′;TNF-α-R:5′-CAGAT-AGATGGGCTCATACC-3′;IL-8-F:5′-AGACA-TACTCCAAACCTT-3′;IL-8-R:5′-CTCTTCCA-TCAGAAAGCT-3′;β-actin-F:5′-CCAGAGCAA-GAGAGGCATCC-3′;β-actin-R:5′-GTGGTGG-TGAAGCT GTAGCC-3′。
1.6 TLR2、JNK和ERK信号蛋白阻断实验
分别选用TLR2阻断剂anti-TLR2 mAb(终浓度4 μg/mL)阻断TLR2 1 h,以及JNK阻断剂SP600125和ERK阻断剂U0126(终浓度20 μmol/L)预处理巨噬细胞45 min,加入细菌,荧光定量PCR检测THP-1巨噬细胞在感染细菌6 h后TNF-α和IL-8 mRNA水平,未加阻断剂组TNF-α和IL-8 mRNA水平参照1.5。
1.7 统计学分析
实验至少重复3次,采用SPSS 13.0软件进行t检验和单因素方差分析,P<0.05为差异有统计学意义。用Graphpad Prism 6.0软件进行统计并作图。
2 结果
2.1 不同细菌感染6 h对THP-1巨噬细胞中TNF-α和IL-8 mRNA水平的影响
脓肿亚种、马赛亚种、ATCC 19977、LPS和NS作用于THP-1巨噬细胞6 h后(图1),脓肿亚肿组TNF-α和IL-8 mRNA水平分别上调(11.27±2.03)倍和(9.37±0.86)倍,两细胞因子之间表达差异无统计学意义;马赛亚种组TNF-α和IL-8 mRNA水平分别上调(13.3±2.4)倍和(8.43±2.07)倍,两细胞因子之间表达差异有统计学意义(P<0.05);ATCC 19977组TNF-α和IL-8 mRNA水平分别上调(11.93±1.86)倍和(8.23±0.59)倍,两细胞因子之间表达差异有统计学意义(P<0.05);LPS组TNF-α和IL-8 mRNA水平分别上调(16.33±0.87)倍和(10.43±0.61)倍,两细胞因子之间表达差异有统计学意义(P<0.05)。马赛亚种组TNF-α mRNA水平上调略高于脓肿亚种组和ATCC 19977组,但差异无统计学意义;脓肿亚种组、马赛亚种组和ATCC 19977组IL-8 mRNA上调水平相似。

图1 不同细菌对THP-1巨噬细胞内TNF-α和IL-8 mRNA水平的影响
Fig.1 The levels of TNF-α and IL-8 mRNA in THP-1 cells
2.2 阻断TLR2对THP-1巨噬细胞中TNF-α和IL-8 mRNA水平的影响
阻断TLR2后,THP-1巨噬细胞中加入脓肿亚种、马赛亚种和ATCC 19977,6 h后巨噬细胞内TNF-α mRNA水平分别上调(3.67±1.23)、(5.44±1.52)和(4.39±1.86)倍,明显低于未加TLR2阻断剂的各细菌处理组,差异有统计学意义(P<0.01);IL-8 mRNA水平分别上调(2.76±1.37)、(3.06±1.04)和(3.13±0.43)倍,明显低于未加TLR2阻断剂的各细菌处理组,差异有统计学意义(P<0.01)(图2)。
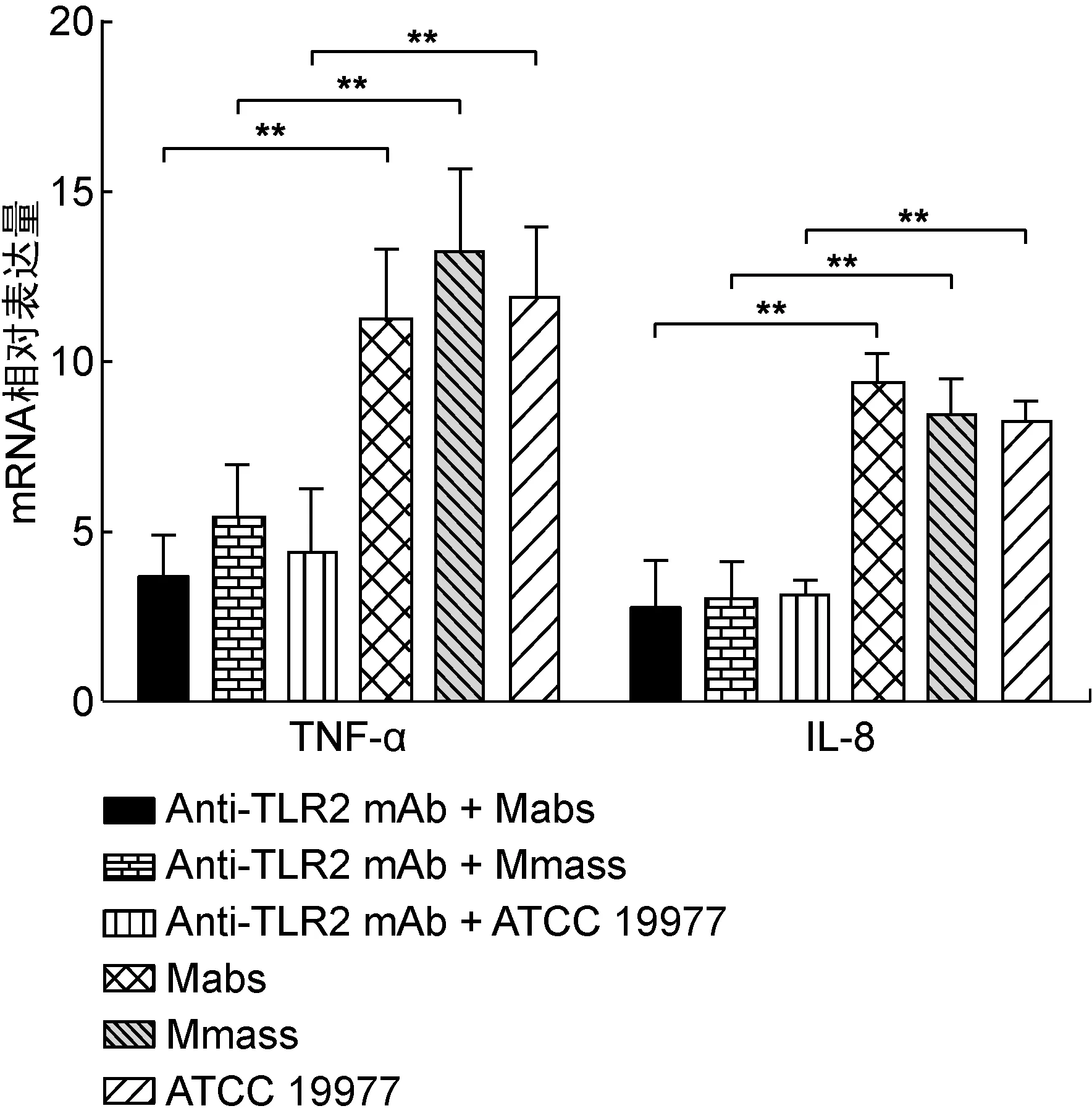
图2 TLR2阻断后THP-1巨噬细胞中TNF-α和IL-8 mRNA水平的变化
Fig.2 The levels of TNF-α and IL-8 mRNA in THP-1 cells after administration of anti-TLR2 mAb
2.3 阻断JNK和ERK信号通路对THP-1巨噬细胞中TNF-α和IL-8 mRNA水平的影响
应用JNK阻断剂SP600125阻断JNK蛋白,脓肿亚种、马赛亚种和ATCC 19977作用于THP-1巨噬细胞6 h后,脓肿亚种和马赛亚种组TNF-α mRNA水平分别上调(6.24±1.07)倍和(6.91±1.09)倍,均低于未加阻断剂的细菌处理组,差异有统计学意义(P<0.05);ATCC 19977组TNF-α mRNA水平上调(4.67±0.66)倍,低于未加阻断剂的ATCC 19977组,差异有统计学意义(P<0.01)。脓肿亚种、马赛亚种和ATCC 19977组IL-8 mRNA水平分别上调(2.31±1.22)、(1.38±0.37)和(1.90±0.61)倍,均低于未加阻断剂的各细菌处理组,差异有统计学意义(P<0.01)(图3A)。
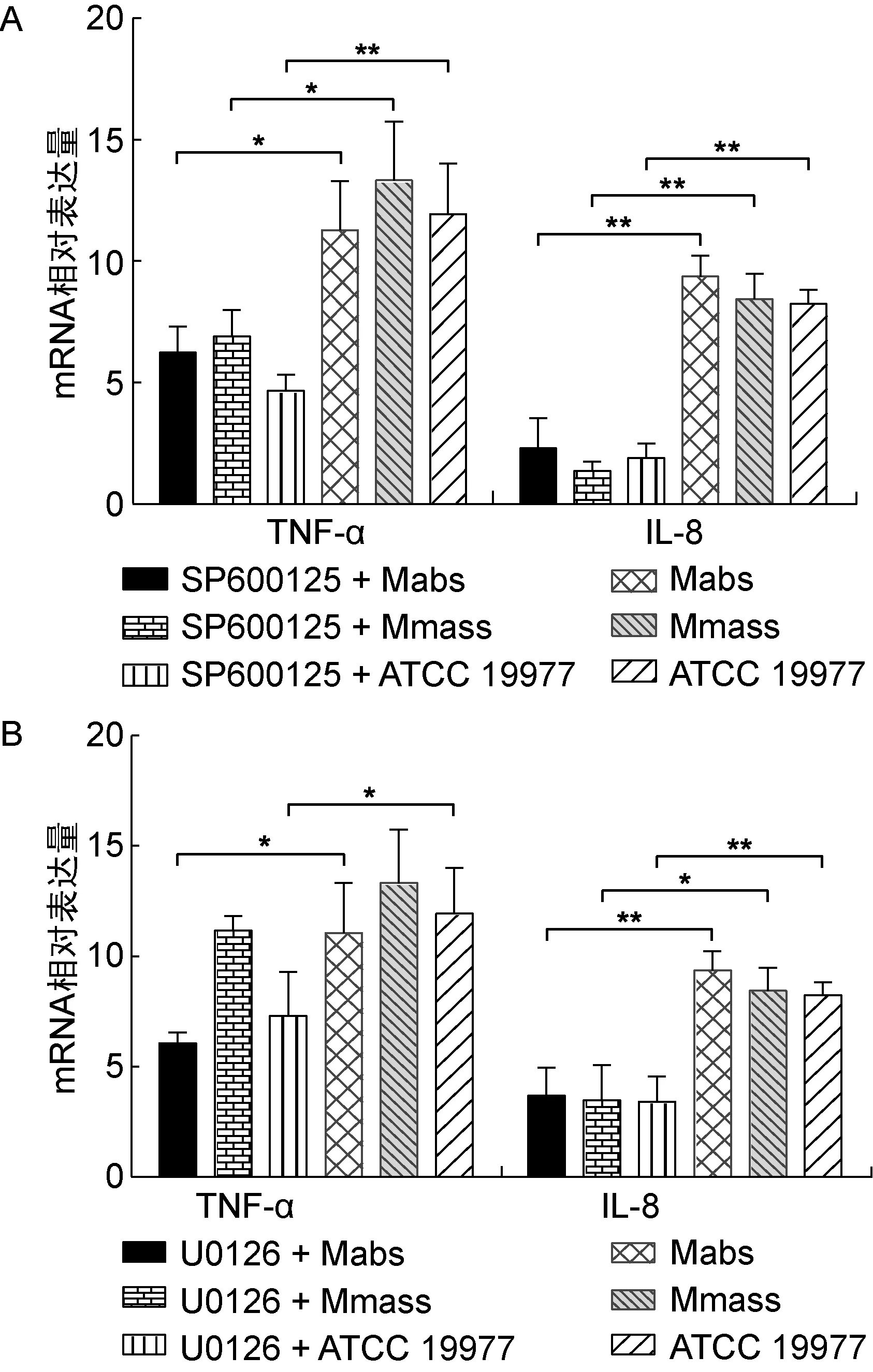
A:TNF-α mRNA level in THP-1 cells after administration of JNK inhibitor. B:IL-8 mRNA level in THP-1 cells after administration of ERK inhibitor.
图3 阻断JNK和ERK信号通路后THP-1巨噬细胞中TNF-α和IL-8 mRNA水平的变化
Fig.3 The levels of TNF-α and IL-8 mRNA in THP-1 cells after administration of JNK and ERK inhibitors
应用ERK阻断剂U0126,脓肿亚种、马赛亚种和ATCC 19977作用于巨噬细胞6 h后,TNF-α mRNA水平分别上调(6.06±0.48)、(11.17±0.65)和(7.30±2.00)倍;脓肿亚种组和ATCC 19977组TNF-α mRNA水平上调较未加阻断剂组显著下降,差异有统计学意义(P<0.05);马赛亚种组TNF-α mRNA水平与未加阻断剂组相比,差异无统计学意义(P>0.05)。脓肿亚种和ATCC 19977组IL-8 mRNA水平分别上调(3.69±1.29)和(3.43±1.13)倍,均低于未加阻断剂组,差异有统计学意义(P<0.01);马赛亚种组IL-8 mRNA水平上调(3.49±1.59)倍,低于未加阻断剂组,差异有统计学意义(P<0.05)(图3B)。
3 讨论
分枝杆菌与宿主相互作用中被研究最多的病原菌为结核分枝杆菌。结核分枝杆菌的不同成分可作用于不同的TLR通路,而TLR可调节巨噬细胞吞噬体与溶酶体的融合,其中TLR2具有广谱配体识别功能,包括分枝杆菌细胞壁组分。TLR下游MAPK通路中不同信号分子可调节巨噬细胞的吞噬作用,诱导NF-κB活化,上调多种免疫反应基因表达,参与T细胞等的激活和增殖[15-16]。针对脓肿分枝杆菌脓肿亚种和马赛亚种诱导巨噬细胞产生促炎症细胞因子的精细调节研究仍处于探索阶段。
鸟分枝杆菌感染健康人的外周血单核细胞,可诱导单核细胞分泌的TNF-α和IL-6升高[11]。从龟分枝杆菌和堪萨斯分枝杆菌细胞壁提取的脂甘露糖可诱导THP-1细胞分泌的TNF-α和IL-8升高[9-10]。本研究表明,脓肿亚种和马赛亚种感染巨噬细胞6 h后,均可诱导巨噬细胞内TNF-α和IL-8 mRNA水平上调,以TNF-α mRNA水平上调最明显,提示TNF-α是机体抗脓肿亚种和马赛亚种细胞免疫中的主要效应细胞因子之一;其次为IL-8 mRNA水平上调,提示两细菌亚种可诱导机体非特异性免疫产生一定量的IL-8,扩大免疫炎症反应,与相关文献报道相符[9-11]。马赛亚种组TNF-α mRNA水平上调作用高于脓肿亚种组和标准菌株ATCC 19977组,但差异无统计学意义,与Kim等[17]报道基本相符。马赛亚种组IL-8 mRNA水平上调与脓肿亚种组和ATCC 19977组差异无统计学意义。本研究初步表明,脓肿亚种、马赛亚种与标准菌株ATCC 19977诱导TNF-α和IL-8 mRNA水平上调的作用相当。
阻断TLR2后,脓肿亚种、马赛亚种和ATCC 19977组巨噬细胞内TNF-α和IL-8 mRNA水平呈明显下降趋势,表明分枝杆菌可经TLR2诱导THP-1细胞内TNF-α和IL-8的分泌[7-10]。阻断JNK信号蛋白后,脓肿亚种和马赛亚种组TNF-α mRNA水平均明显下降;阻断ERK信号蛋白后,脓肿亚种组TNF-α mRNA水平明显下降,而马赛亚种诱导的TNF-α mRNA水平未见明显抑制。表明脓肿亚种诱导的TNF-α表达与JNK和ERK信号蛋白相关,而马赛亚种诱导的TNF-α表达与JNK信号蛋白相关,与既往研究报道[11,17]相符。以上结果显示,脓肿分枝杆菌脓肿亚种与马赛亚种在经胞质MAPK途径诱导TNF-α表达时有不同的致炎机制。阻断JNK和ERK信号蛋白后,脓肿亚种、马赛亚种和ATCC 19977诱导的IL-8 mRNA水平上调的作用出现明显抑制,而针对脓肿亚种和马赛亚种作用于巨噬细胞致IL-8表达的分子信号途径未见相关报道,因此仍需进一步检测细胞因子分泌量和相应信号蛋白磷酸化水平来重复验证,脓肿亚种和马赛亚种诱导THP-1细胞内IL-8 mRNA水平上调可能与JNK和ERK信号蛋白相关。采用3种信号通路阻断剂后,脓肿亚种和马赛亚种组THP-1巨噬细胞内TNF-α和IL-8 mRNA水平仍表现为上调,不排除其经其他信号通路影响此两种细胞因子表达上调的可能。
综上所述,脓肿亚种和马赛亚种均可作用于TLR2,诱导THP-1细胞内TNF-α和IL-8 表达上调,脓肿亚种可经JNK和ERK信号蛋白诱导TNF-α表达上调,马赛亚种可经JNK信号蛋白诱导TNF-α表达上调,脓肿亚种和马赛亚种诱导IL-8表达上调可能与JNK和ERK信号蛋白相关。
[1] Harris KA, Kenna DT, Blauwendraat C, Hartley JC, Turton JF, Aurora P, Dixon GL. Molecular fingerprinting of Mycobacterium abscessus strains in a cohort of pediatric cystic fibrosis patients [J]. J Clin Microbiol, 2012, 50(5): 1758-1761.
[2] Choi WS, Kim MJ, Park DW, Son SW, Yoon YK, Song T, Bae SM, Sohn JW, Cheong HJ, Kim MJ. Clarithromycin and amikacin vs. clarithromycin and moxifloxacin for the treatment of post-acupuncture cutaneous infections due to Mycobacterium abscessus: a prospective observational study [J]. Clin Microbiol Infect, 2011, 17(7): 1084-1090.
[3] Howard ST, Rhoades E, Recht J, Pang X, Alsup A, Kolter R, Lyons CR, Byrd TF. Spontaneous reversion of Mycobacterium abscessus from a smooth to a rough morphotype is associated with reduced expression of glycopeptidolipid and reacquisition of an invasive phenotype [J]. Microbiology, 2006, 152(Pt 6): 1581-1590.
[4] Macheras E, Roux AL, Bastian S, Leão SC, Palaci M, Sivadon-Tardy V, Gutierrez C, Richter E, Rüsch-Gerdes S, Pfyffer G, Bodmer T, Cambau E, Gaillard JL, Heym B. Multilocus sequence analysis and rpoB sequencing of Mycobacterium abscessus (sensu lato) strains [J]. J Clin Microbiol, 2011, 49(2): 491-499.
[5] 桂静,李金莉,洪创跃,王峰.脓肿分枝杆菌复合群亚种鉴定的方法学研究 [J].中华结核和呼吸杂志,2014,37(7):512-516.
[6] 桂静,王峰,洪创跃,李金莉,梁静.龟分枝杆菌和脓肿分枝杆菌药物敏感性分析及E试验法应用评价 [J].中华结核和呼吸杂志,2013,36(8):567-571.
[7] Shin DM, Yang CS, Yuk JM, Lee JY, Kim KH, Shin SJ, Takahara K, Lee SJ, Jo EK. Mycobacterium abscessus activates the macrophage innate immune response via a physical and functional interaction between TLR2 and dectin-1 [J]. Cell Microbiol, 2008, 10(8): 1608-1621.
[8] Sim YS, Kim SY, Kim JE, Shin SJ, Koh WJ. Impaired expression of MAPK is associated with the downregulation of TNF-α, IL-6, and IL-10 in Mycobacterium abscessus lung disease [J]. Tuberc Respir Dis, 2012, 72(3): 275-283.
[9] Jönsson B, Ridell M, Wold AE. Phagocytosis and cytokine response to rough and smooth colony variants of Mycobacterium abscessus by human peripheral blood mononuclear cells [J]. APMIS, 2013, 121(1): 45-55.
[10] Vignal C, Guérardel Y, Kremer L, Masson M, Legrand D, Mazurier J, Lipomannans E. Lipomannans, but not lipoarabinomannans, purified from Mycobacterium chelonae and Mycobacterium kansasii induce TNF-alpha and IL-8 secretion by a CD14-Toll-like receptor 2-dependent mechanism [J]. J Immunol, 2003, 171(4): 2014-2023.
[11] Sampaio EP, Elloumi HZ, Zelazny A, Paulson ML, Sher A, Bafica AL, Shea YR, Holland SM. Mycobacterium abscessus and M.avium trigger Toll-like receptor 2 and distinct cytokine response in human cells [J]. Am J Respir Cell Mol Biol, 2008, 39(4): 431-439.
[12] Schmittgen TD, Livak KJ. Analyzing real time PCR data by the comparative CTmethods [J]. Nat Protoc, 2008, 3(6): 1101-1108.
[13] Wang M, Wang F, Yang J, Zhao D, Wang H, Shao F, Wang W, Sun R, Ling M, Zhai J, Song S. Mannan-binding lectin inhibits Candida albicans-induced cellular responses in PMA-activated THP-1 cells through Toll-like receptor 2 and Toll-like receptor 4 [J]. PLoS One, 2013, 8(12): e83517.
[14] So MY, Tian Z, Phoon YS, Sha S, Antoniou MN, Zhang J, Wu RS, Tan-Un KC. Gene expression profile and toxic effects in human bronchial epithelial cells exposed to zearalenone [J]. PLoS One, 2014, 9(5): e96404.
[15] Zhang H, Ouyang H, Wang D, Shi J, Ouyang C, Chen H, Xiao S, Fang L. Mycobacterium tuberculosis Rv2185c contributes to nuclear factor-κB activation [J]. Mol Immunol, 2015, 66(2): 147-153.
[16] 吴雪琼,张宗德,乐军.分枝杆菌分子生物学 [M].北京:人民军医出版社,2010:111-115.
[17] Kim TS, Kim YS, Yoo H, Park YK, Jo EK. Mycobacterium massiliense induces inflammatory responses in macrophages through Toll-like receptor 2 and c-Jun N-terminal kinase [J]. J Clin Immunol, 2014, 34(2): 212-223.
评选优秀论文通知
为更快、更好地传播微生物学与感染病学领域的研究发展和成果,提高本刊刊登的论文质量,提升作者论文的撰写水平,《微生物与感染》编委会决定每年举行优秀论文年度评选活动。从本刊当年刊登的文章中选取优秀论文予以表彰,设一等奖(奖金3 000元)、二等奖(奖金1 000元),所有奖金由复旦大学上海医学院“一健康基金”提供。获奖者除获得奖金之外,还将获取相应的荣誉证书和本刊次年全年杂志。望广大作者积极投稿。
《微生物与感染》编委会
. WANG Feng, E-mail: biowangfeng@163.com
Stimulated expressions of tumor necrosis factor α and interleukin 8 in macrophages challenged byMycobacteriumabscessusthrough TLR2, JNK and ERK pathways
GUI Jing, WANG Feng, LI Qing, LI Jinli
DepartmentofPathogenicLaboratory,ShenzhenCenterforChronicDiseaseControl,Shenzhen518020,China
The purpose of the current study is to investigate the molecular mechanisms of tumor necrosis factor α (TNF-α) and interleukin 8 (IL-8) mRNA expressions in THP-1 macrophages challenged byMycobacteriumabscessussubsp.abscessus(Mabs) andMycobacteriumabscessussubsp.massiliense(Mmass). The role of Toll-like receptor 2 (TLR2)-mediated c-Jun N-terminal kinase (JNK) and extracellular signal-regulated kinase (ERK) signaling pathways were investigated. First, THP-1 macrophages were cultured in the presence of Mabs and Mmass to stimulate cytokine expression . The mRNA expression levels of TNF-α and IL-8 were analyzed using quantitative reverse transcriptase-polymerase chain reaction (qRT-PCR) after 6 h. The levels of TNF-α and IL-8 mRNA after administration of anti-TLR2 mAb, JNK signaling inhibitor SP600125 and ERK signaling inhibitor U0126 were also detected. The results demonstrated that the levels of TNF-α and IL-8 mRNA in THP-1 cells were significantly upregulated by Mabs and Mmass for 6 h (P<0.05). The stimulated expressions of both TNF-α and IL-8 were significantly downregulated by anti-TLR2 mAb, JNK inhibitor or ERK inhibitor, respectively. It was thus concluded that both Mabs and Mmass could upregulate TNF-α and IL-8 mRNA expressions through TLR2-mediated JNK and ERK pathways.
Mycobacterium; Toll-like receptor; c-Jun N-terminal kinase; Extracellular signal-regulated kinase
王峰
2016-08-22)
猜你喜欢
——和田盘羊
