BALB/c小鼠作为单纯疱疹病毒1型感染模型的免疫学分析
2017-08-16张小龙汤贝贝何玉凤段永忠王丽春张志晓周巨民李琦涵
张小龙,汤贝贝,何玉凤,段永忠,王丽春,张志晓,周巨民,李琦涵
1. 中国医学科学院北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室,昆明 650118; 2. 中国科学院/云南省动物模型与人类疾病机理重点实验室,中国科学院昆明动物研究所,昆明 650223
·论著·
BALB/c小鼠作为单纯疱疹病毒1型感染模型的免疫学分析
张小龙1,*,汤贝贝1,*,何玉凤1,段永忠1,王丽春1,张志晓1,周巨民2,李琦涵1
1. 中国医学科学院北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室,昆明 650118; 2. 中国科学院/云南省动物模型与人类疾病机理重点实验室,中国科学院昆明动物研究所,昆明 650223
在单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)小鼠感染及其相关研究中,临床病理和免疫学指标对其分析具有重要技术意义。本研究观察了HSV-1在不同条件下感染BALB/c小鼠后的多个免疫学指标,包括外周血单核细胞(peripheral blood mononuclear cell,PBMC)群体中树突细胞比例及功能、血清中和抗体水平、PBMC中HSV-1抗原特异性T细胞水平,以及潜伏感染期小鼠神经组织中CD8+T细胞浸润情况。结果显示,HSV-1毒株Mckrae、17+以角膜及滴鼻途径感染3周龄及6周龄BALB/c小鼠后,小鼠PBMC中树突细胞数量增加,并显示出刺激病毒抗原特异性T细胞增殖的能力。病毒感染后35 d,小鼠PBMC中未检测到白细胞介素4(interleukin 4,IL-4)+抗原特异性T细胞,但能检测到低水平的γ干扰素(interferon γ,IFN-γ)+抗原特异性T细胞;小鼠血清中未检测到或仅能检测到低水平的中和抗体。HSV-1以皮下及足垫注射途径感染BALB/c小鼠90 d后,足垫感染途径较皮下感染诱导出更高水平的血清中和抗体,PBMC中可检测到IL-4+及IFN-γ+抗原特异性T细胞,但不同毒株及小鼠周龄之间出现T细胞反应程度差异。组织病理学结果表明,各组小鼠三叉神经组织中均有CD8+T细胞浸润。这些结果提示,不同HSV-1毒株以不同途径感染不同周龄BALB/c小鼠后,均可刺激树突细胞成熟及呈递病毒抗原,但血清中和抗体及PBMC中病毒抗原特异性T细胞水平在不同毒株、感染途径及小鼠周龄之间有差异。
BALB/c小鼠;单纯疱疹病毒1型;免疫学分析
单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)是一种在人群中广泛传播的病原体,感染人体后可分为急性感染、潜伏感染和病毒重激活几个阶段。急性感染常表现为无临床症状或皮肤、黏膜的疱疹病变,然后病毒可沿感染部位神经末梢逆轴突方向入侵感觉神经组织,并在神经细胞中形成终生潜伏感染[1]。此时病毒基因组保留在受感染细胞中,但基本不表达相关功能蛋白[1]。在外界刺激因素诱导下,潜伏于神经细胞的病毒基因组开始复制并表达病毒蛋白,最终组装出感染性病毒颗粒,完成重激活过程。随后感染性病毒沿神经细胞顺轴突方向传播,回到初始感染部位,导致无症状的排毒,或口唇疱疹、疱疹性角膜炎,在免疫缺陷个体中重激活亦可导致疱疹性脑炎并危及生命[1]。
BALB/c小鼠是一种研究HSV-1感染与免疫的常用动物模型[2]。BALB/c小鼠感染HSV-1后可表现出角膜炎、后肢麻痹、死亡等一系列临床症状。HSV-1可有效潜伏于小鼠感觉神经元中。在以小鼠为模型的HSV-1研究中,不同的研究者利用不同的HSV-1毒株、不同的攻毒途径和不同周龄的小鼠[2],而这些变量如何影响小鼠针对HSV-1的免疫反应尚无明确界定。因此,利用小鼠模型评价治疗与预防HSV-1感染的药物及疫苗时,如何用具有客观意义的指标分析该动物模型中HSV-1感染的免疫反应特征具有重要技术意义。本研究观察了不同HSV-1毒株以不同方式感染不同周龄BALB/c小鼠后表现出的急性感染及慢性感染过程中的免疫反应特征,以期反映其感染小鼠过程中具有系统意义的综合数据。
1 材料与方法
1.1 动物与病毒
3周龄及6周龄无特定病原体(specific pathogen free,SPF)级雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司。HSV-1毒株Mckrae、17+经Vero细胞传代,由中国医学科学院医学生物学研究所病毒免疫室保存。
1.2 病毒感染
将HSV-1毒株Mckrae、17+分别以不同途径感染3周龄及6周龄小鼠,感染剂量均为1×104PFU/只。将病毒用磷酸盐缓冲液(phosphate buffered saline,PBS)稀释至相应浓度。角膜感染组用移液器吸取病毒液滴于小鼠角膜处,左、右眼角膜各滴2.5 μL,每只小鼠共5 μL;滴鼻感染组用移液器吸取病毒液滴于小鼠鼻腔内,左、右鼻腔各滴2.5 μL,每只小鼠共5 μL;足垫感染组用1 mL注射器吸取病毒液注射入小鼠左后肢足垫,每只小鼠共20 μL;皮下感染组用1 mL注射器吸取病毒液注射入小鼠背部皮下,每只小鼠共20 μL;对照组则以相应方法注射等量PBS。
1.3 试剂
小鼠淋巴细胞分离液购自美仑生物,GlogiPlug、Cytofix/Cytoperm、PE-Cy7-CD11c、PE-CD80、APC-CD86、PerCP-Cy5.5-MHCII、FITC-IL12p70、PE-CD8α购自BD公司,CD11c MicroBeads mouse-lyophilized分选试剂盒购自Miltenyi Biotec公司,Mouse IFN-γ ELISpotPLUS、Mouse IL-4 ELISpotPLUS试剂盒购自Mabtech公司。多肽由生工生物工程上海(股份)有限公司合成。
1.4 树突细胞数量及表型检测
攻毒后第3天,采集小鼠外周血,每组3只,密度梯度离心法分离外周血单核细胞(peripheral blood mononuclear cell,PBMC),于含10% 胎牛血清(fetal bovine serum,FBS)的RPMI 1640培养基中37 ℃、5% CO2条件下培养12 h;然后向培养液中加入1 μL/mL的GlogiPlug,并继续于37 ℃、5% CO2条件下培养12 h;利用相应抗体对细胞表面分子进行染色,Cytofix/Cytoperm对细胞进行固定及破膜,相应抗体对胞内细胞因子染色,并进行流式细胞检测。
1.5 树突细胞刺激T细胞功能检测
攻毒后第3天,采集小鼠外周血,每组3只,分离PBMC,按CD11c MicroBeads mouse-lyophilized分选试剂盒说明书分选出CD11c+树突细胞,通过尾静脉将1×104个CD11c+树突细胞分别注射入6周龄雌性BALB/c小鼠体内,每组3只,静脉注射7 d后分离受体小鼠PBMC,以HSV-1多肽gB498-505和RR822-829为刺激物(10 μg/mL),酶联免疫斑点法(enzyme-linked immunospot assay,ELISpot)检测PBMC中抗原特异性γ干扰素(interferon γ,IFN-γ)+T细胞数量。
1.6 血清中和抗体效价检测
采集小鼠外周血,每组4只,分离血清,用MEM培养基进行1∶4、1∶8 …… 1∶512系列稀释,HSV-1用MEM培养基稀释至2×103CCID50/mL。取50 μL稀释后的血清和50 μL稀释后的病毒加入96孔板,37 ℃、5% CO2条件下孵育2 h。然后将Vero细胞消化,置于含2% FBS的MEM溶液中,加入96孔板,每孔100 μL,共(2~3)×105个细胞,于37 ℃、5% CO2条件下培养,7 d后观察细胞病变效应(cytopathic effect,CPE)。
1.7 IFN-γ+、白细胞介素4(interleukin 4,IL4)+抗原特异性T细胞检测
采集小鼠外周血并分离PBMC,每组3只,用Mouse IFN-γ ELISpotPLUS和Mouse IL-4 ELISpotPLUS试剂盒,以HSV-1多肽gB498-505和RR822-829为抗原刺激物(10 μg/mL),ELISpot法检测小鼠PBMC中抗原特异性IFN-γ+、IL4+T细胞数量,操作按试剂盒说明书进行。
1.8 三叉神经组织中CD8+T细胞检测
HSV-1感染小鼠后第90天,分离小鼠三叉神经组织,取8 μm冷冻切片,用PE-CD8α抗体及4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染色,荧光共聚焦显微镜下观察。
1.9 统计分析
统计分析采用GraphPad Prism 5软件,数据以mean±SD表示,采用两独立样本均数t检验,P<0.05为差异有统计学意义。
2 结果
2.1 树突细胞表型及功能检测
树突细胞是机体内重要的专职抗原呈递细胞,通常在感染部位吞噬入侵抗原后其表型及功能逐渐成熟,表现为上调细胞表面主要组织相容性复合物(major histocompatibility complex,MHC)Ⅱ类分子及共刺激分子CD80和CD86表达,上调IL-12分泌,并移出感染部位,通过外周循环进入外周淋巴组织[3]。功能成熟的树突细胞依据趋化因子信号导向转移至外周淋巴组织后,能有效向初始T细胞呈递抗原并活化T细胞[3]。为观察HSV-1感染BALB/c小鼠后树突细胞对病毒抗原的呈递功能,检测不同攻毒条件组病毒感染BALB/c小鼠3 d后PBMC中CD11c+树突细胞的比例及其表面MHCⅡ、CD80、CD86分子的表达量和IL-12的分泌量。结果显示,除6周龄滴鼻感染组外,其余各组PBMC中树突细胞比例较对照组均有所增加,但各组间未见显著差异(图1A、1B);各攻毒组树突细胞表面CD80、CD86分子较对照组均有所上调,6周龄滴鼻感染组树突细胞中IL-12分泌细胞数量有所增加,其余各组未见改变(图1C)。各攻毒组间树突细胞表面MHCⅡ分子表达量整体趋于一致,与对照组相比未见明显改变。将各组小鼠感染病毒后第3天PBMC中的CD11c+树突细胞分离出来,通过尾静脉注射入未感染病毒的BALB/c小鼠,以考察负载了HSV-1抗原的树突细胞在体内刺激初始T细胞增殖的能力。结果显示,与对照组相比,各感染组分离的树突细胞在体内均显示出刺激HSV-1抗原特异性初始T细胞增殖的能力,除3周龄角膜感染组外,其他组树突细胞刺激T细胞的能力略有不同,但未见显著性差异(图2)。
2.2 血清中和抗体动态变化检测
经角膜和滴鼻途径感染小鼠后,持续检测其血清中抗HSV-1中和抗体水平。结果显示,仅在17+毒株角膜途径感染6周龄小鼠后第21天开始检测到低水平的血清中和抗体,其余攻毒组血清中和抗体检测均为阴性(图3)。
A: Flow cytometry plot of CD11c+cell rate in PBMCs. B: CD11c+cells in PBMCs. C: Phenotype of CD11c+cells in PBMCs.
图1 HSV-1感染后第3天PBMC中CD11c+细胞数量及表型检测
Fig.1 CD11c+cell rate and phenotype in PBMCs 3 d after HSV-1 infection
图2 树突细胞刺激病毒抗原特异性T细胞增殖的功能检测
Fig.2 Virus specific T cells stimulated by dendritic cells

图3 血清中和抗体效价动态变化
Fig.3 Dynamic changes in neutralizing antibody titer
2.3 HSV-1抗原特异性T细胞水平检测
分别于角膜和滴鼻途径感染小鼠后14 d及35 d 检测PBMC中HSV-1抗原特异性T细胞数量。结果显示,攻毒后第14天各组均未检测到IFN-γ+及IL-4+细胞,攻毒后第35天各组均能检测到少量IFN-γ+细胞,但未检测到IL-4+细胞(图4)。
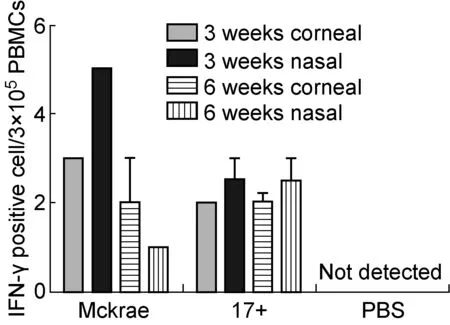
图4 HSV-1感染后第35天PBMC中HSV-1抗原特异性T细胞水平
Fig.4 HSV-1 specific T cell rate in PBMCs 35 d after infection
2.4 慢性感染小鼠抗HSV-1特异性免疫反应检测
利用足垫注射和皮下注射攻毒途径,探索HSV-1感染BALB/c小鼠后第90天小鼠体内抗HSV-1特异性体液免疫及细胞免疫反应。结果显示,血清中和抗体出现阳性反应,不同攻毒途径之间表现出差异,足垫注射攻毒组较皮下注射攻毒组中和抗体水平更高,而不同毒株及不同周龄小鼠之间未观察到显著差异(图5)。各感染组PBMC中均能检测到针对HSV-1抗原的IFN-γ+和IL-4+T细胞,但不同感染组IFN-γ+T细胞数量有显著差异。对于3周龄小鼠,17+毒株感染组IFN-γ+T细胞数较Mckrae毒株感染组更高(图6)。在不同周龄17+毒株攻毒组中,3周龄小鼠IFN-γ+T细胞数较6周龄小鼠更高(图6),但不同感染组针对HSV-1抗原的IL-4+T细胞数量未见显著差异(图6)。
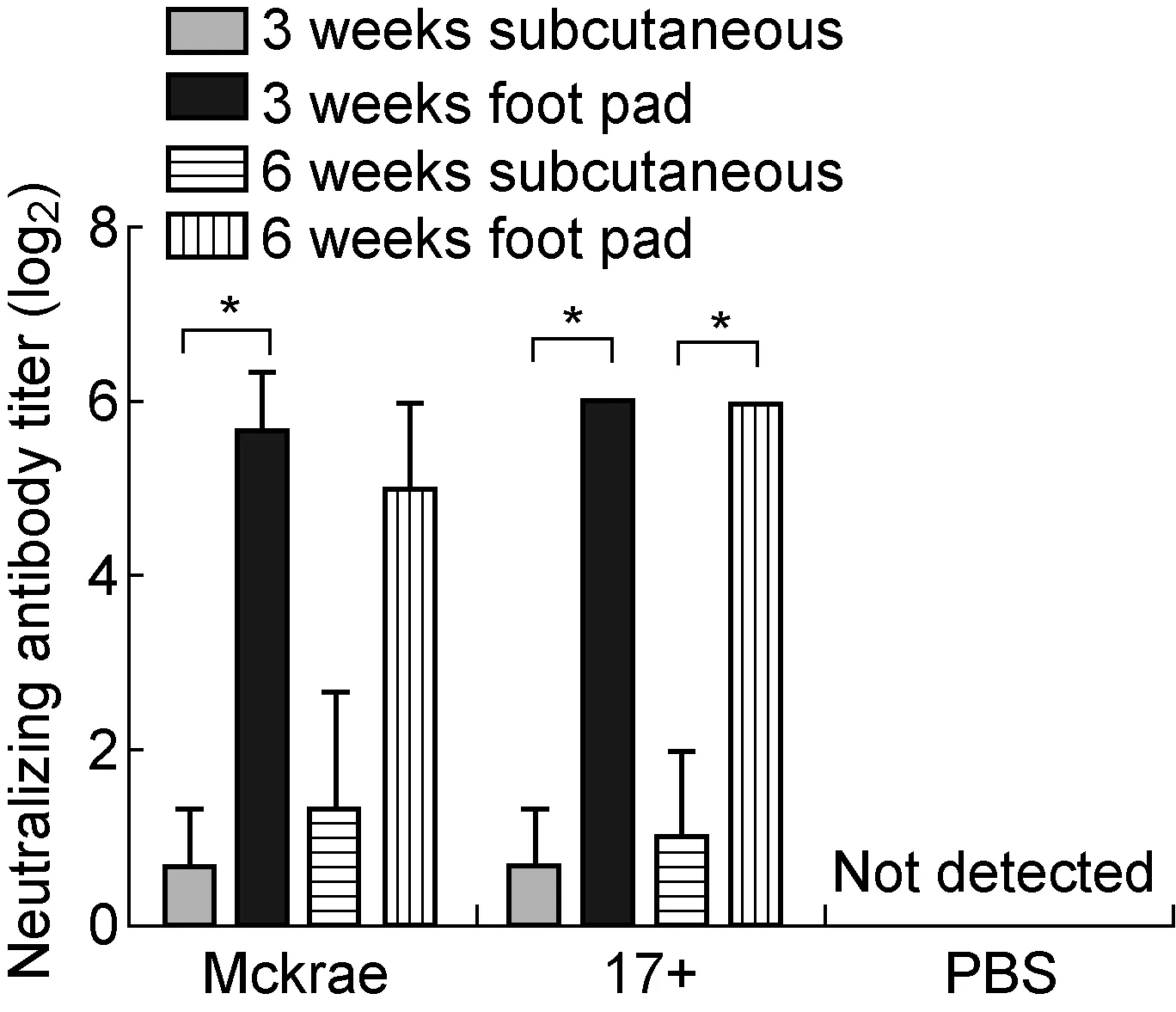
图5 HSV-1感染后第90天血清中和抗体水平
Fig.5 Neutralizing antibody titer 90 d after HSV-1 infection
HSV-1主要潜伏于小鼠运动神经细胞中。有研究认为,聚集于这些神经细胞周围的CD8+T细胞对HSV-1潜伏状态的维持具有重要作用[4]。利用免疫组化荧光染色技术,检测皮下和足垫注射感染组HSV-1攻毒后第90天小鼠三叉神经组织中CD8+T细胞的浸润情况。结果显示,各感染组小鼠三叉神经组织中均能检测到CD8+T细胞浸润,对照组未观察到CD8+T细胞浸润(图7)。
3 讨论
树突细胞对机体抗病毒免疫反应至关重要,其吞噬病毒抗原后逐步下调抗原摄取能力,上调刺激T细胞能力,经历了功能成熟过程后,成为体内可激活初始T细胞的抗原呈递细胞,是连接天然免疫与特异性免疫的桥梁[5]。本研究观察到,不同HSV-1毒株以不同攻毒方式感染不同周龄BALB/c小鼠后,除6周龄滴鼻感染组外其余各组PBMC中的树突细胞数量均有所增加,各组小鼠在感染病毒后树突细胞表面共刺激分子CD80、CD86表达量均有所上调,6周龄滴鼻感染组IL-12分泌细胞数量有所上调,其余组未见明显上调。PBMC中树突细胞比例增加预示有更多树突细胞进入外周血液循坏,并有可能被趋化到外周淋巴系统中,而树突细胞表面共刺激分子表达量的上调及IL-12分泌细胞的增加则显示树突细胞正经历功能成熟的过程。虽然PBMC中树突细胞数量及表面共刺激分子表达量在各感染组之间有所不同,但整体上未见显著差异;与此相对应,各组树突细胞在体内刺激HSV-1抗原特异性初始T细胞增殖的能力也大致相同。结果表明,不同HSV-1毒株以不同途径感染不同周龄BALB/c小鼠后,小鼠体内树突细胞功能成熟及淋巴结趋化动力学略有差异,但均能有效地从病毒感染部位摄取病毒抗原,并在完成功能成熟后刺激HSV-1抗原特异性初始T细胞增殖,以启动下游的特异性抗病毒免疫反应。
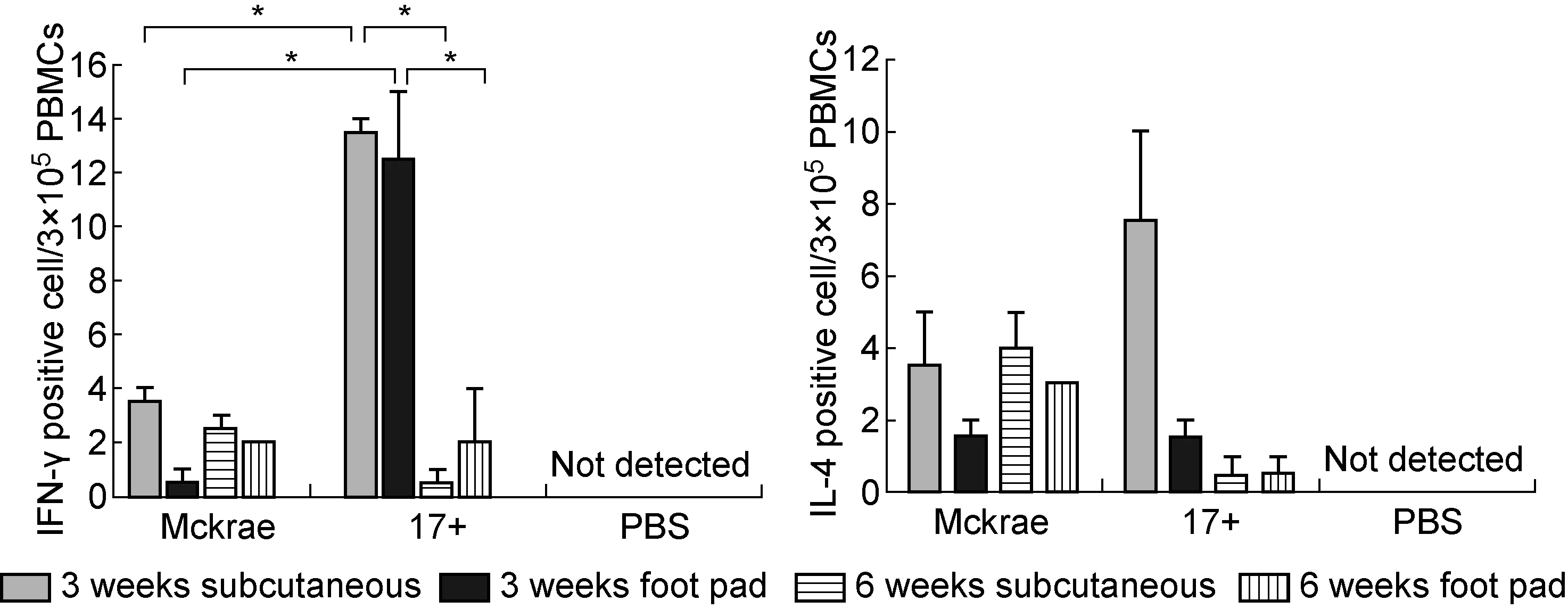
图6 HSV-1感染后第90天PBMC中HSV-1抗原特异性T细胞水平
Fig.6 HSV-1 specific T cell rate in PBMCs 90 d after infection

A: Infected mice. B: Control mice.
图7 BALB/c小鼠感染HSV-1后三叉神经组织中CD8+T浸润情况
Fig.7 CD8+T cell infiltration of trigeminal ganglia 90 d after HSV-1 infection
由辅助性T细胞产生的IL-4对刺激B细胞产生中和抗体至关重要,而HSV-1以角膜和滴鼻途径感染BALB/c小鼠后14 d及35 d均未能在PBMC中检测到HSV-1抗原特异性IL-4+T细胞,与角膜和滴鼻途径攻毒后小鼠血清中的低水平中和抗体结果相一致。结果提示,HSV-1以角膜和滴鼻途径感染BALB/c小鼠后35 d内并不能有效刺激中和抗体产生,因此利用这两种攻毒途径的BALB/c小鼠感染模型来评价疫苗和药物对中和抗体生成的影响将面临困难。
HSV-1感染人体后可在感觉神经元中潜伏,一旦潜伏状态建立则无法被宿主免疫系统清除,从而形成终生潜伏感染[1]。HSV-1感染小鼠后,病毒基因组可潜伏于三叉神经节、背根神经节等感觉神经细胞中,而感染性病毒颗粒则在14 d内被免疫系统从体内清除,从而使HSV-1感染从急性感染期转向潜伏感染期[6-7]。对于HSV-1在小鼠体内的潜伏感染,以前研究多选取感染后1个月左右的时段,更长时间跨度的研究则较少。本研究选取病毒慢性感染小鼠后90 d作为更长时间跨度的观察时段,观察不同毒株、不同攻毒途径及不同周龄对小鼠抗HSV-1特异性免疫反应的影响。血清中和抗体水平检测结果显示,病毒感染后90 d,各感染组均能检测到不同水平的抗HSV-1血清中和抗体,其中足垫注射感染组中和抗体水平高于皮下注射感染组,不同小鼠周龄和不同毒株之间则未见显著差异。足垫注射感染较皮下注射感染引发更高水平的血清中和抗体,因此该攻毒途径的BALB/c小鼠感染模型更适合用于潜伏感染期小鼠体液免疫反应的研究。
PBMC中HSV-1抗原特异性T细胞检测结果显示,病毒慢性感染后第90天,各感染组PBMC中均能检测到不同水平的HSV-1抗原特异性IFN-γ+T和IL-4+T细胞,各感染组IL-4+T细胞数量趋于一致,但部分感染组IFN-γ+T细胞在不同毒株及不同周龄小鼠之间有差异。
HSV-1入侵神经组织后,病毒抗原特异性CD8+T细胞会浸润至受感染的神经组织中,并对HSV-1潜伏感染的神经元形成持续免疫监视,抑制病毒在这些神经元中再激活[1,6]。检测各感染组病毒感染后第90天小鼠三叉神经组织中的CD8+T细胞浸润情况,结果显示与对照组相比,所有感染组三叉神经组织均出现CD8+T细胞浸润。
以往研究表明,HSV-1在小鼠体内的潜伏状态及再激活特性主要由三方面决定:①HSV-1本身因素,包括潜伏相关转录体(latency-associated transcript,LAT)、病毒来源微小RNA(microRNA,miRNA)及部分即刻早期基因的作用[6,8-9];②受感染的神经元因素,包括细胞对病毒抗原的加工及呈递效率、细胞Ⅰ型干扰素产生水平等[10-11];③宿主特异性免疫系统因素,如进入有病毒潜伏感染的神经组织中的CD8+T细胞等[1]。这三方面的因素既独立作用又相互影响,相互作用的平衡最终决定病毒的潜伏与再激活状态。本研究观察到不同HSV-1毒株以不同慢性感染途径在不同周龄小鼠之间表现出的特异性抗病毒免疫反应有差异,是否影响HSV-1在BALB/c小鼠神经组织中的潜伏与再激活,值得进一步研究。
本研究显示,病毒毒株、感染途径及小鼠周龄对小鼠抗病毒特异性免疫反应有影响,这些结果对利用BALB/c小鼠模型来研究HSV-1感染及致病机制有相应的技术意义。这意味着使用此类动物模型进行HSV-1感染及疫苗研究时,需注意不同病毒毒株、感染途径及动物年龄等因素对相关免疫学研究结果的影响。
[1] Egan KP, Wu S, Wigdahl B, Jennings SR. Immunological control of herpes simplex virus infections [J]. J Neurovirol, 2013, 19(4): 328-345.
[2] Kollias CM, Huneke RB, Wigdahl B, Jennings SR. Animal models of herpes simplex virus immunity and pathogenesis [J]. J Neurovirol, 2015, 21(1): 8-23.
[3] Reis e Sousa C. Dendritic cells in a mature age [J]. Nat Rev Immunol, 2006, 6(6): 476-483.
[4] Knickelbein JE, Khanna KM, Yee MB, Baty CJ, Kinchington PR, Hendricks RL. Noncytotoxic lytic granule-mediated CD8+T cell inhibition of HSV-1 reactivation from neuronal latency [J]. Science, 2008, 322(5899): 268-271.
[5] Manicassamy S, Pulendran B. Modulation of adaptive immunity with Toll-like receptors [J]. Semin Immunol, 2009, 21(4): 185-193.
[6] Divito S, Cherpes TL, Hendricks RL. A triple entente:virus, neurons, and CD8+T cells maintain HSV-1 latency [J]. Immunol Res, 2006, 36(1-3): 119-126.
[7] Orr MT, Mathis MA, Lagunoff M, Sacks JA, Wilson CB. CD8 T cell control of HSV reactivation from latency is abrogated by viral inhibition of MHC class I [J]. Cell Host Microbe, 2007, 2(3): 172-180.
[8] Srivastava R, Dervillez X, Khan AA, Chentoufi AA, Chilukuri S, Shukr N, Fazli Y, Ong NN, Afifi RE, Osorio N, Geertsema R, Nesburn AB, Wechsler SL, BenMohamed L. The herpes simplex virus latency-associated transcript gene is associated with a broader repertoire of virus-specific exhausted CD8+T cells retained within the trigeminal ganglia of latently infected HLA transgenic rabbits [J]. J Virol, 2016, 90(8): 3913-3928.
[9] Held K, Junker A, Dornmair K, Meinl E, Sinicina I, Brandt T, Thei D, Derfuss T. Expression of herpes simplex virus 1-encoded microRNAs in human trigeminal ganglia and their relation to local T-cell infiltrates [J]. J Virol, 2011, 85(19): 9680-9685.
[10] Lafaille FG, Pessach IM, Zhang SY, Ciancanelli MJ, Herman M, Abhyankar A, Ying SW, Keros S, Goldstein PA, Mostoslavsky G, Ordovas-Montanes J, Jouanguy E, Plancoulaine S, Tu E, Elkabetz Y, Al-Muhsen S, Tardieu M, Schlaeger TM, Daley GQ, Abel L, Casanova JL, Studer L, Notarangelo LD. Impaired intrinsic immunity to HSV-1 in human iPSC-derived TLR3-deficient CNS cells [J]. Nature, 2012, 491(7426): 769-773.
[11] Wilcox DR, Folmsbee SS, Muller WJ, Longnecker R. The type I interferon response determines differences in choroid plexus susceptibility between newborns and adults in herpes simplex virus encephalitis [J]. MBio, 2016, 7(2): e00437-16. doi: 10.1128/mBio.00437-16.
. LI Qihan, E-mail: liqihan@imbcams.com.cn
Immunological evaluation of BALB/c mice as an animal model for herpes simplex virus 1 infection
ZHANG Xiaolong1,*, TANG Beibei1,*, HE Yufeng1, DUAN Yongzhong1, WANG Lichun1, ZHANG Zhixiao1, ZHOU Jumin2, LI Qihan1
1.YunnanKeyLaboratoryofVaccineResearchandDevelopmentonSevereInfectiousDisease,InstituteofMedicalBiology,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Kunming650118,China; 2.KeyLaboratoryofAnimalModelsandHumanDiseaseMechanismsofChineseAcademyofSciences&YunnanProvince,KunmingInstituteofZoology,Kunming650223,China
To investigate the immunological responses of BALB/c mice to herpes simplex virus type 1 (HSV-1) infection, the following factors were followed: strains, infect routes and mouse ages, the dendritic cells (DCs) and HSV-1 specific T cell rate and function in peripheral blood mononuclear cells (PBMCs), serum neutralizing antibody titer, and CD8+T cell infiltration in nervous tissues in HSV-1-infected BALB/c mice. The results showed that 3-week- and 6-week-old BALB/c mice challenged with HSV-1 Mckrae and 17+ strains through corneal and nasal routes led to an increased rate of DCs in PBMCs, and conferred DC capacity to stimulate HSV-1 specific T cellsinvivo. At 35 d post infection, low level interferon γ (IFN-γ)+T cells and no interleukin 4 (IL4)+T cells could be detected in PBMCs, and low level neutralizing antibody was present or absent in serum. Ninety days after BALB/c mice challenged with HSV-1 through subcutaneous and foot pad injection, CD8+T cells could be detected in mouse trigeminal ganglia in different groups. However, HSV-1 specific IFN-γ+T cell and IL4+T cell rates showed divergence between different virus strains and mouse ages. Foot pad injection of BALB/c mice with HSV-1 could elicit higher neutralizing antibody titer compared with subcutaneous injection. This research demonstrated that, infection of different age BALB/c mice with different HSV-1 strains through different routes can stimulate comparable DC maturation and antigen presentation.
BALB/c mouse; Herpes simplex virus type 1; Immunological analysis
国家自然科学基金(31670173),中国医学科学院医学与健康科技创新工程项目(2016-I2M-1-019),北京协和医学院“协和青年基金”(3332016115),中国医学科学院基本科研业务费(2016ZX350072)
李琦涵
2017-03-02)
*同为第一作者
