表观弥散系数值在儿童颅后窝常见肿瘤鉴别诊断中的价值
2017-08-16岚张勇朱海云
张 岚张 勇朱海云
表观弥散系数值在儿童颅后窝常见肿瘤鉴别诊断中的价值
张 岚1张 勇2朱海云3
目的:探讨表观弥散系数(ADC)值对儿童颅后窝常见肿瘤鉴别诊断的价值。方法:回顾性分析60例经手术病理证实的儿童颅后窝常见肿瘤,其中髓母细胞瘤25例,毛细胞星形细胞瘤23例,室管膜瘤12例。所有患儿术前行MRI平扫、增强和DWI检查。测量三组肿瘤的平均ADC值和最小ADC(ADCmin)值,绘制受试者工作特征(ROC)曲线,获取肿瘤鉴别诊断的最佳阈值及灵敏度、特异度和诊断准确率。结果:髓母细胞瘤、毛细胞星形细胞瘤和室管膜瘤的平均ADC值分别为(0.69±0.34)×10-3mm2/s、(1.68±0.23)×10-3mm2/s 和 (1.15±0.27)×10-3mm2/s;ADCmin 值 分 别 为 (0.48±0.29)×10-3mm2/s、(1.59±0.32)×10-3mm2/s和 (0.83±0.39)×10-3mm2/s,三组肿瘤的平均 ADC 值和 ADCmin 值差异具有统计学意义(P<0.05)。ROC曲线分析鉴别髓母细胞瘤与室管膜瘤的平均ADC值最佳阈值为0.87×10-3mm2/s,相应敏感度92.7%、特异度96.3%、诊断准确率94.5%;鉴别室管膜瘤与毛细胞星形细胞瘤的平均ADC值最佳阈值为1.36×10-3mm2/s,相应敏感度91.7%、特异度92.6%、诊断准确率92.7%。ADCmin值鉴别髓母细胞瘤与室管膜瘤的最佳阈值为0.67×10-3mm2/s,相应敏感度97%、特异度100%、诊断准确率97.8%。ADCmin值鉴别室管膜瘤与毛细胞星形细胞瘤的最佳阈值为1.06×10-3mm2/s,相应敏感度95.7%、特异度97.9%、诊断准确率94.7%结论:平均ADC值和ADCmin值在儿童颅后窝常见肿瘤的鉴别诊断中具有较高的临床应用价值,且ADCmin值对肿瘤的鉴别诊断能力优于平均ADC值。
表观弥散系数;髓母细胞瘤;室管膜瘤;星形细胞瘤
髓母细胞瘤、毛细胞星形细胞瘤和室管膜瘤是儿童颅后窝常见的肿瘤。肿瘤恶性程度不同,治疗方法和预后大不相同,早期诊断及合理的治疗方式尤为重要。由于颅后窝肿瘤形态相似,常规影像学表现缺乏足够特异性,故鉴别诊断较为困难[1]。弥散加权成像(diffusion weighted imaging,DWI)的表观弥散系数(apparent diffusion coefficient, ADC)能够定量评估活体组织的扩散情况,客观反映肿瘤的组织学特征,已应用于多种肿瘤的鉴别诊断中[2]。本研究旨在探讨ADC值在儿童颅后窝肿瘤鉴别诊断中的应用价值。
方 法
1.临床资料
收集2015年1月至2016年10月在河南中医药大学第一附属医院(25例)与郑州大学第一附属医院(40例)就诊并经手术切除病理证实的颅后窝原发性肿瘤65例患儿(年龄≤16岁)的影像和临床资料。65例患儿中,2例血管母细胞瘤,1例胶质母细胞瘤,1例少突胶质细胞瘤,1例脉络丛乳头状瘤予以排除(肿瘤例数少于5例者予以剔除)。余60例中,髓母细胞瘤25例,毛细胞星形细胞瘤23例,室管膜瘤12例。男32例,女28例,年龄10个月~16岁(10.5±2.7)岁。临床表现为头晕、头痛、恶心、呕吐、共济失调、肢体无力、活动障碍、癫痫、复视、视物不清等。所有患儿在MRI检查前均未行活检、手术或放、化疗。本研究经伦理委员会批准进行,患儿家属均签署知情同意书。
2.检查方法
采用德国西门子Verio 3.0T磁共振扫描仪,8通道头部线圈。平扫行轴位T1WI、T2WI、液体衰减反转恢复 (fluid attenuated inversion recovery,FLAIR)序列和DWI,以及矢状位T2WI。扫描参数:层厚6mm,间隔1mm;视野(FOV)230mm×230mm,矩阵128×128。T1WI:重复时间(TR)400ms,回波时间(TE)15ms,激励次数(NEX)1 次;T2WI:TR 5000ms,TE 105ms,NEX 1次;FLAIR:TR 3500ms,TE 90ms,NEX 1次;DWI:TR 3000ms,TE 97ms,NEX 1 次,b=0 和1000s/mm2。平扫后经肘静脉注射对比剂Gd-DTPA(马根维显),行T1WI轴位、冠状位和矢状位增强扫描,剂量0.2ml/kg。
3.图像分析
由三名高年资MRI诊断医师采用盲法独立对图像进行分析、测量,意见不一致时以两位医师相同意见为准。分析所有包含肿瘤层面的ADC图像,手动绘制ROI。ROI为圆形,面积约为30~35mm2,选取3~5个,ROI选择在MRI增强图像上强化最明显的肿瘤实性部分,避开肿瘤内囊变、坏死及出血区,最大程度剔除影响肿瘤ADC值的因素。测量各个ROI的ADC值三次后取平均值作为平均ADC值,最低值作为肿瘤的最小ADC(ADCmin)值。
4.统计学分析
采用SPSS20.0统计软件对测量结果进行分析,三种肿瘤的平均ADC值和ADCmin值以均数±标准差()表示。三组肿瘤ADC值的比较采用单因素方差分析(one-way ANOVA),任意两者之间的差异采用LSD-t检验分析,以P<0.05为差异有统计学意义。采用Medcalc 12.7.0医学统计软件绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under ROC curve,AUC),确定三种肿瘤的最佳鉴别阈值及灵敏度、特异度和诊断准确率。
结 果
1.MRI表现
25例髓母细胞瘤中,18例起源于小脑蚓部并累及第四脑室,2例起源于第四脑室顶部后髓帆并位于第四脑室内,5例位于小脑半球,肿瘤呈圆形或类圆形,T1WI低信号,T2WI高信号,DWI肿瘤实性部分呈高信号,ADC图呈低信号(图1),增强扫描明显强化,18例均匀强化,7例不均匀强化,25例患儿均伴有不同程度脑积水。12例室管膜瘤中,位于第四脑室10例,位于小脑蚓部1例,T1WI肿瘤呈低-等信号,T2WI等-高信号,DWI肿瘤呈等-稍高信号,ADC图呈等-稍低信号(图2),增强扫描呈轻、中度强化,12例患儿均伴有脑积水。23例毛细胞星形细胞瘤位于小脑半球,多呈类圆形,T1WI为低信号,T2WI呈不均匀高信号,DWI肿瘤呈低信号,ADC图为高信号(图3),11例为实性肿块,12例为囊实性肿块,增强扫描肿瘤实性部分或壁结节强化,18例伴有脑积水。

表1 三组肿瘤的平均ADC值和ADCmin值比较(n=60)

图1 男,5岁,四脑室髓母细胞瘤。A.轴位T2WI,肿块呈不均匀高信号;B.DWI,肿块呈不均匀高信号;C.ADC,肿块呈不均匀低信号,平均ADC值为0.79×10-3mm2/s ,ADCmin值为0.58×10-3mm2/s。
2.肿瘤的平均ADC值和ADCmin值(表1)
髓母细胞瘤、毛细胞星形细胞瘤和室管膜瘤的 平 均 ADC 值 分 别 为 (0.69±0.34)×10-3mm2/s、(1.68±0.23)×10-3mm2/s 和 (1.15±0.27)×10-3mm2/s,三 者 差 异 具 有 统 计 学 意 义(F=70.604,P=0.000),LSD-t检验结果显示三组肿瘤平均ADC值组间两两比较,差异均具有统计学意义(P<0.05)。髓母细胞瘤、毛细胞星形细胞瘤和室管膜瘤 ADCmin 值分别为 (0.48±0.29)×10-3mm2/s、(1.59±0.32)×10-3mm2/s 和(0.83±0.39)×10-3mm2/s,三者差异具有统计学意义(F=70.604,P=0.000),LSD-t检验结果显示三组肿瘤ADCmin值组间两两比较,差异均具有统计学意义(P<0.05)。

图2 女,3岁,四脑室室管膜瘤。A.轴位T2WI,肿块呈稍高信号;C.DWI,肿块呈等信号;D.ADC,肿块呈稍低信号,平均 ADC 值为 1.02×10-3mm2/s ,ADCmin 值为 0.73×10-3mm2/s。
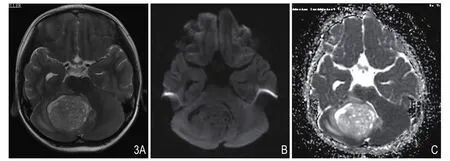
图3 女,4岁,小脑半球毛细胞星形细胞瘤。A.轴位T2WI,肿块呈稍高信号;B.DWI,肿块呈低信号;C.ADC,肿块呈高信号,平均ADC值为1.86×10-3mm2/s ,ADCmin值为1.56×10-3mm2/s。
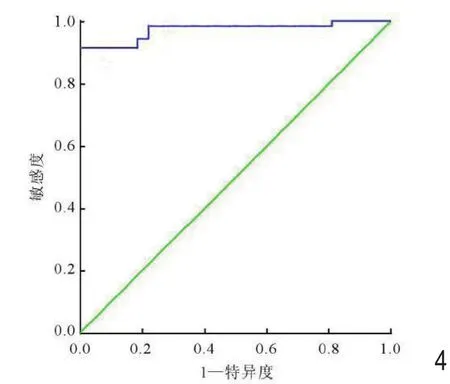
图4 平均ADC值鉴别髓母细胞瘤与室管膜瘤的ROC曲线。

图5 平均ADC值鉴别室管膜瘤与毛细胞星形细胞瘤的ROC曲线。

图6 ADCmin值鉴别髓母细胞瘤与室管膜瘤的ROC曲线。
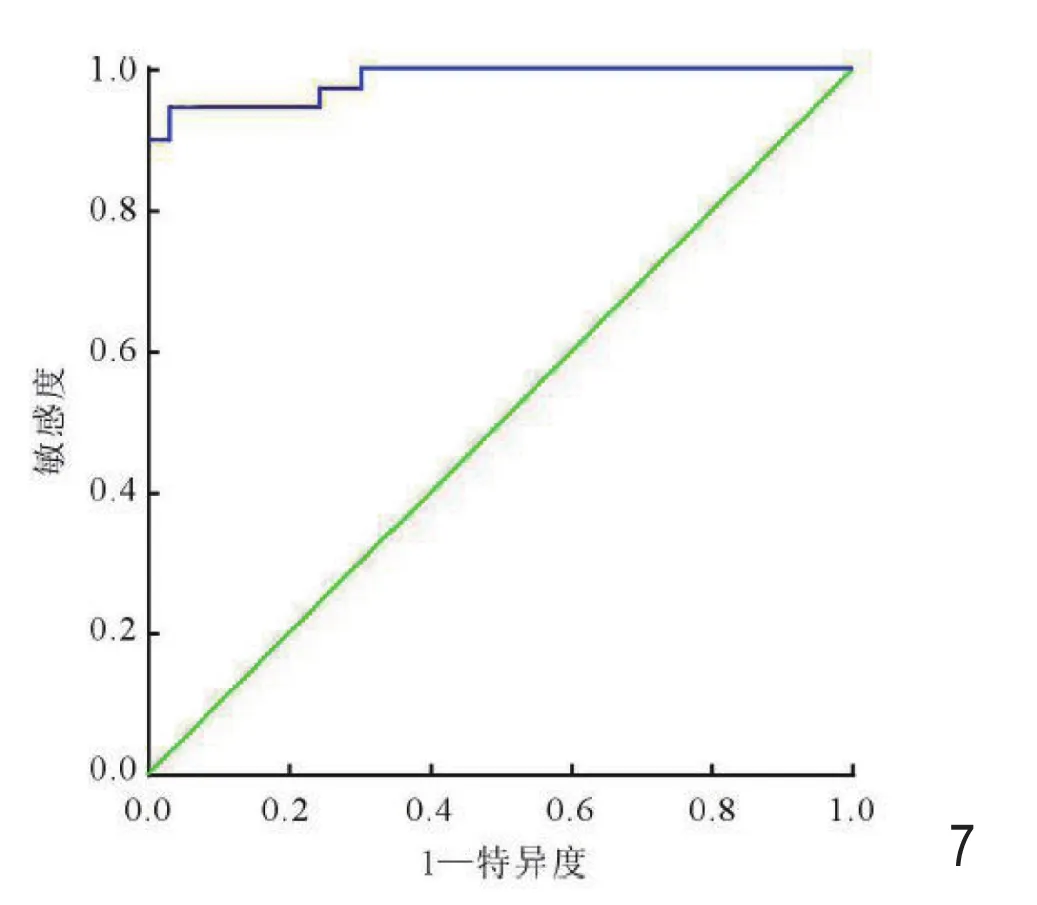
图7 ADCmin值鉴别室管膜瘤与毛细胞星形细胞瘤的ROC曲线。
3.ROC曲线分析
平均ADC值鉴别髓母细胞瘤与室管膜瘤的曲线下面积(AUC)为0.98,最佳鉴别阈值为0.87×10-3mm2/s,敏感度为92.7%;特异度为96.3%,诊断准确率为94.5%(图4)。平均ADC值鉴别室管膜瘤与毛细胞星形细胞瘤的AUC为0.957,最佳鉴别阈值为 1.36×10-3mm2/s,敏感度为 91.7%,特异度为92.6%,诊断准确率为 92.7%(图 5)。ADCmin值鉴别髓母细胞瘤与室管膜瘤的AUC为0.991,最佳鉴别阈值为0.67×10-3mm2/s,敏感度为97%,特异度为100%,诊断准确率为97.8%(图6)。ADCmin值鉴别室管膜瘤与毛细胞星形细胞瘤的AUC 为 0.96,最佳鉴别阈值为 1.06×10-3mm2/s,敏感度为95.7%,特异度为97.9%,诊断准确率为94.7%(图 7)。
讨 论
儿童颅后窝肿瘤以髓母细胞瘤、室管膜瘤和毛细胞星形细胞瘤最为常见,MRI是颅后窝肿瘤术前首选的检查方法[3]。此三种肿瘤具有一些共性,如发病年龄近似,囊实性肿块,肿瘤强化较为显著,髓母细胞瘤和室管膜瘤均可侵犯并充填第四脑室等,故鉴别诊断有一定的困难。
近年来DWI被广泛应用于多种脑肿瘤的分级和鉴别诊断中。本研究首先采用平均ADC值探讨其对三种肿瘤的鉴别意义。结果显示,髓母细胞瘤的平 均 ADC 值 最 低, 为 (0.69±0.34)×10-3mm2/s,毛细胞星形细胞瘤的平均ADC值最高,为(1.59±0.32)×10-3mm2/s, 室 管膜瘤 平均 ADC 值介于二者之间,为 (1.15±0.27)×10-3mm2/s,差异具有统计学意义,与彭雪华等[4]测量平均ADC值的研究结果近似。近年研究认为肿瘤实质部分的最小ADC值最能代表肿瘤细胞密度最高或者细胞增殖最明显的部分,反映了异型性肿瘤细胞的最密集区域[5-6]。因此,本研究同时选择肿瘤的ADCmin值作为分析指标。髓母细胞瘤、毛细胞星形细胞瘤和室管膜瘤的 ADCmin 值分别为 (0.48±0.29)×10-3mm2/s、(1.59±0.32)×10-3mm2/s和(0.83±0.39)×10-3mm2/s,三者的ADCmin值具有显著的统计学差异,与Pierce等[7]的研究结果相近。无论测量的是平均ADC值还是ADCmin值,均表现为髓母细胞瘤的ADC值最低,毛细胞星形细胞瘤的ADC值最高,室管膜瘤的ADC值居中,这与三种肿瘤的病理组织学差异密切相关。Koral等[8]研究认为肿瘤的ADC值与肿瘤的细胞密度呈负相关,肿瘤细胞的异型性越明显,细胞密度越大,水分子弥散受限越显著。髓母细胞瘤由大量密集的小圆细胞组成,核浆比高,核深染缺乏胞质,这种特点造成肿瘤细胞内水分子弥散受限显著,ADC值较低[9];而毛细胞星形细胞瘤的肿瘤细胞呈梭形,胞质疏松,肿瘤细胞内水分子弥散受限不明显,ADC值较高;室管膜瘤的肿瘤细胞密集程度居于髓母细胞瘤和星形细胞瘤之间,ADC值介于二者之间。
本研究通过ROC曲线分析了平均ADC值和ADCmin值两种方法对颅后窝三种肿瘤的鉴别诊断能力。结果显示,平均ADC值鉴别髓母细胞瘤与室管膜瘤的最佳阈值为0.87×10-3mm2/s,室管膜瘤与毛细胞星形细胞瘤鉴别阈值为1.36×10-3mm2/s。Rumboldt等[10]的研究结果是,肿瘤的平均ADC值大于1.4×10-3mm2/s为毛细胞星形细胞瘤,小于0.9×10-3mm2/s为髓母细胞瘤。与之相比,本研究肿瘤的平均ADC值的鉴别阈值稍低。
此外,根据ROC曲线获得,0.67×10-3mm2/s为髓母细胞瘤与室管膜瘤相鉴别的最佳ADCmin,ADCmin值为1.06×10-3mm2/s时可用以鉴别室管膜瘤与毛细胞星形细胞瘤。这与Pierce等[11]的研究结果显示髓母细胞瘤与室管膜瘤鉴别的ADCmin值为 0.675×10-3mm2/s较为接近。但 Jaremko等[12]认为测量平均ADC值时更易受到肿瘤不均质的影响,对肿瘤进行鉴别时会出现更多的交叉,因此推荐测量肿瘤的ADCmin。Pierce等[11]的研究也认为ADCmin值对儿童常见颅后窝肿瘤鉴别有较大的临床应用价值,且操作简单、重复性较好。本研究也发现采用ADCmin值对肿瘤进行鉴别诊断时,敏感度、特异度及诊断准确率均较高,鉴别能力总体优于平均ADC值。此研究结果对临床具有一定的参考价值。
但本研究仍存在一定的局限性。根据最新的WHO肿瘤分类标准,髓母细胞瘤、室管膜瘤和毛细胞星形细胞瘤均包含亚型[13-14],不同亚型之间肿瘤ADC值会有差异,可能会导致肿瘤的ADC值存在部分重叠现象。本研究并未考虑到不同肿瘤亚型之间的ADC值差异,这有可能增加研究结果的敏感度和特异度。
综上所述,平均ADC值和ADCmin值在儿童常见颅后窝肿瘤的鉴别诊断中具有较高的临床应用价值,且ADCmin值对肿瘤的鉴别诊断能力优于平均ADC值。但是,单独依靠测量ADC值是不够的,应结合常规MRI表现,才能对小儿颅后窝肿瘤做出快速、准确的判断。
[1]Poretti A,Meoded A,Huisman TA. Neuroimaging of pediatric posterior fossa tumors including review of the literature.J Magn Reson Imaging,2012,35:32-47.
[2]武文奇, 牛金亮. 基于体素内不相干运动的扩散加权成像在肿瘤诊断中的研究进展. 中华放射学杂志,2016,50:553-555.
[3]Forbes JA, Reig AS,Smith JG,et al. Findings on preoperative brain MRI predict histopathology in children with cerebellar neoplasm.Pediar Neurosurg,2011,47:52-59.
[4]彭雪华,何 玲,黄开平. DWI诊断小儿幕下脑肿瘤. 中国医学影像技术,2011,27:269-272.
[5]Chen L,Liu M, Bao J, et al. The correlation between apparent diffusion coefficient and tumor cellularity in patients: A metaanalysis. PLOS One, 2013,8:e79008
[6]朱 莉,任 广,汤伟军,等.肿瘤最小ADC值在胶质瘤分级中的应用研究.中国医学计算机成像杂志,2015,21:162-164
[7]Pierce T, Kranz PG, Roth C, et al. Use of apparent diffusion coef ficient values for diagnosis of Pediatric Posterior Fossa tumors.Neuroradiol J, 2014,27:233-44.
[8]Koral K, Mathis D, Gimi B, et al. Common pediatric cerebellar tumors: Correlation between cell densities and apparent diffusion coef ficient metrics. Radiology, 2013,268:532-537
[9]Han C, Zhao L, Zhong S, et al. A comparison of high b-value vs standard b-value diffusion-weighted magnetic resonance imaging at 3.0 T for medulloblastomas. Br J Radiol. 2015,88:20150220.
[10]Rumboldt Z, Camacho DL, Lake D, et al. Apparent diffusion coef ficients for differentiation of cerebellar tumors in children. Am J Neuroradiol,2006,27: 1362-1369.
[11]Pierce TT, Provenzale JM. Evaluation of apparent diffusion coefficient thresholds for diagnosis of medulloblastoma using diffusion-weighted imaging. Neuroradiol J, 2014, 27: 63-74.
[12]Jaremko JL, Jans LB, Coleman LT, et al. Value and limitations of diffusion-weighted imaging in grading and diagnosis of pediatric posterior fossa tumors. Am J Neuroradiol,2010, 31 : 1613-1616.
[13]Yeom KW, Mobley BC, Lober RM, et al. Distinctive MRI features of pediatric medulloblastoma subtypes. AJR Am J Roentgenol,2013,200:895-903.
[14]Lin FY, Chintagumpala M. Advances in management of pediatric ependymomas.Curr Oncol Rep, 2015,17:47.
Value of Apparent Diffusion Coefficient in Differential Diagnosis of Common Pediatric Posterior Fossa Tumors
ZHANG Lan1, ZHANG Yong2, ZHU Hai-yun3
Purpose:To investigate the value of apparent diffusion coefficient (ADC) in differential diagnosis of common pediatric posterior fossa tumors.Methods:Sixty children with posterior fossa tumors confirmed by surgery and pathology results were retrospectively analyzed, including 25 medulloblastomas, 23 pilocytic astrocytomas,and 12 ependymomas. All the patients underwent preoperative MRI plain scan, enhanced scan and DWI. The mean and minimum ADC (ADCmin) values of tumors were measured and the receiver operating characteristic (ROC)curves were delineated. The optimal mean ADC and ADCmin values for differential diagnosis of three types tumors,and sensitivity, specificity and diagnostic accuracy rate of them were determined.Results:The mean ADC and ADCmin values for medulloblastoma, pilocytic astrocytoma and ependymoma were (0.69±0.34)×10-3mm2/s,(1.68±0.23)×10-3mm2/s, and (1.15±0.27)×10-3mm2/s; (0.48±0.29)×10-3mm2/s, (1.59±0.32)×10-3mm2/s and(0.83±0.39)×10-3mm2/s, respectively. There were statistically significant differences of mean ADC and ADCmin values among these three kinds of tumors (P<0.05). The optimal mean ADC value which could be used to distinguish medulloblastoma from ependymoma was 0.87×10-3mm2/s (sensitivity: 92.7%, specificity: 96.3% and diagnostic accuracy rate: 94.5%); The optimal mean ADC value to distinguish ependymoma from pilocytic astrocytoma was 1.36×10-3mm2/s (sensitivity: 91.7%, specificity: 92.6% and diagnostic accuracy rate: 92.7%); The optimal ADCmin value to distinguish medulloblastoma from ependymoma was 0.67×10-3mm2/s (sensitivity: 97%, specificity: 100% and diagnostic accuracy rate: 97.8%); The optimal ADCmin value to distinguish ependymoma from pilocytic astrocytoma was 1.06×10-3mm2/s (sensitivity: 95.7%, specificity: 97.9% and diagnostic accuracy rate: 94.7%).Conclusion:The mean and minimum ADC values are useful in differential diagnosis of common pediatric posterior fossa tumors, and ADCmin value is better than mean ADC value for the differential diagnosis.
Apparent diffusion coefficient; Medulloblastoma; Astrocytoma; Ependymoma.
s: Medical science and technology research projects of Henan province(No. 201602030);Henan Foundation for science and technology development(162102310104)
R445.2
A
1006-5741(2017)-03-0201-06
2017.01.11;修回时间:2017.02.23)
中国医学计算机成像杂志,2017,23:201-206
1河南中医药大学第一附属医院磁共振科
2郑州大学第一附属医院磁共振科
3 中国人民解放军第八五医院医学影像科
通信地址:上海市长宁区华山路1328号 ,上海 200052
朱海云 (电子邮箱:zhuhaiyun376@163.com)
河南省医学科技攻关项目(No. 201602030)
河南省科技攻关项目(162102310104)
Chin Comput Med Imag,2017,23:201-206
1 MRI Department, The First Affiliated Hospital of Henan University of TCM
2 MRI Department, The First Affiliated Hospital of Zhengzhou University
3 Department of Radiology, the 85th Hospital of PLA
Address: No.1328 Huashan Road, Shanghai 200052, P.R.C.
Address Correspondence to ZHU Hai-yun (E-mail: zhuhaiyun376@163.com)
