P-EGFR、P-ERK和NF-κB在中耳胆脂瘤上皮中的表达和意义
2017-08-16王晓丽谢淑敏王月辉刘伟殷团芳彭安全任基浩
王晓丽谢淑敏王月辉刘伟殷团芳彭安全任基浩
1湖南省妇幼保健院儿童五官科(长沙410008)
2中南大学湘雅医院耳鼻咽喉头颈外科(长沙410008)
3河南科技大学第一附属医院耳鼻咽喉头颈外科(洛阳471000)
4中南大学湘雅二医院耳鼻咽喉头颈外科,中南大学耳科研究所(长沙410011)
·基础研究·
P-EGFR、P-ERK和NF-κB在中耳胆脂瘤上皮中的表达和意义
王晓丽1谢淑敏2王月辉3刘伟4殷团芳4彭安全4任基浩4
1湖南省妇幼保健院儿童五官科(长沙410008)
2中南大学湘雅医院耳鼻咽喉头颈外科(长沙410008)
3河南科技大学第一附属医院耳鼻咽喉头颈外科(洛阳471000)
4中南大学湘雅二医院耳鼻咽喉头颈外科,中南大学耳科研究所(长沙410011)
目的研究磷酸化表皮生长因子受体(P-EGFR)、磷酸化细胞外信号调节激酶(P-ERK)和细胞核转录因子κB(NF-κB)在中耳胆脂瘤上皮组织中的表达情况,探讨EGFR/ERK/NF-κB信号通路在中耳胆脂瘤发病机制中的作用。方法应用免疫组织化学SP法及Western blot(WB)免疫印迹法检测30例中耳胆脂瘤标本及15例正常外耳道皮肤组织中P-EGFR、P-ERK和NF-κB蛋白的表达。结果(1)P-EGFR蛋白阳性表达主要定位于细胞质和(或)细胞膜,在胆脂瘤组的阳性表达率为63%,明显高于正常外耳道皮肤组的20%(P<0.05);P-ERK蛋白阳性表达主要定位于细胞质和(或)细胞核,在胆脂瘤组的阳性表达率为70%,明显高于正常外耳道皮肤组的20%(P<0.05);NF-κB蛋白阳性表达主要定位于细胞核,在胆脂瘤组的阳性表达率为60%,明显高于正常耳道皮肤组的13.3%(P< 0.05)。在30例中耳胆脂瘤组织中,P-EGFR、P-ERK和NF-κB两两之间呈正相关关系(P<0.05)。(2)Western blot免疫印迹法检测结果显示:中耳胆脂瘤组中P-EGFR、P-ERK和NF-κB的表达量明显高于正常外耳道皮肤组的表达量。结论P-EGFR、P-ERK和NF-κB在中耳胆脂瘤上皮中表达增强,EGFR/ERK/NF-κB信号通路可能在中耳胆脂瘤组织的形成和发展过程中起重要作用。
中耳,胆脂瘤,P-EGFR,P-ERK,NF-κB,EGFR/ERK/NF-κB信号通路
Foundation:Nationalnaturalscience foundation of China(NO:81400457)
Conflictof interest:Theauthorsdeclareno conflictof interestw ith regard to thispublication.
中耳胆脂瘤是耳科常见病,虽为良性病变,却具有侵袭性、破坏性、复发性等特征,发病机制尚不清楚,可能与胆脂瘤上皮细胞的过度增殖、凋亡紊乱等有关[1-3]。随着分子生物技术的发展及应用,细胞因子在胆脂瘤发病机制中的作用逐渐被重视,本文主要探索磷酸化表皮生长因子受体(phospho-epidermal growth factor receptor,P-EG⁃FR)、磷酸化细胞外信号调节激酶(phospho-extra⁃cellular signal-regulated kinase,P-ERK)和细胞核转录因子κB(nuclear transcription factor kappa B, NF-κB)在中耳胆脂瘤上皮组织中的表达情况,探讨EGFR/ERK/NF-κB信号通路在中耳胆脂瘤发病机制中的作用。
表皮生长因子受体(epidermalgrowth factor re⁃ceptor,EGFR)是一种酪氨酸蛋白激酶受体,其细胞外部分与配体结合后可形成二聚体自动磷酸化为P-EGFR,从而激活下游MEK/ERK信号通路,调控NF-κB表达,影响细胞增殖、凋亡、迁移等[4-5]。我们的前期研究显示:EGFR在胆脂瘤上皮组织中处于活化状态[6-7],我们推测:在中耳胆脂瘤组织中可能存在EGFR/ERK/NF-κB信号通路的激活,从而促进胆脂瘤的发生及发展。因此,我们选取该通路的关键因子P-EGFR、P-ERK和NF-κB,运用免疫组织化学SP法及Western blot(WB)检测其表达,探讨EGFR/ERK/NF-κB信号传导通路在中耳胆脂瘤发病机制中的作用。
1 材料与方法
1.1 材料
1.1.1 组织标本
收集2009.08~2011.08期间中南大学湘雅二医院耳鼻咽喉头颈外科后天性中耳胆脂瘤标本30例为实验组,外耳道正常皮肤组织标本(取自外耳道口正常皮肤组织)15例为对照组。标本取出后一半行常规石蜡包埋、切片、苏木精-伊红(HE)染色,另一半立即置入液氮,作为WB的实验组织标本。
1.1.2 主要试剂
兔抗人P-EGFR多克隆抗体、鼠抗人P-ERK单克隆抗体、鼠抗人NF-κB单克隆抗体购于Santa Cruz公司,RIPA裂解液购自北京普利莱,ECL发光液购自美国Thermo pierce。
1.2 实验方法
1.2.1 免疫组织化学实验
步骤如下:烤片、脱蜡、水化、灭活内源性过氧化物酶后,0.01M枸橼酸钾缓冲液高压下抗原修复。山羊血清进行抗原封闭后,孵育一抗(P-EG⁃FR浓度1:200,P-ERK浓度1:50,NF-κB浓度1:200),4℃冰箱内过夜。第二天复温至室温30min,PBS浸泡后孵育二抗10~15min,PBS冲洗后,室温孵育辣根酶标记链霉卵白素10~15min,PBS冲洗。用新鲜配制的二氨基联苯胺(diaminobenzi⁃dine,DAB)显色,显微镜下控制反应时间。冲洗,复染,脱水,透明,封片。已知的阳性切片作为阳性对照,PBS缓冲液代替一抗作为阴性对照。
阳性标准:P-EGFR细胞质着色为棕黄色者为阳性细胞,P-ERK细胞质和(或)胞核着色为棕黄色者为阳性细胞,NF-κB细胞核着色为棕黄色者为阳性细胞。先按照染色的强度(无着色、微弱、中度、深度棕黄色)依次计为0、1、2、3分,然后在400倍显微镜下进行阅片,根据阳性细胞百分比计分:0%、<10%、10%~50%、>50%依次记0、1、2、3分。二者之积:0~2分为阴性(-),≥3分为阳性(+)。
1.2.2 Western blot免疫印迹法
剪取适量组织,用冰预冷的PBS清洗组织,加入RIPA裂解液(已加入蛋白酶抑制剂及蛋白磷酸酶抑制剂)于匀浆器中反复研磨组织直至看不见组织块。置于冰上,蛋白裂解30分钟。移至离心管,12000rpm,4℃,15min,离心;将离心后的上清液转移、保存备用。检测蛋白浓度后,配胶、上样、电泳,浓缩胶电泳电压为80V,分离胶电泳电压为120V,待溴酚蓝电泳至离胶底约1cm时终止电泳。根据marker的指示,分别切出所需分子量蛋白的胶:P-EGFR约170KD,P-ERK1/2约42~44KD,NF-κB约65KD,β-actin约42KD。PVDF膜进行转膜。转膜完毕后,1*TBST洗膜5min,用丽春红染膜,检测蛋白转膜的效率。5%脱脂奶粉封闭1~2小时后,PBS洗膜3次,每次15min。然后用1*TBST将一抗按照一定比例稀释(P-EGFR 1:200,P-ERK 1: 1000,NF-κB 1:1000,β-actin 1:4000),孵育一抗,4℃过夜。第二天摇床30min复温至室温。1*TBST洗3次,每次15min。用1*TBST稀释HRP标记的二抗(稀释比例1:3000),孵育二抗45~60min。孵育结束后,1*TBST洗3次,每次15min。使用ECL化学发光液(Thermo)进行显影,定影液终止显色。底片曝光后扫描,并用quantity one专业灰度分析软件进行分析。
1.3 统计学分析
采用SPSS 16.0软件包进行数据分析,计数资料采用卡方检验,计量资料采用独立样本t检验,Spearman检验分析三蛋白之间的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学检测各蛋白的表达
中耳胆脂瘤组织及外耳道皮肤组织HE染色如图示(图1,图2)。P-EGFR的阳性表达定位于细胞质和(或)细胞膜,着色为棕黄色。实验组30例胆脂瘤标本中共有19例出现阳性染色(图3),阳性率为63%;对照组15例外耳道上皮组织中有3例染色为微弱棕黄色(图4),阳性率为20%。两组间比较差异有统计学意义(χ2=7.515,P=0.006,P<0.05)(见表1)。
P-ERK的阳性表达主要定位于细胞质,有时亦伴有细胞核着色,主要表达在胆脂瘤上皮和皮肤组织的基底层和基底上细胞层。实验组30例胆脂瘤标本中有21例出现阳性染色(图5),阳性率为70%。对照组15例外耳道上皮组织中有3例染色为微弱棕黄色(图6),阳性率为20%。两组间比较差异有统计学意义(χ2=10.045,P=0.002,P<0.05)(见表1)。
NF-κB活化后主要位于细胞核,以细胞核着棕黄色颗粒为阳性细胞。实验组30例胆脂瘤组织标本中有18例出现胞核着色,主要分布于胆脂瘤上皮基底层和基底上层(图7),阳性率为60%。对照组15例外耳道上皮组织中仅有2例染色颗粒位于细胞核,其余均为胞质着色(图8),为阴性表达,阳性率为13.3%。两组间比较差异有统计学意义(χ2=8.820,P=0.003,P<0.05)(见表1)。

表1 中耳胆脂瘤组和正常外耳道皮肤组P-EGFR、P-ERK与NF-κB蛋白表达情况的比较Table1 Comparison of theexpression of P-EGFR,P-ERK and NF-κB between cholesteatoma inm iddleearand normalcanalskin
表2所示为使用Spearman方法检验胆脂瘤组中P-EGFR、P-ERK和NF-κB之间的相互关系的结果,胆脂瘤组中P-EGFR与P-ERK的表达存在正相关(r=0.709,P=0.000,P<0.05),P-EGFR与NF-κB的表达存在正相关(r=0.508,P=0.004,P<0.05),P-ERK与NF-κB的表达存在正相关(r= 0.505,P=0.004,P<0.05)。
2.2 Western blot免疫印迹法检测P-EGFR、P-ERK和NF-κB蛋白的相对表达
将曝光后的底片扫描,并用quantity one专业灰度分析软件进行分析。结果显示:中耳胆脂瘤中P-EGFR、P-ERK和NF-κB蛋白的表达明显高于正常皮肤(图9)。对两组样本的相对灰度值进行独立样本t检验,结果示:胆脂瘤组中P-EGFR的相对表达量为0.8380±0.0431,显著高于正常皮肤组的0.3900±0.1175(t=-3.580,P=0.016,P<0.05);胆脂瘤组中P-ERK的相对表达量为0.1660±0.0248,显著高于正常皮肤组的0.0700±0.0138(t=-3.381,P= 0.019,P<0.05);胆脂瘤组中NF-κB的相对表达量为0.8200±0.1309,显著高于正常皮肤组的0.3860± 0.0706(t=-2.918,P=0.010,P<0.05)。

图1 胆脂瘤上皮HE染色(×100);Fig.1 Hematoxylin-eosin staining of cholesteatoma(×100);

图2 正常外耳道皮肤HE染色(×100);Fig.2 Hematoxylin-eosin staing of normalskin(×100);

图3 P-EGFR在中耳胆脂瘤上皮中的阳性表达(×200);Fig.3 The positiveexpression of P-EGFR in cholesteatoma (×200);

图4 P-EGFR在正常外耳道皮肤中的阴性表达(×200);Fig.4 The negative expression of P-EGFR in normal skin(× 200)

图5 P-ERK在中耳胆脂瘤上皮中的阳性表达(×200);Fig.5 The postive expression of P-ERK in cholesteatoma(× 200);

图6 P-ERK在正常外耳道皮肤中的阴性表达(×200);Fig.6 ThenegativeexpressionofP-ERK innormalskin(×200);

图7 NF-κB在中耳胆脂瘤上皮中的阳性表达(×200);Fig.7 The positive expression of NF-κB in cholesteatoma(× 200);

图8 NF-κB在正常外耳道皮肤中的阴性表达(×200)Fig.8 ThenegativeexpressionofNF-κB innormalskin(×200)
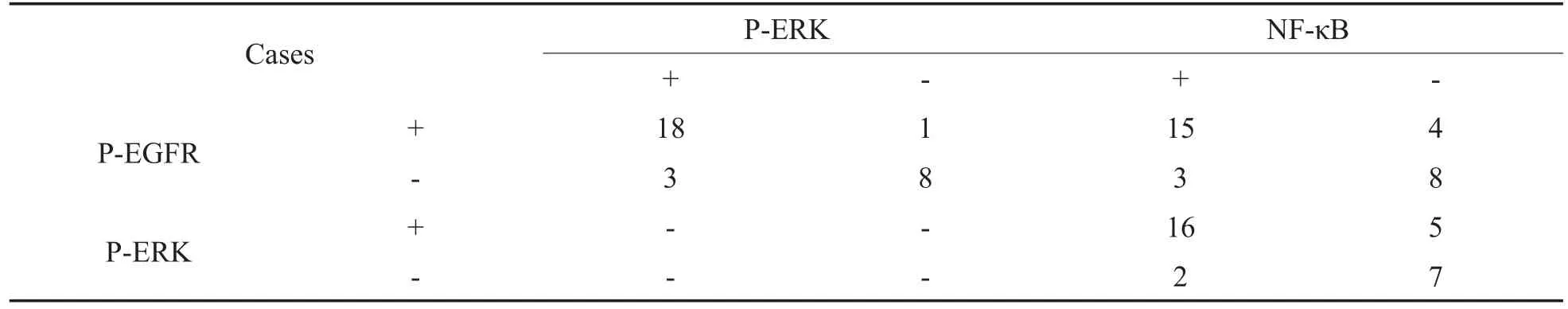
表2 中耳胆脂瘤组中P-EGFR、P-ERK和NF-κB蛋白表达之间的关系Table 2 Relationship of the expression of P-EGFR、P-ERK and NF-κB in cholesteatoma
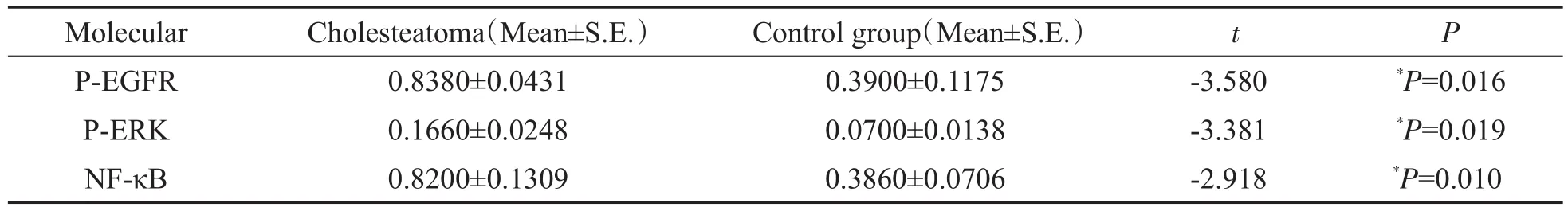
表3 中耳胆脂瘤组和外耳道皮肤组中P-EGFR、P-ERK和NF-κB蛋白的相对表达量Table 3 Comparison of the relative expression of P-EGFR,P-ERK and NF-κB between cholesteatoma inm iddle earand normal canalskin

图9 两组标本的WB灰度分析图(S:皮肤C:胆脂瘤)Fig.9 Western blotting analysis of P-EGFR,P-ERK,NF-κB between skin and cholesteatoma(S=skin;C=cholesteatoma)
3 讨论
EGFR是一个约170kDa大小、具有酪氨酸蛋白激酶活性的表皮生长因子受体,由胞外区、跨膜区、胞内区3个部分构成。胞外部分与配体结合后可形成二聚体自动磷酸化为P-EGFR,从而激活下游信号通路,发挥促进细胞增殖、迁移及肿瘤细胞侵袭性等作用[7]。
ERK蛋白属于丝氨酸-苏氨酸激酶亚家族,众多成员中关于ERK1、ERK2的研究目前最多。ERK1/2是Ras/Raf/MEK/ERK信号通路的重要成分,通过结合细胞表面受体转录因子,由细胞浆转移到细胞核中,调控一些重要蛋白的活性,进而调控细胞周期、细胞的增殖、分化及凋亡等过程[8-10]。
NF-κB是一种重要的转录因子,是一种从B淋巴细胞的细胞核提取物中发现的核蛋白。其家族包括五个成员:p50、p52、p65、c-Rel和RelB,它们可以形成多种同二聚体或者异二聚体复合体,激活后由胞浆转移到胞核,参与多种基因的调控、炎症反应和免疫反应,调节细胞的增殖及转化、抑制凋亡、促进肿瘤发展等[11-12]。
本研究中我们通过免疫组织化学方法发现P-EGFR蛋白阳性表达主要定位于细胞质和(或)细胞膜,在胆脂瘤组的阳性表达率为63%,明显高于正常外耳道皮肤组的20%(P<0.05);P-ERK蛋白阳性表达主要定位于细胞质和(或)细胞核,在胆脂瘤组的阳性表达率为70%,明显高于正常外耳道皮肤组的20%(P<0.05);NF-κB蛋白阳性表达主要定位于细胞核,在胆脂瘤组的阳性表达率为60%,明显高于正常耳道皮肤组的13.3%(P<0.05)。Spear⁃man检验结果显示:中耳胆脂瘤中P-EGFR、P-ERK、NF-κB三者的阳性表达两两之间均呈显著正相关关系(P<0.05)。WB免疫印迹检测从蛋白半定量角度也印证了:中耳胆脂瘤中P-EGFR、P-ERK和NF-κB的表达明显高于外耳道正常皮肤,且两组间有显著的统计学差异(P<0.05)。EG⁃FR与配体发生特异性结合之后,自身磷酸化转变为P-EGFR而激活,继而激活下游EGFR/ERK/ NF-κB信号通路,发挥促进细胞增殖、分化、迁移、侵袭的作用。我们的前期研究证实EGFR在胆脂瘤上皮组织中处于活化状态[6-7]。Huisman等[13-15]发现P-ERK1/2在胆脂瘤上皮组织中的表达较耳后皮肤明显增强,表达部位主要位于胆脂瘤组织全层细胞核,作者推测胆脂瘤上皮中终末分化紊乱,晚期终末分化停止,角质形成细胞滞留在早期终末分化阶段,导致细胞过度增殖、凋亡抑制,角质堆积。Liu等[16]通过免疫组织化学及WB方法发现胆脂瘤组织中P-ERK的表达较正常皮肤增强,主要位于胆脂瘤上皮全层细胞核。我们通过本研究也再次证实了中耳胆脂瘤组织中P-ERK1/2显著增强,此外,阳性细胞不仅表达在细胞核,细胞质中也有P-ERK1/2的阳性表达。
Miyao等[17]发现在胆脂瘤上皮全层均有NF-κB表达,主要位于细胞核周围,细胞核内却无表达,他们推测:胆脂瘤组织中NF-κB失活、其抗凋亡机制失活,联合caspase-3、caspase-8的促凋亡作用,导致角蛋白堆积,胆脂瘤形成。廖军等[18]发现胆脂瘤上皮组织中上皮全层均有NF-κβ表达,23例均有胞浆染色,且8例胞核亦染色,表达强度显著高于正常外耳道皮肤组织,推测炎症反应在中耳胆脂瘤发病机制中起重要作用,提出抗炎治疗、调控NF-κβ的表达可能作为胆脂瘤非手术治疗的方案。我们通过本研究也证实了中耳胆脂瘤组织中NF-κβ的表达较正常皮肤显著增强,且主要表达在细胞核,我们推测:激活的NF-κβ进入细胞核后与相应的靶基因结合,启动了靶基因的转录和表达,从而在胆脂瘤的形成和发展过程中发挥重要作用。
我们知道:P-ERK是EGFR的下游靶因子,NF-κB是P-ERK的下游靶因子,胆脂瘤角质形成细胞所处微环境中存在大量的表皮生长因子(epi⁃dermal growth factor,EGF)、转化生长因子α(trans⁃forming growth factor alpha,TGF-α)及双调蛋白(amphiregulin,AR)等炎症细胞因子,当它们与EG⁃FR特异性结合之后使后者自身磷酸化为P-EGFR而被激活,然后激活下游靶因子ERK,继而NF-κB被激活,导致细胞内部一系列信号级联反应,促进角质细胞增殖、角质碎屑堆积,从而促进中耳胆脂瘤的发生及发展。由此我们推测:EGFR/ERK/ NF-κB信号通路可能在胆脂瘤组织中处于激活状态,在胆脂瘤的发病机制中起重要作用。
综上所述,P-EGFR、P-ERK、NF-κB在中耳胆脂瘤上皮中的表达显著高于外耳道正常皮肤组,EG⁃FR/ERK/NF-κB信号通路可能参与了胆脂瘤组织的形成和发展,在胆脂瘤的发病机制中起重要作用。
1 廖军,林昶.中耳胆脂瘤的可能发病机制[J].中华耳科学,2015, 13(2):362-365.
Liao J,Lin C.Possible pathogenesis ofmiddle ear cholesteatoma [J].Chinese JournalofOtology,2015,13(2):362-365.
2 潘松林,龚树生.中耳胆脂瘤发病机制研究进展[J].听力学及言语疾病杂志,2008,16(4):338-340.
Pan SL,Gong SS.Progress on the pathgenesis ofmiddle ear cho⁃lesteatoma[J].Journal of Audiology and Speech Pathology,2008, 16(4):338-340.
3 Kuo CL.Etiopathogenesis of acquired cholesteatoma:prominent theories and recentadvances in biomolecular research[J].Laryn⁃goscope,2015,125(1):234-240.
4 Santarpia L,Lippman SM,El-Naggar AK.Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy[J].Ex⁃pertOpin Ther Targets,2012,16(1):103-119.
5 Lemmon MA,Schlessinger J.Cellsignalingby receptor tyrosine ki⁃nases[J].Cell,2010,141(7):1117–1134.
6 LiuW,Yin T,Ren J,etal.Activation of the EGFR/Akt/NF-κB/cy⁃ clinD1survival signaling pathway in human cholesteatoma epithe⁃lium[J].Eur Arch Otorhinolarygol,2014,271(2):265–273.
7 LiuW,Ren H,Ren J,etal.The role of EGFR/PI3K/Akt/cyclinD1 signaling athway in acquiredmiddle ear cholesteatoma[J].Media⁃tors Inflamm,2013,2013(5):651207
8 Mehdizadeh A,Somi MH,Darabi M,et al.Jabbarpour-Bonyadi M.Extracellular signal-regulated kinase 1 and 2 in cancer thera⁃py:a focus on hepatocellular carcinoma[J].Mol Biol Rep,2016, 43(2):107-116.
9 McCubrey JA,Steelman LS,ChappellWH,et al.Roles of the Raf/ MEK/ERK pathway in cell growth,malignant transformation and drug resistance[J].Biochim Biophys Acta,2007,1773(8):1263–1284.
10 Kim EK,Choi EJ.Compromised MAPK signaling in human dis⁃eases:an update[J].Arch Tocicol,2015,89(6):867-882.
11 Hinz M,Krappmann D,Eichten A,et al.NF-kappa B function in growth control:regulation of cyclinD1 expression and G0/ G1-to-S-phase transition [J].Mol Cell Biol,1999,19(4): 2690-2698.
12 Van Antwerp DJ,Martin SJ,KafriT,etal.Suppression of TNF-al⁃pha-induced apoptosis by NF-kappaB[J].Science,1996,274 (5288):787–789.
13 Huisman MA,De Heer E,Grote JJ.Survival signaling and termi⁃nal differentiation in cholesteatoma epithelium[J].Acta Otolaryn⁃gol,2007,127(4):424.
14 Huisman MA,De Heer E,Grote JJ.Terminal differentiation and mitogenactivated protein kinase signaling in human cholesteato⁃maepithelium[J].OtolNeurotol,2006,27(3):422-426.
15 Huisman A,De Heer E,Grote JJ.Sustained extracellular sig⁃nal-regulated kinase1/2 mitogen-activated protein kinase signal⁃ing is related to increased p21 expression in cholesteatoma epithe⁃lium[J].ActaOtolaryngol,2005,125(2):134-140.
16 刘东亮,马秀岚.PTEN及P-ERK和P-AKT在中耳胆脂瘤上皮中的表达及意义[J].临床耳鼻咽喉头颈外科杂志,2014,28 (4):238-242.
Liu D,Ma X.Expression and significance of PTEN,P-ERK and P-AKT in themiddle ear cholesteatoma[J].Lin Chuang Er BiYan Hou Tou JingWaiKe Za Zhi,2014,28(4):238-242.
17 Miyao M,Shinoda H,TakahashiS.Caspase-3,caspase-8,and nu⁃clear factor-kappaB expression in human cholesteatoma[J].Otol Neurotol,2006,27(1):8-13.
18 廖军,林昶.晚期糖基化终末产物受体与核因子-κβ在中耳胆脂瘤中的表达[J].中华耳科学,2015,13(4):729-733.
Liao J,Lin C.expression of receptors for advanced glycation end product(RAGE)and nuclear factor-κB(NF-κB)in middle ear cholesteatoma[J].Chinese Journal of Otology,2015,13(2): 362-365.
Expression and Significanceof P-EGFR,P-ERK and NF-κB in M idd le Ear Cholesteatoma Epithelium
WANGXiali1,XIEShumin2,WANGYuehui3,LIUWei4,YINTuanfang4,PENGAnquan4,REN Jihao4
1Hunan ProvincialMaternaland Child Health CareHospital,Departmentof PediatricOphthalmology and Otorhinolaryngology,Changsha,Hunan Province,China(410008).
2DepartmentofOtolaryngology-Head and Neck Surgery,TheXiangya Hospital,CentralSouth University,Changsha, Hunan Province,China(410008).
3 DepartmentofOtolaryngology-Head and Neck Surgery,FirstAffiliated HospitalofHenan University of Scienceand Technology,Luoyang,Henan Province,China(471000).
4DepartmentofOtolaryngology-Head and Neck Surgery,The Second Xiangya Hospital,Central South University,Otology Research InstituteofCentral South University,Changsha,Hunan Province,China(410011).
LIUWei Email:lw-007@163.com
ObjectiveTo study the expression of P-EGFR,P-ERK and NF-κB inm iddle ear cholesteatoma epithelium,and explore the potential roles of EGFR/ERK/NF-κB signaling transduction pathway in m iddle ear cholesteatomaepithelialhyperplasia.Methods SP immunohistochem icalassay and Western blotwere used to detect the expression and significance of P-EGFR,P-ERK and NF-κB in 30 casesofm iddle ear cholesteatoma tissue samples and 15 casesof normal ear skin specimens.Results(1)Immunohistochem istry showed P-EGFR was expressed in the cytoplasm and/or membrane of epithelialcells.P-EGFRwas positive in 19 of the 30m iddleear cholesteatoma specimens(63%),compared to 3 of the15 specimens(20%)in the controlgroup(P<0.05).P-ERK expression in cholesteatomawasdetected ata higher rate(21/30,70%)than normalexternalear canalskin(3/15,20%)(P<0.05).NF-κB immunoreactivity was detected in thenucleiofepithelialcellsatahigher rate in cholesteatoma(18/30,60%)than the controlgroup(2/15,13.3%)(P<0.05).Inmiddle ear cholesteatoma epithelium,there was a positive correlation between expression of P-EGFR,P-ERK and NF-κB(P<0.05).(2)Western blotdiscovered that the expression of P-EGFR,P-ERK and NF-κB in cholesteatomawas significantlymore than theamountof expression in skin.ConclusionsTheexpression of P-EGFR,P-ERK and NF-κB in m iddleear cholesteatomawassignificantly higher than normalskin.Activation of EGFR/ERK/NF-κB signaling transduction pathwaymay be involved in the information and developmentofmiddleearcholesteatoma.
Cholesteatoma;M iddle Ear;P-EGFR;P-ERK;NF-κB;EGFR/ERK/NF-κB Signaling Transduction Pathway
R764
A
1672-2922(2017)03-339-6
2017-01-09审核人:翟所强)
10.3969/j.issn.1672-2922.2017.03.013
国家自然科学基金(项目批准号:81400457)
王晓丽,硕士研究生,研究方向:耳科学
刘伟,Email:lw-007@163.com
