水飞蓟的基源鉴定与质量分析
2017-08-16郭万里聂作明周怀香梁宗锁
张 通,郭万里,聂作明,周怀香,梁宗锁,盛 清
(浙江理工大学, a.生命科学学院;b.浙江省植物次生代谢调控重点实验室,杭州 310018)
水飞蓟的基源鉴定与质量分析
张 通a,郭万里b,聂作明a,周怀香a,梁宗锁b,盛 清a
(浙江理工大学, a.生命科学学院;b.浙江省植物次生代谢调控重点实验室,杭州 310018)
为了探究不同产地的水飞蓟药材是否达到药典标准,对分别采集于内蒙古自治区、黑龙江省和辽宁省等地10个批次的水飞蓟样品进行了检测与分析。通过干燥法、炽灼法和热浸法对水飞蓟样品的水分含量、灰分含量以及浸出物含量进行检测分析,结果表明:所有批次的样品水分含量均小于10%,灰分含量均小于9%,浸出物含量均高于18%。同时,对水飞蓟进行了基源鉴定,通过性状鉴定、显微鉴定、DNA条形码以及高效液相四种方法对采集到的样品进行基源鉴定研究和比较,结果表明:四种方法均能够鉴别中药材水飞蓟,其中性状鉴定法更为简便,而DNA条形码技术和高效液相法准确性更高。
基源鉴定; 质量检测; DNA条形码; 高效液相
0 引 言
水飞蓟(Silybummarianum(L.) Gaertn.)又名水飞雉、奶蓟子、奶蓟等,为菊科水飞蓟属成员,1~2年生草本植物。原产于印度和巴基斯坦的喀什米尔山区,作为观赏植物,北京植物园于1952年从英国引入[1];而作为药材种植,水飞蓟则是由中国土产畜产进口公司天津土产公司于1972年从德国引进[2-3]。
水飞蓟植株高约100~150 cm,茎直立,近圆柱形,具锐刺,多分枝。叶为大型羽状或椭圆形披针状,无叶柄,表面亮绿色,有乳白色斑纹,头状花序,管状花,有紫色、白色两种花色[4]。果实(即种子)为长椭圆形,长约5~7 mm,宽约3 mm,成熟后呈暗棕色或黑色;成熟的果实千粒重约21~27 g,水飞蓟果实主要由种子胚和外皮两部分构成,无胚乳[5]。水飞蓟药用成分水飞蓟素主要存在于果实外皮(即种壳)中,含量约为壳中的3%~5%,种胚中水飞蓟素较少[6-7]。
水飞蓟是一种历史悠久的天然药物,被多国药典所收载,临床上常用于治疗急慢性肝炎、肝硬化、肝损伤等[8]。水飞蓟宾、水飞蓟亭、水飞蓟宁及其同分异构体构成统称为水飞蓟素,是水飞蓟药材的药用成分,其药理作用机制包括抑制人体产生一氧化氮、阻断部分真菌毒素与肝细胞膜受体特异性结合以及改善肝脏细胞酶活性等[9-10]。近年来水飞蓟素的应用被拓宽到癌症的治疗、抗炎和抗衰老等领域[11-12],因此水飞蓟的需求量也逐年上升。水飞蓟素是目前市场上销售的利加隆胶囊、复方益肝灵片等药物的主要有效成分,西利宾胺和水林佳也是目前临床治疗肝炎、肝硬化和肝损伤的主要辅助药物,其主要成分是水飞蓟宾[13]。
基源鉴定即用各种方法鉴定中药的来源物种,确定其真实性[14];基源鉴定是中药研究的基础,也是中药研究学的首要任务。性状鉴定是最基础的中药材基源鉴定方法,是根据药材的形状、颜色、大小、气味等特征对药材进行鉴定的方法,因其简洁、快速的特点至今仍被广泛应用。显微鉴定是利用观察显微切片的结构和特征来确定药材的来源物种,这种方法对于结构不同的物种十分有效。理化鉴定,则是利用物理的、化学的方法或分析仪器来确定药材的真实性,常用的方法有薄层色谱法、紫外光谱法、高效液相法等,其中高效液相法既能够用于药材的基源鉴定还能够用于评价质量,并能够准确检测中药中有效成分或标志性成分及其含量。DNA条形码是利用基因组中一段公认的、较短的序列进行物种鉴定的一种分子技术,陈士林等建立的以ITS2为主,PsbA-trnH为辅的植物中药材DNA条形码鉴定系统快速、准确而有效,备受欢迎,其“中药材DNA条形码分子鉴定法指导原则”已被2015版《中华人民共和国药典》(以下简称“中国药典”)所收录[15]。本文结合中国药典、美国药典及中药材常用的鉴定方法对采集到的样品进行基源鉴定和质量分析,为水飞蓟进一步的分子和药理研究奠定基础。
1 材料与方法
1.1 样品采集
10个批次的水飞蓟样品于2014年7月中旬和2015年7月中旬分别采集自辽宁省的盘锦市和海城地区,黑龙江省虎林市的云山农场以及呼玛县地区,内蒙古自治区的海拉尔县地区、呼伦贝尔市的绰尔河农场以及牙克石农场,样品编号、采集重量、采集时间和采集地点如表1所示。所有样品在37 ℃干燥至恒重保存于4 ℃冰箱中。
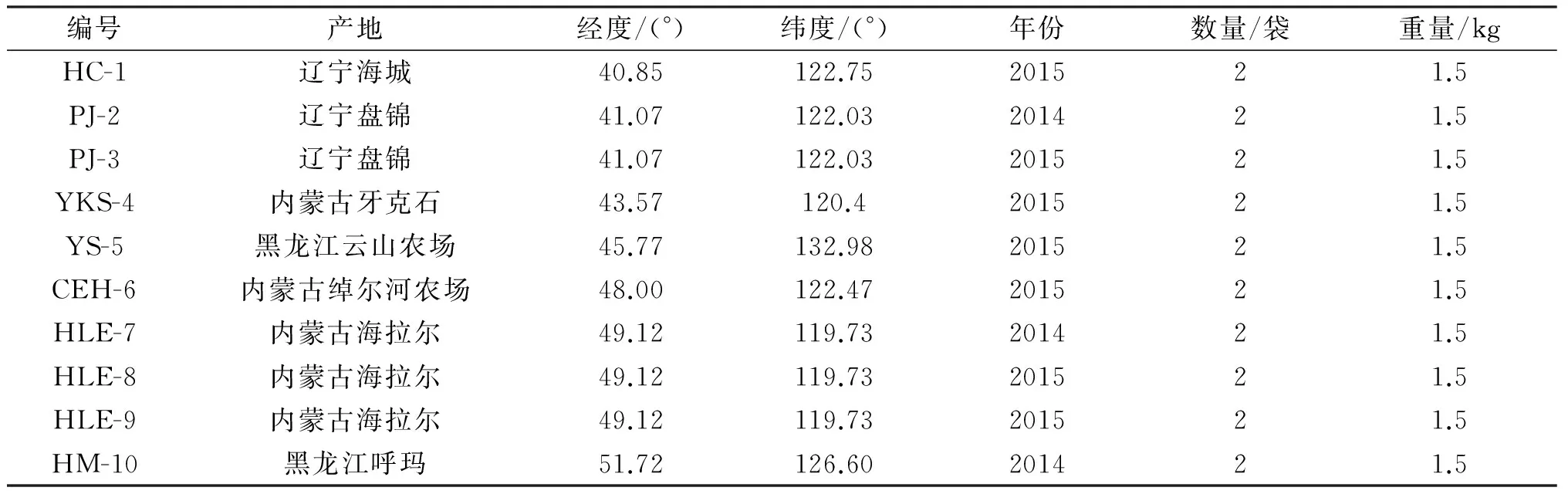
表1 样品采集地点及编号
1.2 质量检测分析
采用《中国药典》的方法[16]对水飞蓟进行质量检测分析,具体过程如下:
水分含量的测定:用分析取水飞蓟样品2~4 g,置于40 mm×25 mm扁形称量瓶中,并打开瓶盖放置于真空干燥箱中,设置干燥箱温度为105 ℃,干燥5 h,待冷却后,称重;再在上述样品至于真空干燥箱中干燥1 h后称重,若两次称重差异不超高5 mg,则依据减失的重量计算水飞蓟中的含水量,若称重差异超过5 mg,则继续放入干燥箱中干燥,直至减失重量的差异不超过5 mg,计算水飞蓟样品中水分的含量。
灰分含量的测定:将水飞蓟样品粉碎通过24目筛子后,精密称定水飞蓟样品2~3 g,置于高温炉中,缓缓加热,提升温度至600 ℃左右,使水飞蓟样品完全灰化至恒重。根据剩余的水飞蓟残渣重量,计算水飞蓟样品中总灰分的含量。
浸出物含量的测定:取水飞蓟样品3 g,置于含有100 mL乙醇的250 mL容量的锥形瓶中称取样品重量;静置0.5~1.0 h后,加热锥形瓶,连续回流冷凝管并保持微沸1.0 h,关闭加热套,待放冷后再次称取样品重量;用水补足减失的重量,用干燥器滤过,取滤液25 mL置于干燥的挥发皿中,用80 ℃水浴蒸干后,干燥3.0 h,迅速称定重量,以干燥品计算水飞蓟样品中浸出物的含量。
1.3 基源鉴定
1.3.1 性状鉴定
随机从各个批次的水飞蓟样品中选取20粒种子用游标卡尺测量种子的长度和宽度,计算平均值和标准差。千粒重:随机从每个批次样品中选取1000粒用分析天平称量,重复5次,计算平均值和标准差。同时,观察并记录不同批次样品种子的形状、大小和色泽等。
1.3.2 显微镜鉴定
从每个批次的样品中随机挑取5~10粒种子,用温水浸泡3.0 h后切片,用毛笔将切好的种子横剖面挑入盛有清水的培养皿中,挑取完整的薄的横剖面制片,置于显微镜下观察。
1.3.3 DNA条形码鉴定
水飞蓟DNA条形码鉴定采用ITS2序列[17]进行鉴定。具体过程如下:水飞蓟DNA的提取将0.3 g的种子样品通过外力磨碎,加入DNA Wash Buffer(Ascorbic acid、citric acid、PVP、HEPES free acid配制)1 mL清洗两次,弃去上清;加入1 mL DNA plant zol:β-巯基乙醇(24∶1)溶液1 mL,充分混匀,置于65 ℃水浴锅45 min,每15 min混匀一次;加入750 mL氯仿,混合均匀离心取上清;上清液加入适量体积的异丙醇混匀,离心弃去上清;加入75%乙醇对DNA进行清洗,然后将所得到的DNA溶解至0.1 mmol/L进行PCR反应。PCR反应:ITS2序列正向引物:5′-ATGCGATACTTGGT GTGAAT-3′,反向引物:5′-GACGCTTCTCCAG ACTACAAT-3′; 扩增程序为:94 ℃、5 min;94 ℃、30 s, 56 ℃、30 s,72 ℃、45 s, 40 个循环;72 ℃、10 min。rTaq酶试剂盒由Takara公司提供,PCR反应以25 μL为参照,包括1×Buffer,0.2 mmol/L dNTPs,0.1 mmol/L引物对和提取的DNA,0.5 μL rTaq酶,ddH2O至25 μL进行在PCR仪进行反应。用浓度为1%琼脂糖凝胶电泳对PCR扩增产物进行检测,并且将所有的有条带的样品PCR扩增产物送到测序公司测序。采用MEGA软件对测序的结果进行拼接获得相应的DNA序列,将序列在中药材DNA条形码鉴定系统中进行物种鉴定,确定序列相似性最高的物种。
1.3.4 高效液相法鉴定
水飞蓟素标准溶液制备:精密称取水飞蓟提取物粉末标准品7 mg(溶于2 mL甲醇中,20 min超声处理,用甲醇稀释到0.7 mg/mL;通过0.45 μm的滤膜过滤去除杂质;稀释5倍获得0.14 mg/mL的水飞蓟提取物粉末标准品溶液。
水飞蓟宾标准溶液的制备:精密称取水飞蓟宾标准品1 mg溶于2 mL的甲醇中,再分别稀释制备成0.500、0.100、0.020、0.004、0.002 mg/mL的水飞蓟宾标准溶液,20 min超声处理;通过0.45 μm的滤膜过滤去除杂质。
标准曲线的制作:根据水飞蓟宾5个浓度的标准品溶液,每个浓度的溶液进样3次,记录峰面积,以每个峰面积的平均值x为横坐标,水飞蓟宾标准品溶液的浓度(mg/mL)y为纵坐标,进行线性回归。
样品溶液的制备的方法参考索氏萃取法[18],具体过程如下:取约10 g充分研磨的水飞蓟粉末精密称定并置于一个连续回流的提取套管中,用小棉球塞住冷凝管的上端,将套管装入250 mL的圆底烧瓶中(内含150 mL的正己烷),加热4 h除去脂类成分;把装有正己烷的圆底烧瓶从提取套管分离,弃去正己烷溶液,干燥萃取套管除去附着的正己烷;再将套管装入配有 250 mL圆底烧瓶(内含100 mL乙酸乙酯) 的连续提取器中,保持微沸,使溶剂轻轻回流。8 h后,把提取物定量转移到100 mL容量瓶中,添加甲醇至刻度作为样品储备溶液。取出1 mL样品储备溶液用甲醇稀释25倍即得到样品溶液。
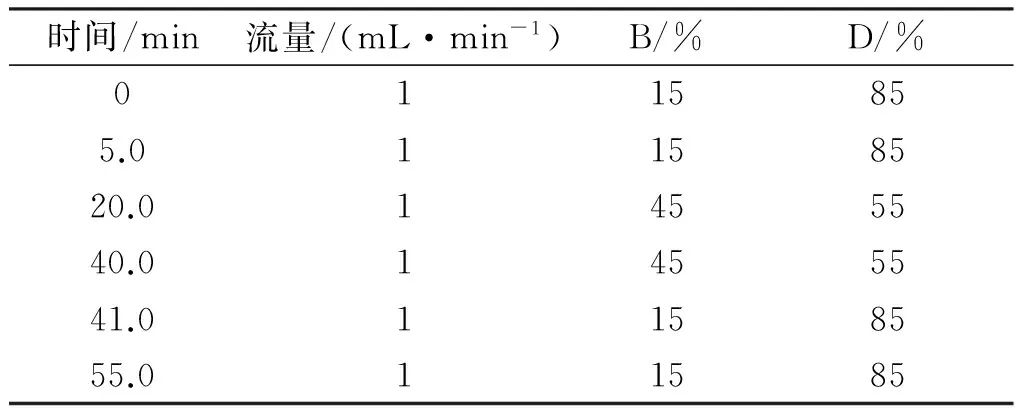
表2 HPLC流动相配比及洗脱时间
注:检测波长:UV288 nm;色谱柱:C18色谱柱(250 mm×4.6 mm,5 μm);柱温:40 ℃;流速:1 mL/min;上样量:10 μL;流动相:溶液B:V甲醇∶V磷酸∶V水=20∶0.5∶80,溶液D:V甲醇∶V磷酸∶V水=80∶0.5∶20。
2 结果与分析
2.1 水飞蓟的水分、灰分和浸出物含量测定
2015版中国药典中关于药材水飞蓟的规定为:水分含量不得超过10%,灰分含量不得高于9%,浸出物含量不得低于18%[16]。不同产地水飞蓟的水分、灰分、浸出物的含量测定结果如图1所示。水分含量最高的药材来自辽宁海城,达到7.065%,灰分含量最高的药材来自于黑龙江云山农场,达到5.306%,浸出物含量最高的药材来自于辽宁海城,达到30.844%。图1结果表明:所有产地水飞蓟药材的水分含量均低于10%,灰分含量均低于9%,而浸出物的含量则远远高于18%,符合中国药典的规定。
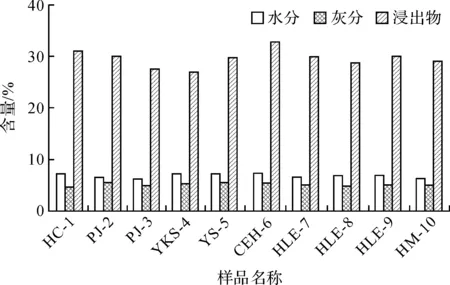
图1 不同产地水飞蓟药材的水分、灰分及浸出物含量
2.2 基源鉴定
2.2.1 性状鉴定
中国药典中关于水飞蓟的性状描述为:呈长倒卵形或椭圆形,长5~7 mm,宽2~3 mm,表面淡灰棕色或黑褐色,光滑,有细纵花纹,顶端钝圆,稍宽,有一圆环,中间具花柱残迹,基部略窄[16]。通过实验测量得到水飞蓟样品的形状、大小、色泽等性状特征,并与中国药典的描述进行比较确定其真实性,如图2所示。
从图2可以看出,水飞蓟药材的形状呈现椭圆形,顶端稍宽,可以清晰地看到花柱残迹的圆环,底部比顶端略窄,药材颜色可分为三种:黑褐色、棕色及灰白色,有纵细花纹贯穿于种皮之上。由表3可以看出,10个批次水飞蓟药材样品的宽度在2.85~3.50 mm之间,长度在6.40~7.50 mm之间,种子的千粒重在22~28 g之间,通过与药典描述比较发现,样品的形状和颜色与药典的规定完全吻合,但样品的大小较药典的规定稍大,分析后认为样品的大小与药材的品质优劣有关,但不影响性状鉴定的结果,因此以上性状可以作为水飞蓟基源鉴定的依据。

图2 不同产地水飞蓟药材样品
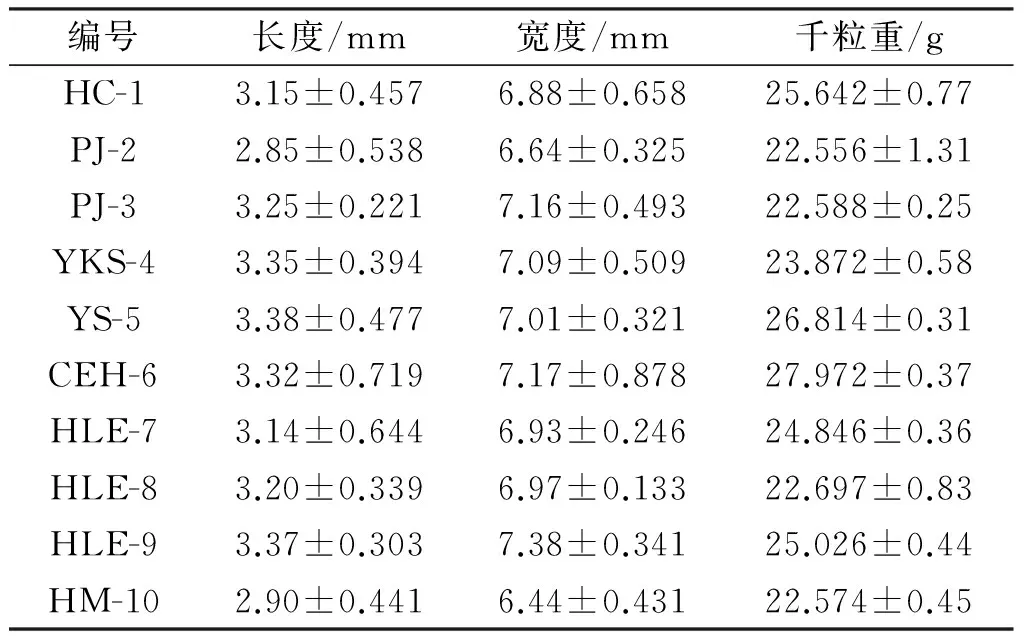
编号长度/mm宽度/mm千粒重/gHC-13.15±0.4576.88±0.65825.642±0.77PJ-22.85±0.5386.64±0.32522.556±1.31PJ-33.25±0.2217.16±0.49322.588±0.25YKS-43.35±0.3947.09±0.50923.872±0.58YS-53.38±0.4777.01±0.32126.814±0.31CEH-63.32±0.7197.17±0.87827.972±0.37HLE-73.14±0.6446.93±0.24624.846±0.36HLE-83.20±0.3396.97±0.13322.697±0.83HLE-93.37±0.3037.38±0.34125.026±0.44HM-102.90±0.4416.44±0.43122.574±0.45
2.2.2 显微鉴定
美国药典规定的水飞蓟的显微鉴定的依据为:水飞蓟果壁表皮由无色栅栏细胞构成,无色栅栏细胞与表皮垂直排列,具有加厚的外侧细胞壁,并有裂缝状腔深入其内[18]。通过显微镜对样品的显微结构进行观察和分析,结果如图3和图4所示。
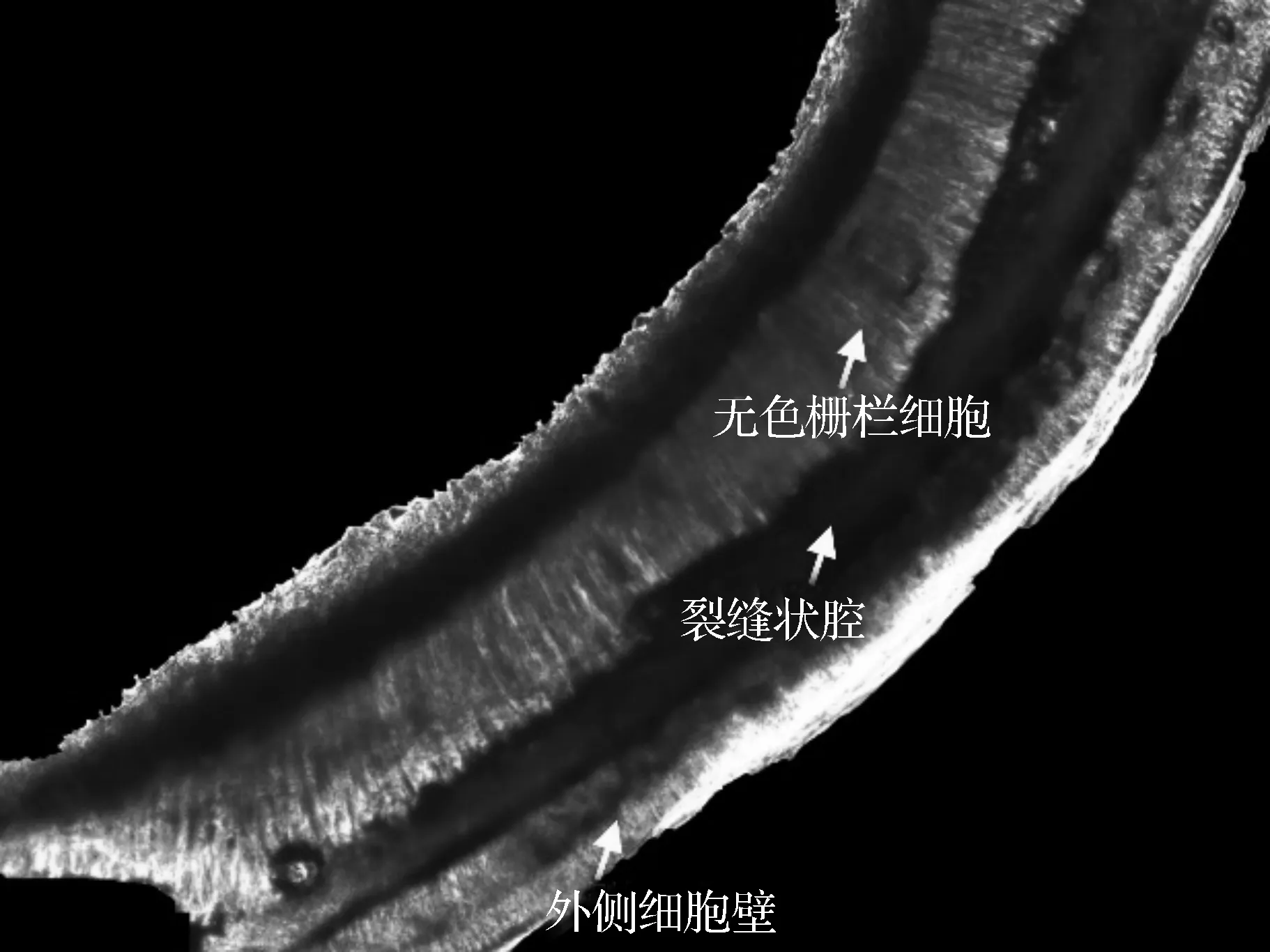
图3 荧光显微镜下的水飞蓟种皮
图3为图4中样品PJ-2的放大图,通过图3可以清晰地看到外侧细胞壁、裂缝状的腔以及无色栅栏细胞。不同颜色的种子的外侧细胞壁细胞颜色不同,其中黑褐色种子的外侧细胞壁细胞颜色深,表明含有更多的色素,棕色种子的外侧细胞壁颜色较浅,色素含量少,而灰白色种子的外侧细胞壁为无色,不含色素,裂缝状的腔排布在外侧细胞壁内侧与无色栏珊细胞相接与美国药典描述的性状一致。
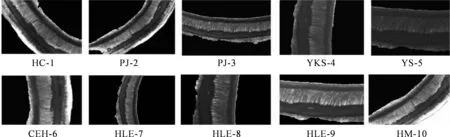
图4 各产地水飞蓟荧光显微镜下的种皮
2.2.3 DNA条形码鉴定
DNA条形码技术是通过比较一段通用的DNA序列,对样品的物种进行鉴定的方法[17]。图5为水飞蓟药材ITS2序列的PCR电泳图,10个批次的样品都成功扩增目的片段,将PCR产物送往生物公司测序。
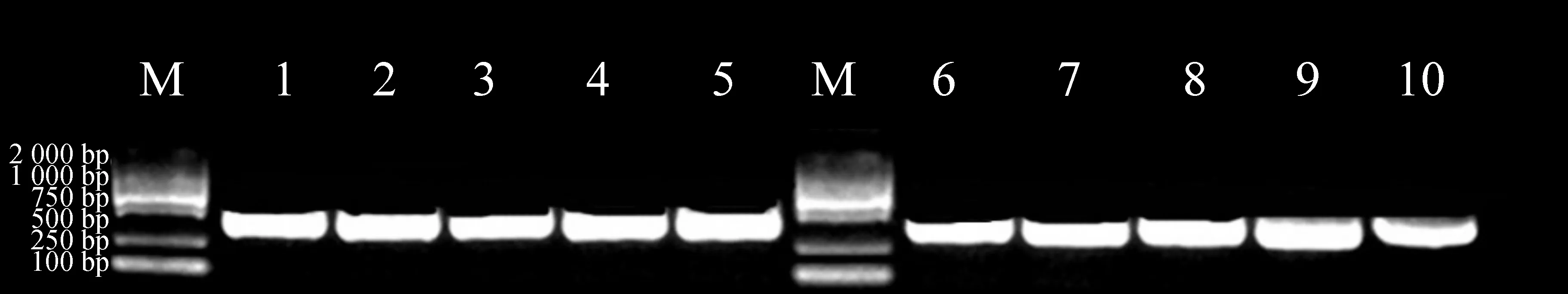
图5 水飞蓟样品PCR电泳图
水飞蓟ITS2序列长度在214和216 bp之间,平均GC含量为63.08%,在154 bp处容易发生CT突变,而在178、189和201 bp处容易产生缺失。并将所有样品的ITS2序列输入到中药材DNA条形码鉴定系统(http://www.tcmbarcode.cn/china/)或在GenBank数据库中BLAST进行同源性标记,得到的序列相似性最高的物种均为水飞蓟,序列相似性为100%。将所有样品的ITS2序列与GenBank上数据库与水飞蓟相似性达到90%的序列构建NJ进化树分析,结果如图6所示。结果表明:水飞蓟和其他蓟属的近源物种分别聚为一支,因此ITS2序列可以作为DNA条形码鉴别水飞蓟及其混伪品。
2.2.4 高效液相法鉴定
通过比较水飞蓟素标准品液相色谱图(图7中1号曲线)和样品提取物色谱图(图7中2号曲线)发现,样品提取物每一种成分与水飞蓟素标准溶液的相对保留时间是一致的,其中a峰为水飞蓟亭,b峰为水飞蓟宁,c峰为水飞蓟宾A,d峰为水飞蓟宾B,e峰为异水飞蓟宾A,f峰为异水飞蓟宾B,g峰为脱氢水飞蓟宾,从图6可以清晰地看到样品中每一种成分的色谱峰,通过水飞蓟宾标准品标准曲线(图8),y=5×10-8x,其中X轴表示通过高效液相测得的峰面积,Y轴表示成分的含量,只要将实验测得的数据即某种成分的峰面积代入标准曲线方程就可以计算出这种成分含量,因此该方法可以作为基源鉴定的依据,还可以运用此方法测定水飞蓟药材中各种有效成分的含量。
3 讨 论
水飞蓟作为一种集具药用价值和观赏价值的经济作物,在我国种植面积非常广泛,已经成为药农增加收益的选择之一。近年来随着水飞蓟抗肿瘤活性研究的逐渐深入,市场对于药材水飞蓟的需求量也越来越多,因此建立一套快捷、有效的水飞蓟的鉴别方法与质量检测体系已经迫在眉睫。本文通过干燥法、炽灼法和热浸法对不同产地的水飞蓟药材的水分、灰分和浸出物进行检测,通过与中国药典[16]的标准进行比较,检测这些水飞蓟样品是否符合要求。水分、灰分和浸出物作为评价药材质量的重要指标,往往被忽略,然而这些指标成分对于药材的质量和疗效具有重要的作用。
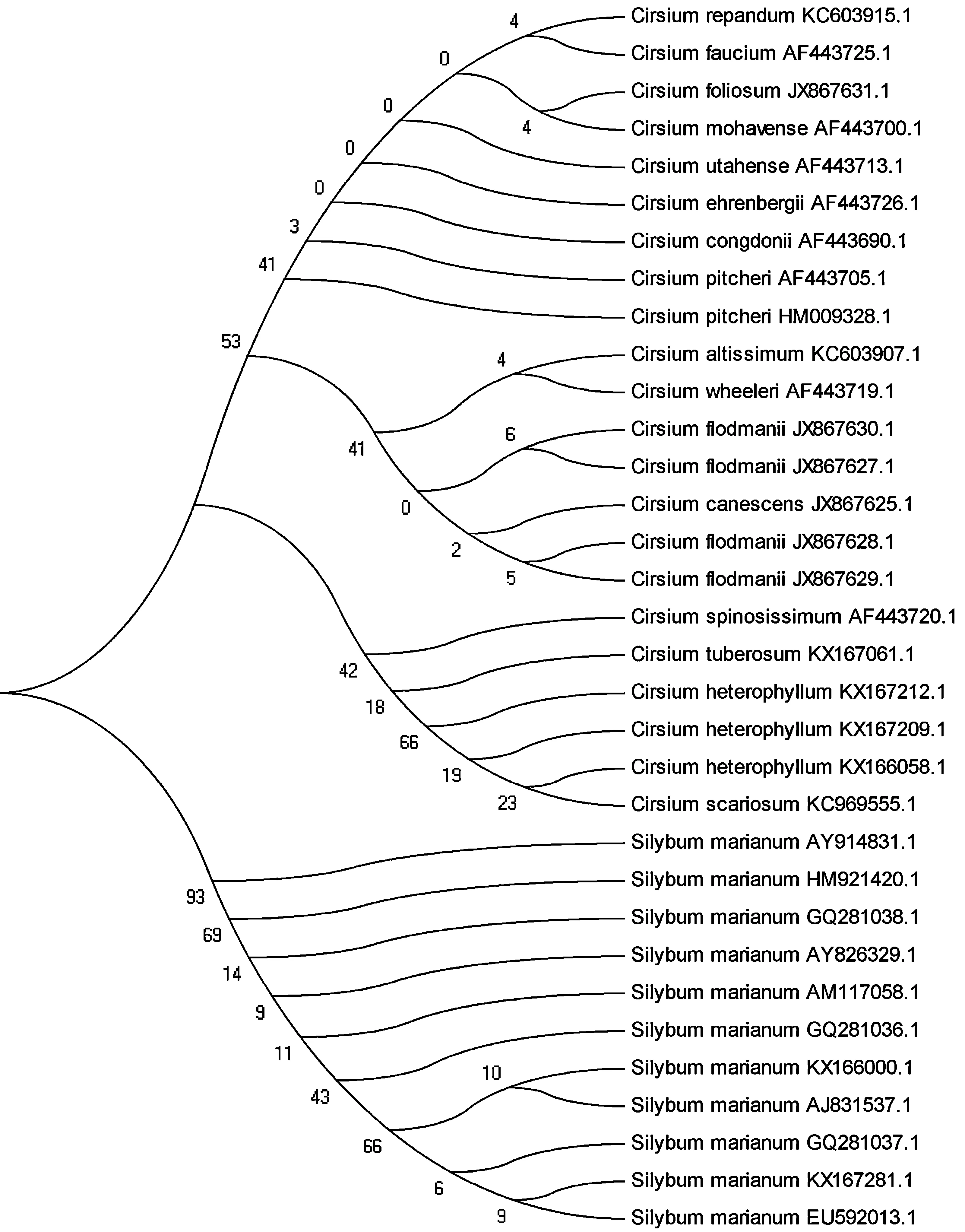
图6 基于ITS2序列构建的水飞蓟及其它蓟属植物的NJ树
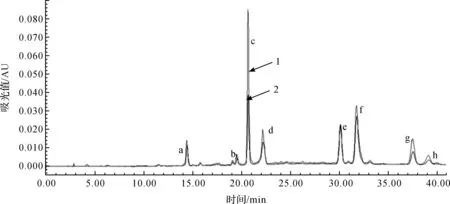
1.标准品; 2.样品图7 水飞蓟素高效液相色谱比较
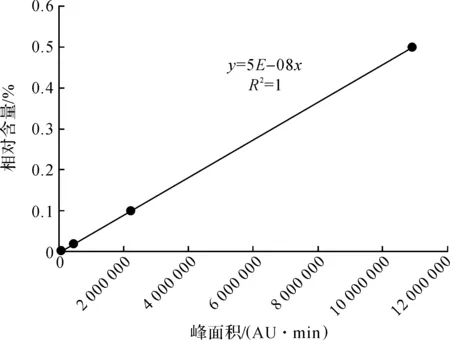
图8 水飞蓟宾的标准曲线
中药材品种的混乱及真伪鉴定方法的欠缺严重影响中医药的疗效与安全,对于传统的中药材基源鉴定方法,性状鉴定法快速简便,实用性强,但是准确性不足,容易出错;显微鉴定对于区别不同科属的植物有着强大的优势,但是对于区别水飞蓟的亲缘物种时有一定的难度[14];高效液相法准确很高,但是对于设备要求比较高,如果想要进一步检测水飞蓟中各种药效成分的含量,如水飞蓟宾、水飞蓟亭、水飞蓟宁的含量,可以采用高效液相法,既能够准确地对药材进行鉴定又能够检测药效成分;DNA条形码技术作为一种新的分子鉴定技术,因其准确性高,简便易行的特点,已被广泛应用于多种中药材及药用植物的鉴定中,如冬虫夏草的鉴定[19]、前胡的鉴定[20]等。本文通过上述四种方法对采集到的水飞蓟样品进行了基源鉴定研究,各种方法的操作过程及步骤已在文中说明,这对于人们选择一套合适的中药材基源鉴定方法具有参考意义。目前中药的安全问题已成为制约中药产业发展和获得国际认可的“瓶颈”,其中如何对药材进行基源鉴定对于解决这一问题有着重要意义。
4 结 论
本文通过干燥法对不同产地的水飞蓟样品的水分进行检测,发现不同产地的水飞蓟样品均达到药典规定的标准,对于保持中药材水飞蓟中有效成分的药效和长时间储存具有重要的意义。通过炽灼法检测水飞蓟样品中的灰分含量发现,所有批次的样品的灰分含量均低于9%(中国药典的标准),能够确保水飞蓟的品质。浸出物含量是中药材质量控制重要指标之一,本文通过热浸法对水飞蓟的浸出物含量进行了检测,发现所有批次的样品均远远超过药典规定的标准,对于制药企业选购水飞蓟药材用于生产实践具有重要的意义。本文对采集自东北地区7个产地的水飞蓟样品采用四种方法进行基源鉴定,对于鉴别不同来源的中药材的品质非常重要。不同品种的中药材的最适鉴定方法也不同,本文开展的水飞蓟基源鉴定对于中药材鉴定的方法选择具有借鉴意义。
[1] POST-WHITE J, LADASE J, KELLY K M. Advances in the use of milk thistle (Silybum marianum)[J]. Integrative Cancer Therapies,2007,6(2):104-109.
[2] 安咏梅.水飞蓟的经济价值和栽培技术[J].北方园艺,2014,30(16):161-163.
[3] 徐德峰,张卫明,史劲松,等.国内水飞蓟资源利用现状与展望[J].食品研究与开发,2007,28(2):157-161.
[4] 朱淑云.水飞蓟籽仁蛋白和油的主要特性与生物活性研究[D].镇江:江苏大学,2013:7-8.
[5] 刘宏.水飞蓟种子活性成分的提取、分离及初步活性研究[D].北京:北京化工大学,2009:19-20.
[6] SIEGEL A B, STEBBING J. Milk thistle: early seeds of potential[J]. The Lancet Oncology, 2013, 14 (10): 929-930.
[7] CUFI S, BONAVIA R, VAZQUEZ-MARTIN A, et al. Silibinin meglumine, a water-soluble form of milk thistle silymarin, is an orally active anti-cancer agent that impedes the epithelial-to-mesenchymal transition (EMT) in EGFR-mutant non-small-cell lung carcinoma cells[J].Food and Chemical Toxicology, 2013, 60(10):360-368.
[8] KROLL D J, SHAW H S, OBERLIES N H. Milk thistle nomenclature: Why it matters in cancer research and pharmacokinetic studies[J]. Integrative Cancer Therapies 2007, 6 (2): 110-119.
[9] 王红军,姜媛媛,路平,等.水飞蓟宾的抗肿瘤、抗氧化和免疫调节分子药理学机制研究进展[J].药学学报,2010,45(4):413-421.
[10] ESPOSITO M, DI-PIERRO P, DEJONGHE W, et al. Enzymatic milk clotting activity in artichoke (Cynara scolymus) leaves and alpine thistle (Carduus defloratus) flowers. Immobilization of alpine thistle aspartic protease[J]. Food Chemistry, 2016, 204:115-121.
[11] CUA I, OLIMAN M. The use of silymarin in chronic hepatitis C infection: an updated systematic review and meta-analysis[J].Journal of Viral Hepatitis , 2014, 21:27-27.
[12] CLICHICI S, OLTEANU D, NAGY AL, et al. Silymarin inhibits the progression of fibrosis in the early stages of liver injury in ccl4-treated rats[J]. Journal of Medicinal Food, 2015, 18 (3): 290-298.
[13] 巫秀美,刘光明,冯玉冰,等.水飞蓟宾类黄酮木质素衍生物的研究进展[J].国际药学研究杂志,2010,37(3):187-197.
[14] 刘义梅.中药鉴定学基源鉴定方法探讨[J].湖北中医药大学学报,2014,16(6):54-58.
[15] 袁庆军,张文婧,姜丹,等.论中药分子鉴定的方法和原则[J].植物分类与资源学报,2012,34(6):607-613.
[16] 国家药典委员会.中国药典[M].北京:中国医药科技出版社,2015;82-83.
[17] CHEN S L, Yao H, HAN J P, et al. Validation of the ITS2 Region as a Novel DNA Barcode for Identifying Medicinal Plant Species[J]. Plos One, 2010, 5 (1)e8613.
[18] The United States Pharmacopeial Convention. The United States Pharmacopeia[M]. 35th,Washington:U.S. Pharmacopeial Formulary,2012: 1384-1385.
[19] XIANG L, SONG J Y, XIN T Y, et al. DNA barcoding the commercial Chinese caterpillar fungus[J].Fems Microbiology Letters ,2013,347(2):156-162.
[20]侯典云,宋经元,杨培,等.基于ITS2序列鉴别前胡和紫花前胡药材及其混伪品[J].中国中药杂志,2014,39(21):4186-4190.
(责任编辑: 唐志荣)
Source Identification and Quality Analysis ofSilybumMarianum(L.) Gaertn. from Different Areas of Origin
ZHANGTonga,GUOWanlib,NIEZuominga,ZHOUHuaixianga,LIANGZongsuob,SHENGQinga
(a. College of Life Science; b. Key Laboratory of Plant Secondary Metabolism and Regulation of Zhejiang Province,Zhejiang Sci-Tech University, Hangzhou 310018; China)
To explore whetherSilybummarianum(L.)Gaertn. in different producing area reaches the pharmacopoeia criterion, 10 batches ofSilybummarianum(L.)Gaertn. collected from Inner Mongolia, Heilongjiang and Liaoning Province were detected and analyzed respectively. The moisture content, ash content and extractive content of the samples were detected by drying method, burning method and hot dipping method. The results show that the water content of all samples is less than 10%; the ash content is less than 9% and the content of extract is higher than 18%. Besides, source identification was carried out for the samples by four methods including character identification, microscopic identification, DNA barcoding and high performance liquid chromatography(HPLC). The results indicate that the four methods can identifySilybummarianum(L.)Gaertn. Character identification method is simpler, while DNA barcoding technique and HPLC present higher accuracy.
source identification; quality inspection; DNA barcoding; HPLC
10.3969/j.issn.1673-3851.2017.05.025
2016-11-30 网络出版日期: 2017-04-25
国家自然科学基金青年科学基金项目(81373908)
张 通(1992-),男,河南南阳人,硕士研究生,主要从事药用植物分子方面的研究。
盛 清,E-mail:csheng@zstu.edu.cn
Q946.82
A
1673- 3851 (2017) 03- 0467- 08
