负载型双金属催化剂非均相催化甲基橙的氧化分解
2017-08-15冯茹月
孙 宏,张 泽,冯茹月
(1. 齐齐哈尔大学 化学与化学工程学院,黑龙江 齐齐哈尔 161006;2. 齐齐哈尔市环境监测中心站,黑龙江 齐齐哈尔 161005)
负载型双金属催化剂非均相催化甲基橙的氧化分解
孙 宏1,张 泽2,冯茹月1
(1. 齐齐哈尔大学 化学与化学工程学院,黑龙江 齐齐哈尔 161006;2. 齐齐哈尔市环境监测中心站,黑龙江 齐齐哈尔 161005)
以ZnO,Cu(NO3)2和MnSO4等为原料制得ZnO负载铜锰双金属(CMZ)催化剂,并在H2O2/NaHCO3体系中氧化分解甲基橙(MO),通过XPS,AAS,UV-vis等方法分析了CMZ催化剂的组成,考察了反应条件对催化氧化反应的影响,对MO氧化分解原理进行了初步分析。实验结果表明,氧化分解MO适宜的反应条件为:催化剂用量2 g/L,n(H2O2)∶n(MO)= 160∶1,n(NaHCO3)∶n(H2O2)= 1∶1,MO质量浓度20 mg/L,初始pH = 8.4,反应温度35 ℃。在该条件下,反应120 min后MO的氧化分解率达到81.17%。该体系适合处理碱性MO废水。
负载双金属催化剂;铜;锰;H2O2/NaHCO3;甲基橙
目前纺织印染业中应用最普遍的染料为偶氮染料,偶氮染料由—N==N—将稳定芳环和致癌的芳胺键合而成,芳环上引入助色基团(如—SO3H,—OH,—COOH等)增加水溶性,因此偶氮染料水溶好、毒性强,很难生物降解。尝试采用Fenton氧化法降解碱性溶液中的甲基橙(MO)。在碱性溶液中Fe(Ⅱ)容易发生沉淀,失去催化作用,H2O2易分解生成氧气,电极电位下降,因此可采用Cu(Ⅱ)、Mn(Ⅱ)和Co(Ⅱ)进行均相催化,同时加入NaHCO3提高氧化效能[1-3],但均相催化剂难以分离回用。文献报道的非均相催化剂有苯甲酸铜[4]、CuFe2O4/Cu@C[5]、AgX/ZnO[6]、CoMgAl-SHTs[7]、ZnO[8]和Fe-Ni掺杂ZnO[9]等,但上述催化剂的制备工艺复杂。
本工作以ZnO,Cu(NO3)2和MnSO4等为原料制备得到ZnO负载铜锰双金属(CMZ)催化剂,利用该催化剂在H2O2/NaHCO3体系中氧化分解MO,采用XPS,AAS,UV-vis等方法分析了催化剂的组成,考察了氧化分解MO适宜的反应条件,并对氧化分解原理进行了初步分析。
1 实验部分
1.1 仪器与试剂
Cu(NO3)2,MnSO4,NaHCO3,ZnO,MO,H2O2(纯度30%):分析纯,上海国药集团化学试剂有限公司。实验用水为去离子水。
NICOLET-380型傅里叶变换红外光谱仪:美国Thermo公司;ESCALAB 250 Xi型 X射线光电子能谱仪:美国Thermo公司;AA320N型原子吸收分光光度计:上海仪电公司;TU-1901型紫外可见分光光度计:北京普析通用公司。
1.2 CMZ催化剂的制备
将ZnO 用蒸馏水洗涤后干燥,将干燥后的ZnO 加入Cu(NO3)2和MnSO4溶液中摇匀,静态吸附72 h后抽滤,留取滤液。用蒸馏水反复洗涤固体至不含离子,在真空干燥箱中105 ℃下烘干至恒重,密闭保存。利用原子吸收分光光度计测定滤液中Cu(Ⅱ)和Mn(Ⅱ)离子的含量,并计算得到Cu(Ⅱ)吸附率为98%,Mn(Ⅱ)吸附率为97%。
1.3 催化性能试验
在100 mL比色管中,分别加入一定体积的200 mg/L MO溶液、13 mmol/L H2O2和50 mmol/L NaHCO3溶液,然后加入CMZ催化剂摇匀后定容至50 mL,开始氧化分解反应。反应一段时间后取上清液,离心后用分光光度计在λmax= 464 nm 处测定MO的吸光度,根据郎伯-比尔定律计算水中MO的含量,按式(1)计算MO的氧化分解率(D)。

式中,ρ0,ρt分别代表初始和反应后的MO浓度,mg/L。
2 结果与讨论
2.1 XPS表征结果
CMZ催化剂表面元素的含量及结合能见表1。从表1可看出,催化剂负载后在结合能654 eV附近出现强的Mn 2p吸收峰,在934 eV附近出现了新的Cu 2p强吸收峰,结合原子吸收分光光度法测定结果,证实Cu(Ⅱ)和Mn(Ⅱ)已负载于ZnO表面上。
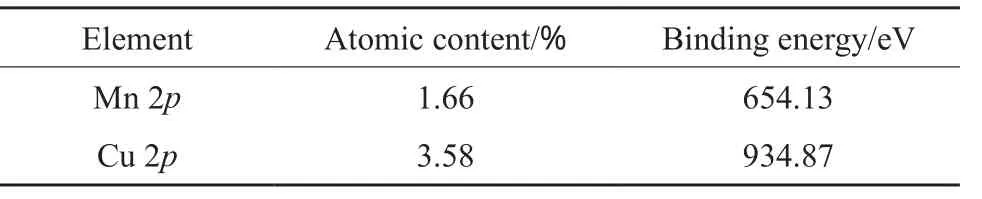
表1 CMZ催化剂表面元素的含量及结合能Table 1 Chemical composition and binding energy of the catalyst surface
2.2 催化氧化分解MO的性能
2.2.1 不同催化剂和用量对氧化分解的影响
不同催化剂对MO氧化分解的影响见图1。
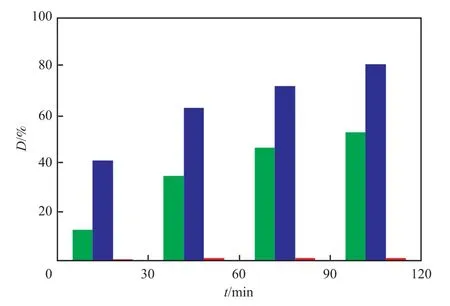
图1 不同催化剂对MO氧化分解的影响Fig.1 Effect of different catalyst on degradation rate(D) of methyl orange(MO).
由图1可知,ZnO负载Mn(Ⅱ)的催化剂催化作用很弱,染料几乎不能氧化,说明Mn(Ⅱ)不能催化体系产生活性物种MnⅣ== O。ZnO负载Cu(Ⅱ)的催化剂表现出良好的催化效能,反应120 min后MO氧化分解率为52.68%。而ZnO负载铜锰双金属的CMZ催化剂催化效果优于ZnO负载Cu(Ⅱ)催化剂,氧化分解率可达81.17%,提高近30百分点,说明CMZ催化剂不是Cu(Ⅱ)和Mn(Ⅱ)催化作用的叠加,而是Cu(Ⅱ)和Mn(Ⅱ)发生了相互协同增效作用,可能两者在反应中加快了自身氧化还原的循环过程,增加了体系中活性物种的形成,促进了MO的氧化分解(见式(4),(6),(7),(10),(12))。结合实验和文献[1-2]推测的氧化反应机理见式(2)~(12)。

将使用过的CMZ催化剂回收,抽滤洗涤并干燥研磨,进行催化氧化分解MO的重复性实验,使用3次后MO氧化分解率接近50%。表明回收催化剂的分解效果有损失,较初次使用损失近30百分点。
2.2.2 n(H2O2)∶n(MO)的影响
n(H2O2)∶n(MO)对MO氧化分解的影响见图2。
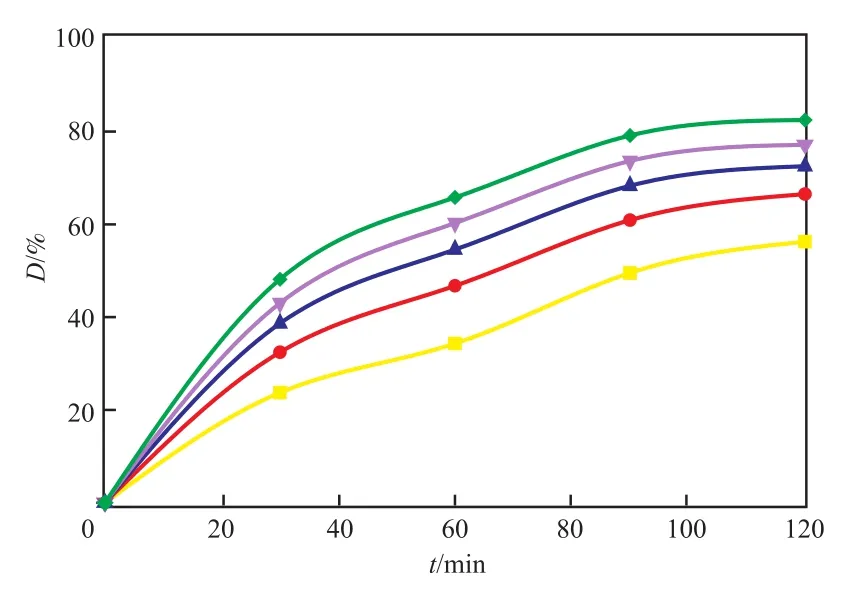
图2 n(H2O2)∶n(MO)对MO降解的影响Fig.2 Effect of the n(H2O2)∶n(MO) on degradation rate of MO.
从图2可知,随着n(H2O2)∶n(MO)的增加,MO的氧化分解率增大较快,当n(H2O2)∶n(MO)>160∶1时,MO氧化分解率增速放缓。说明氧化反应接近平衡时,过量H2O2不能提升反应速率。由于增加H2O2的含量会使HCO4-含量增加(见式(2)),从而引起式(3)和(5)的反应向正向进行,体系内CuⅢ和MnⅣ== O活性物种增加,同时铜锰催化H2O2快速分解产生较多的HO·,均能氧化MO(见式(8)~(9),(11)),但过多HO·在体系内容易猝灭,金属离子的活性物种也会按式(6)~(7)和(12)的方向进行,失去氧化活性,使反应速率变缓。
2.2.3 n(NaHCO3)∶n(H2O2)的影响
n(NaHCO3)∶n(H2O2)对MO氧化分解的影响见图3。从图3可看出,不加NaHCO3时MO氧化分解率很低,随着n(NaHCO3)∶n(H2O2)的增加,MO氧化分解率先增加后减小,当n(NaHCO3)∶n(H2O2)= 1∶1时,MO氧化分解率达到最高,表明适量NaHCO3对氧化反应具有促进作用。因此推测反应体系氧化分解MO主要按式(1),(2),(4)进行,HCO4-含量增加使CuⅢ和MnⅣ== O活性物种含量增加,反应速率加快。过量NaHCO3会和铜锰离子形成配合物,使活性物种的含量减少,分解反应受抑制。

图3 n(NaHCO3)∶n(H2O2)对MO氧化分解的影响Fig.3 Effect of the n(NaHCO3)∶n(H2O2) on degradation rate of MO.
2.2.4 催化剂用量对氧化分解的影响
CMZ催化剂用量对MO氧化分解的影响见图4。

图4 CMZ催化剂用量对MO氧化分解的影响Fig.4 Effect of CMZ catalyst dosage on degradation rate of MO.
从图4可知,反应60 min内,MO的氧化分解率随催化剂用量的增加而快速增大;当反应60 min后,催化剂用量超过2 g/L时,MO的氧化分解率接近。过少的催化剂不能迅速产生活性物种,导致氧化分解率较小。过多的催化剂使反应最初的氧化分解率上升较快,但随染料的不断消耗,活性物种间也会相互作用,而使氧化分解速率变小。因此,适宜的催化剂用量为2 g/L。
2.2.5 反应温度的影响
反应温度对MO氧化分解的影响见图5。从图5可看出,反应温度为25 ℃时,氧化分解率随反应时间的延长增幅明显;反应温度为35 ℃或45 ℃时,反应120 min后MO的氧化分解率相近;反应温度为45 ℃时,反应60 min后MO的氧化分解已接近平衡。这是因为,升高温度有利于H2O2的—O—O—键断裂形成较多的HO·从而提高反应速率,缩短反应平衡时间。考虑到升温增加能耗,故选择反应温度为35 ℃较适宜。
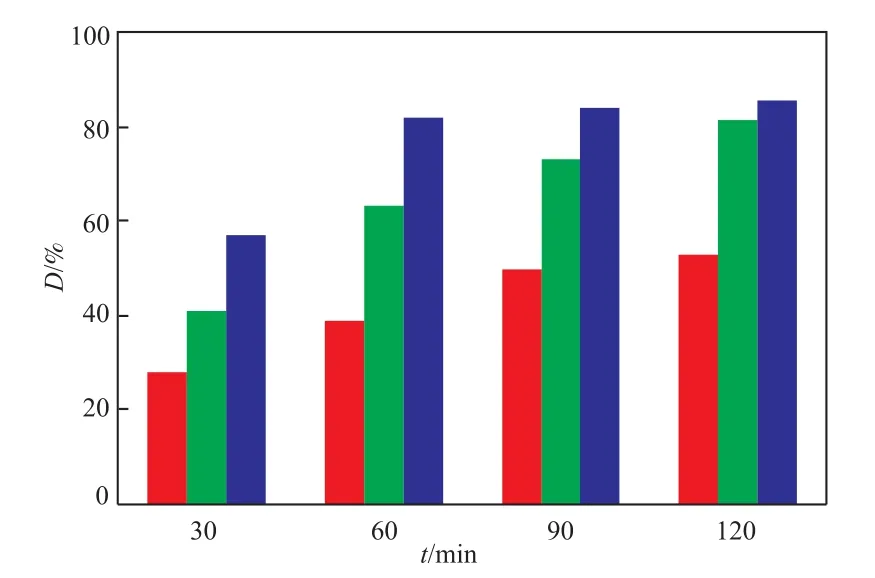
图5 反应温度对MO氧化分解的影响Fig.5 Effect of the reaction temperature on the degradationrate of MO.
综上所述,CMZ催化剂氧化分解MO的适宜条件为:催化剂用量2 g/L,n(H2O2)∶n(MO)= 160∶1,n(NaHCO3)∶n(H2O2)= 1∶1,MO质量浓度20 mg/L,初始pH = 8.4,反应温度35 ℃。在该条件下,反应120 min后MO的氧化分解率达到81.17%。
2.2.6 MO氧化分解过程的初步分析
对MO氧化分解过程进行UV-vis扫描,结果见图6。从图6可看出,在λ = 464 nm处—N==N—的特征吸收明显下降,表明MO分子的—N==N—键发生了断裂,且伴随最大吸收峰蓝移至λ = 341 nm处;推测分解时C—S键发生断裂,脱去—SO3Na基团,从而破坏了MO分子结构。MO在λ = 256 nm处为苯环特征吸收,苯环的氧化分解率为49.91%,说明苯环开裂速率慢于—N==N—键,MO分子分解为小分子的苯衍生物。

图6 MO氧化分解过程的UV-vis谱图Fig.6 UV-vis images of MO degradation process.
分析MO反应前后的FTIR谱图,1 609,1 521 cm-1处吸收峰归属于苯环—C==C—键的伸缩振动;1 450~1 400 cm-1处的吸收峰归属于—N==N—的伸缩振动;1 369 cm-1处的吸收峰归属于芳基上—C—N—的伸缩振动;1 200 cm-1处的吸收峰归属于烷基上—C—N—键的伸缩振动;818 cm-1处的吸收峰归属为苯的1,4取代;1 121 cm-1处的吸收峰为—S==O的对称伸缩振动。而分解产物中上述各峰消失,证明—N==N—、—C—N—和—S==O键均断裂。氧化分解后1 609 cm-1和1 521 cm-1处留有一个小尖峰,表明苯环的氧化分解还不够彻底。1 449 cm-1处出现的强峰归属于CO32-;880 cm-1处出现铵盐的特征峰,说明降解形成了铵盐。综上所述,MO分子已被分解成铵盐等小分子化合物。
3 结论
1)用吸附法制备了ZnO负载铜锰双金属CMZ催化剂,在催化剂用量2 g/L,n(H2O2)∶n(MO)= 160∶1,n(NaHCO3)∶n(H2O2)= 1∶1,MO质量浓度20 mg/L,初始pH = 8.4,反应温度35 ℃的条件下,反应120 min后MO的氧化分解率达到81.17%,分解形成铵盐和苯衍生物。
2)CMZ催化剂的制备工艺简单,易与废水分离,水处理成本低,实际可操作性强,适合非均相催化H2O2/NaHCO3体系在碱性条件下氧化降解MO。
3)负载的金属离子催化H2O2/HCO3-体系氧化染料的过程十分复杂,其反应机理有待进一步深入探讨。
[1] Cheng Long,Wei Mingyu,Huang Lianghua,et al. Efficient H2O2oxidation of organic dyes catalyzed by simple copper(Ⅱ)ions in bicarbonate aqueous solution[J].Ind Eng Chem Res,2014,53(9):3478-3485.
[2] 徐爱华,邵科杰,吴文利,等. 碳酸氢钠溶液中微量Mn2+离子催化氧化降解有机污染物[J].催化学报,2010,31(8):1031-1038.
[3] Li Xiaoxia,Xiong Zhongduo,Ruan Xinchao,et al. Kinetics and mechanism of organic pollutants degradation with cobaltbicarbonate-hydrogen peroxide system:Investigation of the role of substrates[J].Appl Catal,2012,411/412(16):24-30.
[4] Sun Hong,Zhang Ze. Heterogeneous catalytic oxidation of methyl orange dye by copper(Ⅱ)-benzoic acid complex/ NaHCO3/H2O2system[J].J Chem Eng Jpn,2017,50(1):26-30.
[5] Bao Chao,Zhang He,Zhou Lincheng,et al. Preparation of copper doped magnetic porous carbon for removal of methylene blue by a heterogeneous Fenton-like reaction[J].RSC Adv,2015,5(88),72423-72432
[6] Lu Jia,Wang Huihu,Dong Yifan,et al. Plasmonic AgX nanoparticles-modified ZnO nanorod arrays and their visiblelight-driven photocatalytic activity[J].Chin J Catal,2014,35(7):1113-1125.
[7] Jawad A,Lu Xiaoyan,Chen Zhuqi,et al. Degradation of chlorophenols by supported Co-Mg-Al layered double hydrotalcite with bicarbonate activated hydrogen peroxide[J].J Phys Chem A,2014,118(43):10028-10035.
[8] 朱汉财,王红娟,彭峰,等. 纳米ZnO薄片的制备、表征及其光催化降解性能[J].石油化工,2006,35(9):886-890.
[9] 傅天华,高倩倩,刘斐,等. Fe-Ni 共掺杂ZnO的制备及其光催化降解甲基橙活性[J].催化学报,2010,31(7):797-802.
(编辑 邓晓音)
Heterogeneous degradation of methyl orange by supported metal catalyst
Sun Hong1,Zhang Ze2,Feng Ruyue1
(1. College of Chemistry and Chemical Engineering,Qiqihar University,Qiqihar Heilongjiang 161006,China;2. Qiqihar Environment Monitoring Center,Qiqihar Heilongjiang 161005,China)
With ZnO,Cu(NO3)2and MnSO4as raw materials,supported copper and manganese bimetallic(CMZ) catalyst was prepared and was applied to oxidize azo dyes methyl orange(MO) in H2O2/NaHCO3system. The composition of CMZ catalyst,the factors influencing oxidation and the oxidation decomposition principle of MO were characterized by XPS,AAS,and UV-vis. The results indicate that the optimum conditions for oxygenolysis MO were:catalyst dosage 2 g/L,n(H2O2)∶n(MO) 160∶1,n(NaHCO3)∶n(H2O2) 1∶1,MO mass concentration 20 mg/L,initial pH 8.4,and reaction temperature 35 ℃. Under the optimum conditions,81.17% of MO was removed after 120 min. CMZ catalyst was suitable for treatment of MO in alkali aqueous solution.
supported bimetallic catalyst;copper;manganese;hydrogen peroxide/sodium bicarbonate;methyl orange
1000-8144(2017)07-0879-05
TQ 426.82
A
10.3969/j.issn.1000-8144.2017.07.008
2016-11-29;[修改稿日期]2017-05-04。
孙宏(1964—),女,黑龙江省塔河县人,大学,教授,电话 13836262755,电邮 sun1964214@163.com。
黑龙江省教育厅项目(2012TD012)。
