超声波辅助提取虫草参多糖及其抗氧化能力研究
2017-08-13周康韩航王伟
周康 韩航 王伟


摘要[目的]研究虫草参多糖的提取工艺,并考察其抗氧化能力。[方法]采用超声波辅助提取虫草参多糖,在单因素试验的基础上进行正交试验,确定虫草参多糖的最佳提取工艺,并考察虫草参多糖的抗氧化能力。[结果]虫草参多糖的最佳提取工艺为超声功率500 W、提取时间40 min、液料比40∶1,在此条件下多糖提取率为60.94%;各影响因素主次顺序依次为超声功率、液料比、提取时间。所得虫草参多糖对羟基自由基、超氧阴离子自由基、DPPH·自由基均具有一定的清除能力。[结论]虫草参多糖具有一定的抗氧化作用,能延缓自由基对人体细胞的损伤。
关键词 虫草参;多糖;超声波辅助提取;工艺优化;抗氧化性
中图分类号 S567.2 文献标识码 A 文章编号 0517-6611(2017)03-0135-03
Abstract[Objective] To study the extraction process of polysaccharide from Cordyceps sinensis, and investigate its antioxidant capacity. [Method] Polysaccharides were extracted from C. sinensis assisted by ultrasonic, orthogonal experiment was carried out based on single factor test. The optimum extraction conditions were determined and antioxidant capacity of polysaccharide from C. sinensis were investigated. [Result] The yield of polysaccharide was 60.94% under the optimum conditions of ultrasonic power 500 W, extraction time 40 min, liquidsolid ratio 40∶1;The influencing factors were in order as ultrasonic power, liquidsolid ratio, extraction time. Hydroxyl radicals, superoxide anion radicals and DPPH·radicals can be scavenged by C. sinensis polysaccharide within a certain range.[Conclusion] Polysaccharide from C. sinensis has a certain antioxidant capacity, which can delay free radical damage to human cells.
Key words Cordyceps sinensis;Polysaccharide;Ultrasonic assisted extraction;Process optimization;Antioxidant
蟲草参又名地参,属唇形科多年生药食两用草本植物,是一种地下茎长5~6 cm的肉质环形参,广泛分布于西南等少数民族地区,喜温耐寒,素来享有“山中之王”的美誉[1-2]。中医认为其具有活血调经、祛瘀消痈、利水消肿等功效,在《中药大辞典》中就有提神醒脑、调血脂、补肾虚的功效记载[3]。虫草参中糖类及氨基酸等活性物质含量丰富,具有降血糖、降血脂、抗氧化、促消化等功效[1,4-7]。目前,虫草参多糖的提取方法主要是热水提取,能耗较高,而超声技术在中药活性成分提取分离中的应用将显著提高提取率,降低能耗。笔者采用超声波辅助提取虫草参多糖,在单因素试验的基础上进行正交试验,确定虫草参多糖的最佳提取工艺,并考察其抗氧化能力,以期为虫草参加工利用提供数据积累。
1 材料与方法
1.1 试材
虫草参(中国剑川县车记地参食品厂),烘干粉碎过60目筛备用。葡萄糖等试剂购自国药集团化学试剂有限公司,均为分析纯。
1.2 仪器
数显恒温水浴锅(HH-4型,常州国华电器有限公司);紫外可见分光光度计(UV-9600型,北京北分瑞利分析仪器有限责任公司);旋转蒸发仪(RE-52型,上海亚荣生化仪器);循环水式真空泵[SHZ-D(Ш)型,巩义市予华仪器有限责任公司];植物粉碎机(LG-500A型,瑞安百信药机械厂);低速自动平衡离心机(DT5-4B型,北京时代北利离心机有限公司)。
1.3 方法
1.3.1 葡萄糖标准曲线的绘制。
精确称取葡萄糖标品10 mg,溶解定容于100 mL容量瓶中,配制成0.1 mg/mL的葡萄糖标准溶液。分别取0、0.4、0.6、0.8、1.0、1.2、1.4 mL葡萄糖标准溶液,蒸馏水补齐至2.0 mL,加入1 mL 6%苯酚溶液及5 mL 98%硫酸,摇匀,30 ℃水浴20 min,于490 nm处测定吸光度。以吸光度为纵坐标、葡萄糖含量为横坐标绘制标准曲线。
1.3.2 虫草参多糖提取工艺。
称取一定量虫草参粉末,采用超声波辅助提取虫草参多糖,所得样品离心后,取上清液定容,依照苯酚硫酸法测定其多糖含量。分别考察超声功率、提取时间、液料比对虫草参多糖提取率的影响。并在单因素试验的基础上,采用L9(34)正交试验(表1),得出最佳工艺条件。
1.3.3 清除羟基自由基能力测定[8-12]。
取2支25 mL比色管,加入5 mL 2 mmol/L FeSO4、5 mL 6 mmol/L H2O2,混合均勻后用6 mmol/L水杨酸-乙醇溶液补齐至刻度,于510 nm处立即测定吸光度A0,再加入1 mL虫草参多糖溶液,摇匀后测定吸光度Ax,并按公式(1)计算羟基自由基清除率。
羟基自由基清除率=(A0-Ax)/A0×100%(1)
式中,Ax为虫草参多糖组吸光度,A0为空白组吸光度。
1.3.4 清除超氧阴离子自由基能力测定[8-12]。
取2支25 mL比色管,加入4.5 mL 0.05 mol/L pH为8.2的Tris-HCl溶液,于25 ℃水浴20 min后,加入0.5 mL 0.025 mol/L邻苯三酚溶液及1 mL虫草参多糖溶液,混匀后放置5 min,再加入1 mL 8 mol/L的HCl,摇匀后于320 nm处测定吸光度,并按公式(2)计算超氧阴离子自由基清除率。
超氧阴离子自由基清除率=(A0-Ax)/ A0×100%(2)
式中,Ax为虫草参多糖组吸光度,A0为空白组吸光度。
1.3.5 清除DPPH·自由基能力测定[8-12]。
取20 mg DPPH·用无水乙醇溶解并定容至500 mL,取1 mL虫草参多糖样品与1 mL DPPH·混合反应30 min后,于517 nm处测定吸光度Ax,并按照公式(3)计算DPPH·自由基清除率。
DPPH·自由基清除率=(Ax-A1)/A2×100%(3)
式中,Ax为虫草参多糖组与DPPH·反应的吸光度,A1为虫草参多糖组与溶剂的吸光度,A2为DPPH·与溶剂的吸光度。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
由图1可知,葡萄糖标准曲线的线性回归方程为y=6.020 6x+0.007 1(R2=0.999 1),表明葡萄糖含量在0~0.14 mg线性关系良好。
2.2 单因素试验
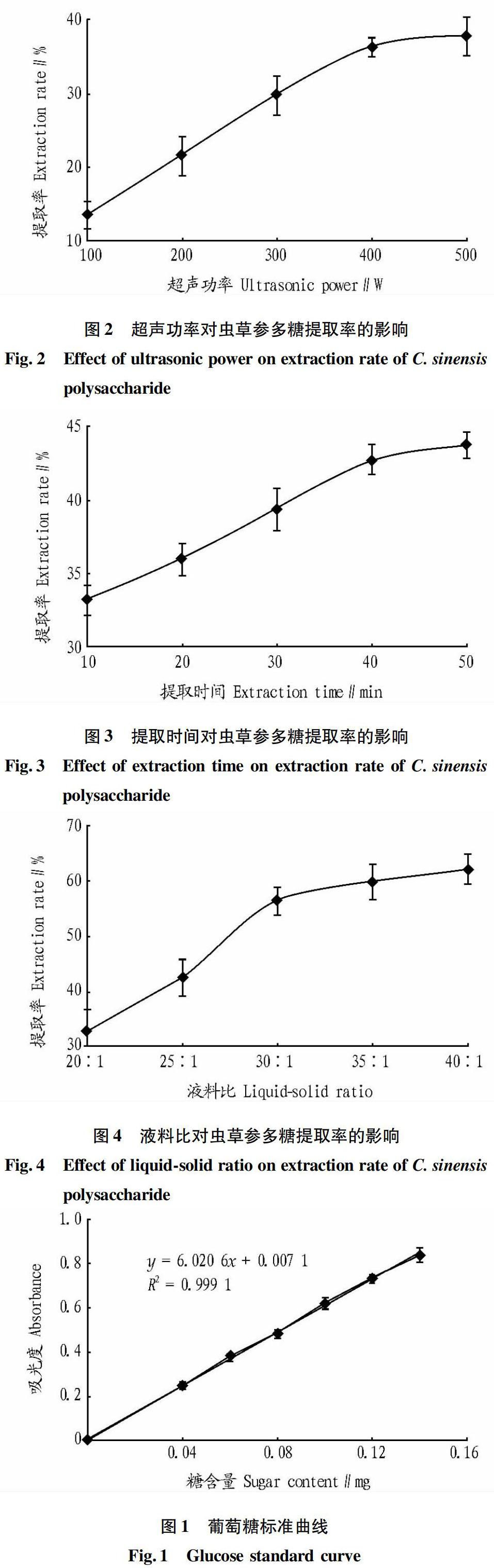
2.2.1 超声功率对虫草参多糖提取率的影响。
从图2可看出,随着超声功率的增大,虫草参多糖提取率不断提高,当超声功率达到400 W时,提取率为36.31%,随着超声功率继续增大,多糖溶出率上升趋势减缓。可能是因为在较低超声功率情况下,超声波能逐渐破坏细胞壁,致使内容物溶出,而随着超声功率的提高,在一定时间内虫草参细胞能被基本破壞,内容物已充分溶出,所以多糖溶出率上升趋势减缓,故选择超声功率为400 W为宜。
2.2.2 提取时间对虫草参多糖提取率的影响。
由图3可知,随着提取时间的延长,虫草参多糖提取率不断提高,当提取时间达到40 min时,提取率为42.59%,随着提取时间继续延长,多糖溶出率上升趋势减缓。可能是因为在较短的提取时间内,超声波快速破坏细胞壁,使细胞内容物释放,随着时间的延长,细胞壁已经被完全破坏,内容物已充分溶解,使得多糖溶出率升高趋势变缓,因此,超声提取时间确定为40 min。
2.2.3 液料比对虫草参多糖提取率的影响。
从图4可看出,随着液料比的增大,虫草参多糖提取率不断提高,当液料比达到30∶1时,提取率为56.24%,随着液料比继续增大,多糖溶出率上升趋势减缓。可能是因为在一定质量虫草参粉末情况下,随着溶剂用量的增加,增大了虫草参与溶剂接触面的浓度差,从而提高了多糖传质速率,随着溶剂用量继续增加,内容物已完全溶出,使得多糖溶出率升高趋势变缓,因此,液料比确定为30∶1。
2.3 正交试验
由表2可知,超声波辅助提取虫草参多糖最佳工艺为A3B2C3,即超声功率为500 W,提取时间为40 min,液料比为40∶1,在此条件下多糖提取率为62.65%,经此条件验证,虫草参多糖提取率为60.94%。通过极差分析可知,各影响因素主次顺序依次为超声功率、液料比、提取时间。
2.4 清除羟基自由基能力测定
由图5可知,随着虫草参多糖浓度的增加,其清除羟基自由基能力不断提高,当多糖浓度为40 μg/mL时,其清除率达80.33%,同等浓度下的维生素C溶液清除率为68.67%,虫草参多糖对羟基自由基清除能力明显优于维生素C溶液。
2.5 清除超氧阴离子自由基能力测定
从图6可看出,随着虫草参多糖浓度的增加,其清除超氧阴离子自由基能力不断提高,当多糖浓度为50 μg/mL时,清除率达52.33%,同等浓度下的维生素C溶液清除率为47.67%,虫草参多糖对超氧阴离子自由基清除能力明显优于维生素C溶液。
2.6 清除DPPH·自由基能力测定
由图7可知,随着虫草参多糖浓度的增加,其清除DPPH·自由基能力不断提高,当多糖濃度为50 μg/mL时,清除率达50.33%,同等浓度下的维生素C溶液清除率为44.67%,虫草参多糖对DPPH·自由基清除能力明显优于维生素C溶液。
3 小结
围绕虫草参多糖提取工艺进行研究,并考察其抗氧化能力,在单因素试验的基础上进行正交试验,得出虫草参多糖最佳提取工艺为A3B2C3,即超声功率500 W、提取时间40 min、液料比40∶1,在此条件下多糖提取率为62.65%,经此条件验证,虫草参多糖提取率为60.94%;各影响因素主次顺序依次为超声功率、液料比、提取时间。所得虫草参多糖对羟基自由基、超氧阴离子自由基和DPPH·自由基均有一定的清除作用,在一定的范围内,多糖浓度越高,抗氧化效果越好,且虫草参多糖对羟基自由基、超氧阴离子自由基和DPPH·自由基清除能力明显优于维生素C溶液。由此可知,虫草参多糖具有一定的抗氧化作用,能延缓自由基对人体细胞的损伤。
参考文献
[1] 罗孟禹,董开居.浅析名特珍稀野菜“地参”种植与开发[J].中国野生植物资源,2006,25(5):64-65.
[2] 胡旗辉.药食两用虫草参栽培技术[J].农村新技术,2006(11):9.
[3] 许泳吉,钟惠民,杨波,等.野生植物地参中营养成分的测定[J].光谱实验室,2003,20(4):528-529.
[4] 张赛男.虫草参多糖提取工艺研究[J].北京农业,2015(12):15-16.
[5] 林春榕,左绍远,熊伟,等.地参多糖对D-半乳糖所致衰老小鼠的抗氧化作用研究[J].安徽农业科学,2012,40(18):9646-9647.
[6] 熊伟,陈贵元,谭德勇,等.野生地参多糖对四氧嘧啶致糖尿病小鼠血糖和血脂的影响[J].生物加工过程,2011,9(6):45-48.
[7] LAWRENCE J M,REID J,TAYLOR G J,et al.The effect of high dose atorvastatin therapy on lipids and lipoprotein subfraction in overweight patients with type 2 diabetes [J].Atherosclerosis,2004,174(1):141-149.
[8] 张赛男.虫草参多糖抗氧化性研究[J].辽宁农业职业技术学院学报,2015,17(3):9-10.
[9] 李平,王艳辉,马润宇.山茱萸多糖PFCAIII抗氧化性能研究[J].北京化工大学学报,2003,30(3):35-38.
[10] 秦慧民,朱思明,于淑娟.橙皮苷及铜配合物的抑菌抗氧化活性研究[J].食品科技,2006,31(6):81-83.
[11] YEN G C,DUH P D,TSAI C L.Relationship between antioxidant activity and maturity of peanut hulls [J].J Agric Food Chem,1993,41(1):67-70.
[12] BERKER K I,GL K,TOR I,et al.Total antioxidant capacity assay using optimized Ferricyanide/Prussian Blue method [J].Food analutical methods,2012,3(3):154-168.
