微量金属元素对中低温厌氧消化工艺的影响
2017-08-13王粟史风梅裴占江
王粟 史风梅 裴占江

摘要[目的]探究微量金属元素对中低温厌氧消化工艺的影响。[方法]通过向序批式反应体系内投放微量金属元素(Fe、Co、Ni),研究不同温度条件下,厌氧消化效率的差异。[结果]35 ℃条件下,厌氧发酵对底物消耗更为迅速,产气效率更高,而20 ℃条件下,则更有利于刺激嗜冷产甲烷菌群的活性,各处理的pH多维持在6.5~7.0,更适宜厌氧发酵反应的进行。其产生的沼气,甲烷含量也相对更高,其中WP20处理平均甲烷含量可达52%。而投放微量金属元素,对不同菌种的刺激效果存在一定差异,在20 ℃条件下,微量元素对W菌种厌氧发酵产气效率影响最为显著;35 ℃条件下,微量元素对G1菌种影响较为明显,G1P35累计产气量达7 129 mL。[结论]该研究可为深入探讨低温条件下沼气生物强化菌群的微生物特性、环境因子互作、菌群时空分布和种群动力学提供技术支撑。
关键词 厌氧消化;金属元素;中低温
中图分类号 S210.3 文献标识码 A 文章编号 0517-6611(2017)03-0049-03
Abstract[Objective] To explore effects of trace metal elements on middle and low temperature anaerobic digestion process.[Method] Effects of trace elements (Fe,Co,Ni) on anaerobic digestion system were investigated through batch experiments at 20 ℃ and 35 ℃.[Result] The results showed that the consuming velocity of substrate was faster by anaerobic digestion and the aerogenesis rate was higher at 35 ℃,while,the activity of psychrophilic methanogens was higher at 20 ℃.The pH of all treatment groups maintained from 6.5 to 7.0 which benefited the reactions of anaerobic fermentation.Especially,methane content was higher in biogas produced at 20 ℃ and relative average methane content in WP20 group reached to 52%.Meanwhile,the effects of adding trace metal elements on different strains of bacteria were also different.The effect was most significant in W group at 20 ℃,but in G1 group at 35 ℃,and the cumulative biogas yield of G1P35 group was up to 7 129 mL.[Conclusion] The study can provide the technical support for the further study on the microbial characteristics,environmental factors interaction,the temporal and spatial distribution of bacteria and the population dynamics in the low temperature condition.
Key words Anaerobic digestion;Metal element;Middle and low temperature
沼氣生產是一个由多种微生物联合,具有交替作用的复杂生化过程,受多种环境因素影响[1],在现有技术和装备条件下,寒区沼气生产的经济效益相对低下。目前仍缺乏能够满足这种需求的理论依据和实用技术。生物强化发酵技术是指在生物处理系统中,通过投加非生物外源添加剂或具有特定功能微生物来恢复反应器功能或增强反应器的处理效率的方法[2-3]。目前,生物强化技术在废水处理耗氧消化、提高絮凝效果、降解特殊底物,尤其是在土壤和地下水生物修复中广为应用[4-5]。吕淑霞等[6]研究表明,发酵物(以TS计)添加3 g/kg固体纤维素酶,甲烷产率可提高52.10%;而添加一定的微量元素(如铬、铜、镍、锌等)能够提高沼气发酵微生物尤其是产甲烷菌群的生物活性。Geets等[7]研究表明,2.5 mg/L Ni能够增加54.00%的产气量。Singer等[8]研究发现,奶牛粪便中添加Cu,在48 d滞留时间内产气率比对照提高22.22%。李亚新等[9]分别以醋酸钙和乙醇为基质,研究得出激活甲烷菌的最佳微量元素组合为Fe、Co、Ni,与对照相比,产气量增加43.40%,甲烷含量提高了5.10%,COD去除率提高了10.20%。
沼气发酵过程对温度敏感,不仅影响产甲烷速率,还影响甲烷生成途径[10-11]。低温生境中甲烷主要通过乙酸为底物来合成,其在该途径的贡献率可达88.00%,而中温条件下仅有33.00%的甲烷是由乙酸型产甲烷菌产生[12],这也暗示着低温下甲烷的合成途径、生物强化工艺及效果不同于中温生境。而前人研究也多集中于常温条件下生物强化产甲烷过程,对于低温条件下产甲烷过程研究较少。笔者通过向反应体系内投放微量金属元素,研究在不同温度条件下沼气发酵菌群强化厌氧消化效率的差异,以期为指导寒区沼气生产实践提供科学依据。
1 材料与方法
1.1 试验材料
厌氧发酵以牛粪为底物,采集于黑龙江省农业科学院畜牧研究所奶牛养殖场,烘干后用植物粉碎机(FZl02)将样品粉碎,放入20 L塑料袋中,用纯氮气置换内部空气后,于4 ℃储存于干燥器内备用。
接种污泥取自全省不同生态区的典型生境[五大连池(W)、肇东(Z)、林甸(L)、依安(Y)、甘南(G1)、密山(M)],通过富集培养,筛选出具有较高活性的低温产甲烷菌群。试验前将接种污泥置于35 ℃、2 Hz摇床培养箱中培养24 h,以减少内生甲烷气体对结果的影响。具体理化性状见表1。
1.2 装置与方法
采用序批式厌氧发酵方法,随机选取接种菌群,分别将W、Z、L 3组处理置于(20±1) ℃温度下培养,记为W20、Z20、L20;将G1、Y、M置于(35±1) ℃温度下培养,记为G135、Y35、M35。每组设3次重复。此外,另设6组处理,分别向上述各菌种厌氧发酵体系内一次性加入微量金属元素Fe3+、Co2+、Ni2+,记为WP20、ZP20、LP20、G1P35、YP35、MP35。微量金属元素投入量为Fe3+ 1.00 mg/L、Co2+0.10 mg/L、Ni2+0.25 mg/L。
试验装置采用自制1 L广口瓶为反应器,反应体系600 mL,总固体含量(TS)为6%,接种时厌氧瓶内充入氮气流500 mL/min,保持6 min以上,保证反应体系处于严格的厌氧环境。
试验周期为60 d,沼气产量采用排饱和食盐水法测定;甲烷含量采用气相色谱仪(安捷伦7890A)分析测定,载气为高纯氮气和氢气,柱箱温度50 ℃,前进样口温度125 ℃,检测器温度设为150 ℃,样品停留时间8.5 min;pH 采用pH计法测定。
2 结果与分析
2.1 产气量变化
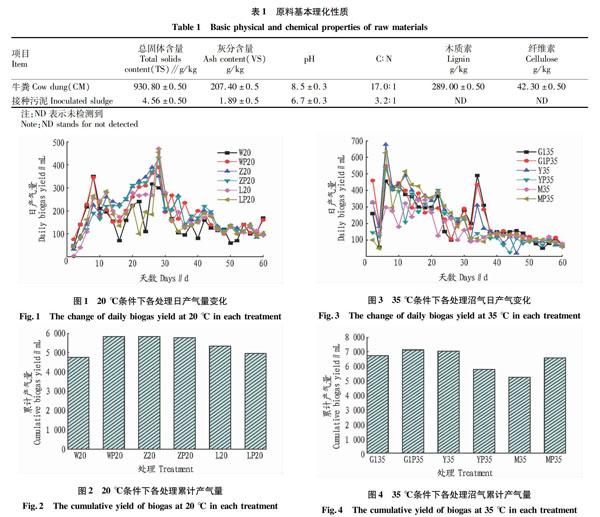
从图1可以看出,20 ℃培养条件下,各处理在发酵初期(1~8 d)产气量迅速上升,第9天产气量逐渐减少,随着发酵进行,第25天,各处理逐步进入产气高峰,L20处理的产气量最高,达470 mL。发酵第30天,各处理产气量迅速下降,并逐步趋于稳定。
从图2可以看出,各处理累计产气量从大到小依次为WP20、Z20、ZP20、L20、LP20、W20,可见,微量元素的投放对菌种Z和L菌种厌氧发酵产气效率影响不大,而WP20和W20累计产气量分别达到5 840和4 758 mL,说明微量金属元素的投放对提高W菌群厌氧产气效率具有显著效果。
从图3可以看出,由于温度的升高,发酵前3 d便有大量气体产生,并在第4天产气量迅速下降,这可能是由于有机酸短期内得到大量积累,产气效率受到了抑制。但随着产甲烷优势菌群活性的不断增强,产气量又再次升高,并在第6天进入产气高峰期,其中Y35处理的日最高产气量达677 mL。随着厌氧发酵的进行,各处理日产气量逐步呈下降趋势,并在第38天開始,日产气量维持在150 mL以下。从图4可以看出,35 ℃条件下,添加微量金属元素,使菌群M和G1的产气效率显著提高, 其中,G1P35处理累计产气量最高达7 129 mL。
2.2 pH及甲烷含量变化
从图5可以看出,各处理pH 在试验过程中基本稳定,pH 在厌氧发酵初期呈现一定下降后,于第9天开始增加,并逐步趋于稳定,说明反应体系甲烷菌群活性较高,大部分小分子酸得到及时分解利用。pH进入稳定期后,20 ℃条件下各处理pH均保持在6.5~7.0,而35 ℃各处理pH多维持在7.0左右(图6),说明20 ℃条件下各处理的pH最适宜厌氧发酵反应的进行,有利于提高产沼气的质量。
从图7、8可以看出,各处理在厌氧发酵前9 d,甲烷含量迅速增加,随后逐步趋于稳定,其中20 ℃條件下各处理甲烷含量均维持在51%左右,明显高于35 ℃下各处理49%左右的甲烷含量。WP20处理平均甲烷含量最高,达到52%,其他各处理平均甲烷含量从大到小依次为LP20、L20、W20、Z20、Y35、YP35、ZP35、G1P35、M35、G135、MP35,说明20 ℃条件下各处理反应体系中的产甲烷菌群活性更高。
20 ℃下各处理日产气量低于35 ℃下各处理,而甲烷含量却明显高于35 ℃下各处理,未出现产气量越高甲烷含量也越高的普遍现象。这可能是由于接种菌群均来自全省各典型低温生境,厌氧发酵过程中,在相对低温环境下,更有利于刺激嗜冷产甲烷菌群的活性,从而提高了沼气中的甲烷含量。
3 结论
(1)通过对不同菌种在不同温度条件下对厌氧发酵产气效率的影响可知,35 ℃条件下,厌氧发酵对底物消耗更为迅速,产气效率更高。
(2)20 ℃条件下,有利于刺激嗜冷产甲烷菌群的活性,各处理pH多维持在6.5~7.0,更适宜厌氧发酵反应的进行。其产生的沼气,甲烷含量也相对更高,其中WP20处理平均甲烷含量可达52%。
(3)投放微量金属元素,对不同菌种的刺激效果存在一定差异,在20 ℃条件下,微量元素对W菌种厌氧发酵产气效率影响差异最为显著;而在35 ℃条件下,微量元素对G1菌种影响较为明显,G1P35累计产气量达7 129 mL。
参考文献
[1] METJE M,FRENZEL P.Methanogenesis and methanogenic pathways in a peat from subarctic permafrost[J].Environ Microbiol,2007,9(4):954-964.
[2] HORN M A,MATTHIES C,KSEL K,et al.Hydrogenotrophic methanogenesis by moderately acid-tolerant methanogens of a methane-emitting acidic peat[J].Appl Environ Microbiol,2003,69(1):74-83.
[3] CONNAUGHTON S,COLLINS G,O′FLAHERTY V.Psychrophilic and mesophilic anaerobic digestion of brewery effluent:A comparative study[J].Water Res,2006,40(15):2503-2510.
[4] VAN LIMBERGEN H,TOP F M,VERSTRAETE W.Bioaugmentation in activated sludge:Current features and future perspectives[J].Applied microbiology and biotechnology,1998,50(1):16-23.
[5] KNIGHT B,ZHAO F J,MCGRATH S P,et al.Zinc and cadmium uptake by the hyperaccumulator Thlaspi caerulescens in contaminated soils and its effects on the concentration and chemical speciation of metals in soil solution[J].Plant and soil,1997,197(1):71-78.
[6]吕淑霞,陈祖洁.纤维素酶应用于酒精糟废水厌氧消化中的研究[J].中国沼气,1994(1):1-5.
[7] GEETS G S,JAGADEESH K S,REDDY T K.Nic Heasall accelerator of biogas productionin water hyacineh,Eiehor nia erassipes Solns[J].Biomass,1990,21:157-161.
[8] SINGER A C,VAN DER GAST C J,THOMPSON I P.Perspectives and vision for strain selection in bioaugmentation[J].Trends in biotechnology,2005,23(2):74-77.
[9]李亞新,楊建刚.微量金属元素对甲烷菌激活作用的动力学研究[J].中国沼气 ,2000,18(2):8-11.
[10] KOTSYURBENKO O R,FRIEDRICH M W,SIMANKOVA M V,et al.Shift from acetoclastic to H2-dependent methanogenesis in a West Siberian peat bog at low pH values and isolation of an acidophilic Methanobacterium strain[J].Appl Environ Microbiolj,2007,73(7):2344-2348.
[11] DHAKED R K,SINGH P,SINGH L.Biomethanation under psychrophilic conditions[J].Waste Manag,2010,30(12):2490-2496.
[12] CONRAD R.Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments[J].FEMS Microbiol Ecol,1999,28(3):193-202.
