丁本酞对老年急性脑梗死病人血清Ang-Ⅰ、内皮素1、VEGF水平的影响
2017-08-11张军亚
张军亚
丁本酞对老年急性脑梗死病人血清Ang-Ⅰ、内皮素1、VEGF水平的影响
张军亚
目的 探讨丁本酞对老年急性脑梗死病人血清血管生成素Ⅰ(Ang-Ⅰ)、内皮素1(ET-1)、血管内皮生长因子(VEGF)水平表达及临床疗效的影响。方法 选择2014年7月—2016年7月于我院就诊的老年急性脑梗死病人104例,对照组采用常规治疗,试验组于常规治疗基础上加以丁苯酞治疗,比较两组实验室指标、日常生活能力及神经功能评分、临床疗效、安全性。结果 治疗后,试验组Ang-Ⅰ、ET-1低于对照组;试验组VEGF高于对照组,差异有统计学意义(P<0.05);试验组神经功能、炎症因子、氧化应激指标均优于对照组(P<0.05)。试验组日常生活能力及神经功能评分均优于对照组(P<0.05);试验组有效率高于对照组,差异有统计学意义(P<0.05)。结论 老年急性脑梗死病人应用丁本酞治疗疗效比较确切,能有效调节相关血清因子分泌,促进病情恢复。
急性脑梗死;老年;丁苯酞;血管生成素Ⅰ;内皮素1;血管内皮生长因子
急性脑梗死是老年人群的常见疾病,主要由于脑组织局部血液循环骤然出现障碍,产生缺血、缺氧的软化性坏死,从而出现一系列临床表现,致残率极高,且容易复发[1]。临床报道发现,急性脑梗死发生期间损伤脑组织可产生多种病理生理改变,多种血清细胞因子参与其中,从而起到生物学作用[2]。丁苯酞作为抗脑缺血的一种药物,药理研究表明其对脑血流灌注有显著改善作用,促进神经功能修复[3]。丁苯酞对急性脑梗死病人的相关血清指标影响是目前研究热点,本研究旨在回顾性分析丁本酞对老年急性脑梗死病人血清指标水平表达及疗效的影响。
1 资料与方法
1.1 一般资料 选择2014年7月—2016年7月于我院就诊的老年急性脑梗死病人104例,病人均符合《各类脑血管病疾病诊断要点》急性脑梗死的相关诊断标准[4]:发病突然、于发病数小时或1 h~2 h内病情达到高峰,可出现偏瘫、吞咽困难等系列临床症状。纳入标准:经头颅CT、MRI等检查明确诊断;首次发病;内科治疗指征明确;发病至入院时间6 h~12 h;年龄60岁~75岁。排除标准:心、肝、肾等主要器官严重病变;自身免疫系统及血液系统异常;脑出血或伴颅脑外伤;伴精神疾病;心源性休克。
对照组52例,男28例,女24例;年龄60岁~75岁(67.41岁±1.35岁);发病至入院时间6 h~12 h(7.64 h±0.32 h);梗死部位:基底节区18例,脑桥14例,颞叶12例,小脑8例。试验组52例,男23例,女29例;年龄60岁~75岁(68.93岁±1.15岁);发病至入院时间6 h~12 h(8.42 h±0.24 h);梗死部位:基底节区20例,脑桥16例,颞叶10例,小脑6例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法 对照组采用抗血小板、活血化瘀、维持电解质平衡、神经保护、降颅内压等常规治疗;试验组在常规治疗基础上加以丁苯酞治疗,口服0.2 g丁苯酞(广西康迪药业有限公司,每片0.1 g,20140621),每日3次。均连续治疗14 d。于用药前后观察各临床指标,评估病人临床疗效及不良反应。
1.3 指标观察 抽取病人入院及治疗后空腹外周静脉血4 mL,分离血清后将上清液保留,置于-80 ℃环境中待检。血管生成素Ⅰ(Ang-Ⅰ)采用酶联免疫吸附法测定,内皮素1(ET-1)采用酶联免疫双抗体夹心法测定,血管内皮生长因子(VEGF)采用放射比浊法测定;神经元特异烯醇化酶(NSE)、S100β采用放射免疫法测定;C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)采用电化学发光法测定;丙二醛(MDA)、超氧化物歧化酶(SOD)采用免疫比色法测定。
日常生活能力:使用BI生活指数评估[5],100分表示完全正常,生活独立能力分界点为60分,60分表示存在一定功能障碍、但可独立;60分~41分表示日常生活需要他人帮助;低于20分表示严重的功能缺陷。神经功能缺损评分(NIHSS)按照意识水平、凝视、视野、上肢运动、下肢运动、面瘫、感觉等方面评估,分数越高表示神经功能损伤越严重。评估临床疗效:NIHSS减少90%以上,临床体征与症状消失,日常生活能力得到恢复为基本痊愈;NIHSS减少46%~90%,临床体征与症状基本缓解,日常生活能力得到提高为显效;NIHSS减少18%~45%,临床体征与症状、日常生活能力均有缓解为好转;NIHSS波动在18%以下为无效[6]。

2 结 果
2.1 两组老年急性脑梗死病人血清Ang-Ⅰ、ET-1、VEGF水平比较 治疗前,两组血清Ang-Ⅰ、ET-1、VEGF水平比较,差异无统计学意义(P>0.05)。治疗后,两组血清Ang-Ⅰ、ET-1水平均降低,试验组低于对照组,差异有统计学意义(P<0.05);两组VEGF均上升,试验组高于对照组,差异有统计学意义(P<0.05)。详见表1。

组别n AngⅠ(μg/L) 治疗前治疗后t值P ET1(ng/L) 治疗前治疗后t值P VEGF(ng/L) 治疗前治疗后t值P对照组5227.12±5.2016.40±3.8911.9030.00072.11±10.6067.91±9.302.1470.034386.40±60.51421.85±62.702.9330.004试验组5228.43±5.4214.59±3.2515.7920.00073.89±11.6860.11±8.316.9320.000384.41±62.30471.63±65.216.9730.000t值-1.2572.574-0.8134.5090.165-3.968P0.2110.0110.4170.0000.8690.000
2.2 两组老年急性脑梗死病人血清NSE、S100β比较 治疗前,两组血清NSE、S100β比较,差异无统计学意义(P>0.05);治疗后,两组血清NSE、S100β均降低,试验组低于对照组,差异有统计学意义(P<0.05)。详见表2。
表2 两组老年急性脑梗死病人血清NSE、S100β比较(±s) μg/L
2.3 两组老年急性脑梗死病人CRP、TNF-α比较 治疗前,比较两组CRP、TNF-α差异无统计学意义(P>0.05);治疗后,两组CRP、TNF-α均降低,试验组低于对照组,差异有统计学意义(P<0.05)。详见表3。
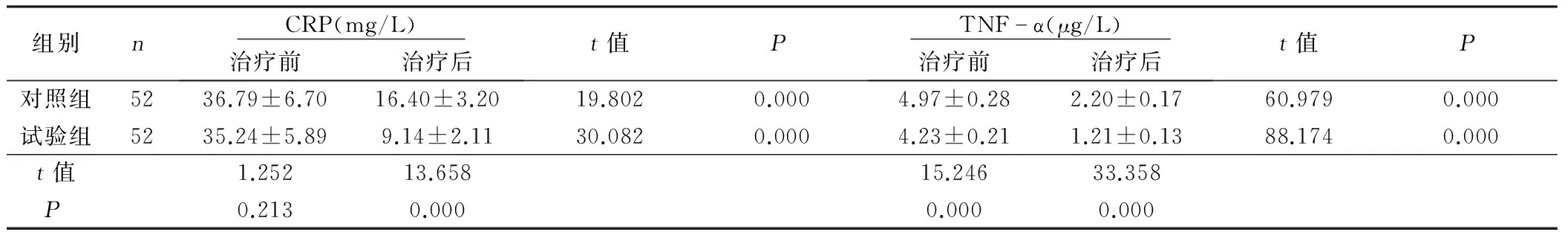
组别n CRP(mg/L) 治疗前治疗后t值P TNFα(μg/L) 治疗前治疗后t值P对照组5236.79±6.7016.40±3.2019.8020.0004.97±0.282.20±0.1760.9790.000试验组5235.24±5.899.14±2.1130.0820.0004.23±0.211.21±0.1388.1740.000t值1.25213.65815.24633.358P0.2130.0000.0000.000
2.4 两组老年急性脑梗死病人MDA、SOD比较 治疗前,比较两组MDA、SOD差异无统计学意义(P>0.05);治疗后,两组MDA均降低,试验组低于对照组,差异有统计学意义(P<0.05),两组SOD均升高,试验组高于对照组,差异有统计学意义(P<0.05)。详见表4。
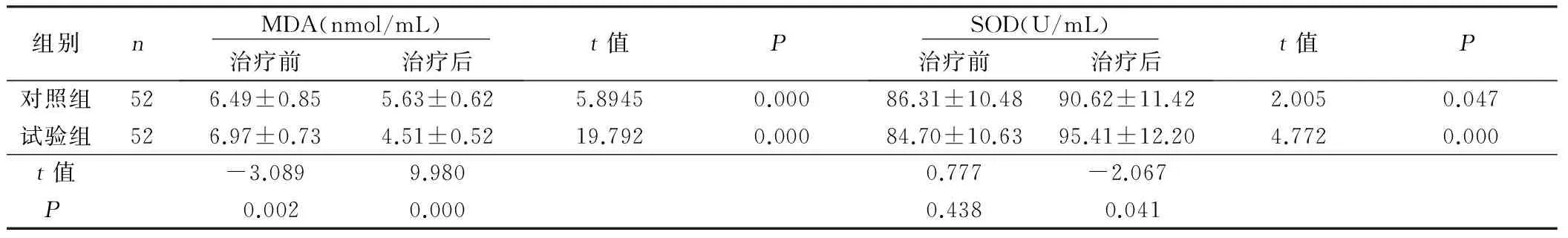
组别n MDA(nmol/mL) 治疗前治疗后t值P SOD(U/mL) 治疗前治疗后t值P对照组526.49±0.855.63±0.625.89450.00086.31±10.4890.62±11.422.0050.047试验组526.97±0.734.51±0.5219.7920.00084.70±10.6395.41±12.204.7720.000t值-3.0899.9800.777-2.067P0.0020.0000.4380.041
2.5 两组老年急性脑梗死病人日常生活能力及神经功能评分比较 治疗前,比较两组日常生活能力及神经功能评分差异无统计学意义(P>0.05);治疗后,两组日常生活能力及神经功能评分均改善,试验组更明显,差异有统计学意义(P<0.05)。详见表5。
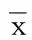
表5 两组老年急性脑梗死病人日常生活能力及神经功能评分比较(±s) 分
2.6 两组老年急性脑梗死病人临床疗效比较 试验组有效率高于对照组,差异有统计学意义(P<0.05)。详见表6。
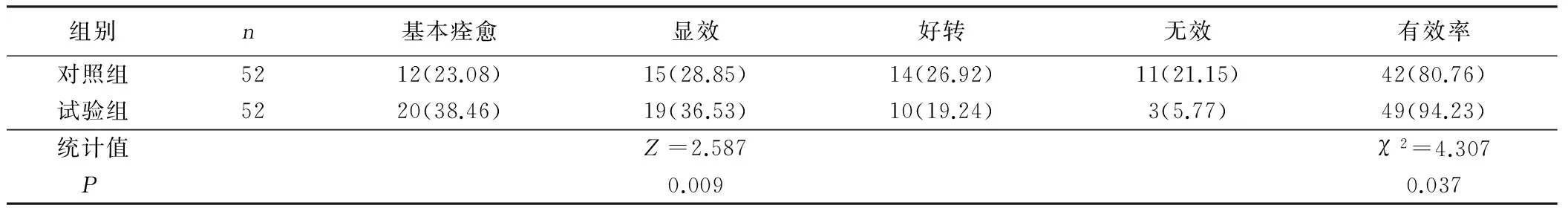
表6 两组老年急性脑梗死病人临床疗效比较 例(%)
2.7 安全性比较 用药期间,两组均未见严重不良反应,差异无统计学意义(P>0.05)。
3 讨 论
老年病人机体多伴不同程度的退行性变化,当突发脑梗死时可增加血管因子反应,Ang-Ⅰ作为间质血管新生的主要蛋白,参与血管内皮细胞完善,促进血管形成分支、重构,但其脆性比较高,影响组织损伤的修复[7]。ET-1是一种活性多肽,可使血管收缩,对血管平滑肌细胞增殖有促进作用,导致内皮细胞受损,有利于机体形成动脉粥样硬化[8]。VEGF作为血管再生的主要因子,和内皮细胞的特定受体结合,有利于血管内皮细胞的增殖及黏附等,促进血管生长,并建立侧支循环,还可增加血管的通透性,确保血管的正常功能[9]。急性脑梗死治疗目的是尽快缓解脑组织血液循环,并使血管生理状态尽可能恢复[10]。
丁本酞能促进微循环重构,且对线粒体有保护作用,可保持血管的完整结构,促进血管管径的恢复,增加脑部缺血组织的血流[11]。本结果显示,丁苯酞治疗后Ang-Ⅰ、ET-1低于常规治疗者,且VEGF明显上升,表明丁苯酞对血管新生具有促进作用,能下调Ang-Ⅰ及ET-1表达,减轻组织损伤,同时增加VEGF表达,有利于脑部缺血组织血供改善[12]。
急性脑梗死由于局部脑组织血供不足,导致神经功能损伤,NSE主要分布于中枢神经系统的神经内分泌细胞及神经元,脑组织受损时其可经破坏的血脑屏障进入血液,其血清浓度能直观反映机体神经元的损伤情况[13]。S100β作为神经系统的一种特异性蛋白,生理剂量对神经生长因子发育有促进作用,浓度过高可产生神经毒性,是早期神经损伤的可靠指标[14]。本研究结果显示,丁苯酞治疗后NSE及S100β浓度显著降低,考虑与其可有效改善脑部缺血组织血流,保持能量代谢,从而减少神经细胞凋亡,促进其修复。
临床研究发现,脑梗死发病期间有炎症因子参与,CRP能增加动脉粥样硬化斑块的不稳定性,促进其破裂,引起局部血栓,进一步诱导病变血管的狭窄与闭塞[15]。TNF-α是炎症反应中的主要促炎性因子,其水平降低时可使脑梗死病灶相应缩小[16]。本结果显示,丁本酞治疗后CRP、TNF-α显著低于常规治疗者,表明其可使局部炎症反应产生抑制,减轻脑部组织的损伤。
相关研究表示,急性脑梗死后缺血脑组织再灌注促进大量自由基释放,导致脑部组织出现脂质过氧化损伤,造成微循环出现障碍,并使脑细胞结构破坏[17]。本结果显示,丁苯酞治疗后MDA显著降低,且SOD明显上升,表明丁苯酞能使SOD活性明显提高,从而使脂质过氧化物生成减少,导致机体抗氧化能力增加[18]。本研究结果显示,丁苯酞治疗后病人NIHSS、BI评分均有效改善,且有效率较高,表明其可促进病人神经功能改善,提高病人日常生活能力,促进恢复。两组病人用药期间均无严重不良反应,安全性比较可靠。
综上所述,老年急性脑梗死病人应用丁本酞治疗临床疗效确切,能有效调节相关血清因子的分泌,促进病人的恢复。
[1] Romi F,Naess H.Spinal cord infarction in clinical neurology:a review of characteristics and long-term prognosis in comparison to cerebral infarction[J].Eur Neurol,2016,76(3-4):95-98.
[2] 李武,谢小兵.急性脑梗死患者相关生化指标检测的临床意义[J].现代生物医学进展,2011,11(2):283-286.
[3] 吴娟,陈永.丁本酞对急性脑梗死患者临床疗效及血液流变学的影响[J].重庆医学,2012,41(33):3488-3489.
[4] 王新德.各类脑血管病疾病诊断要点[J].中华神经精神科杂志,1996,29(6):379-381.
[5] 李奎成,唐丹,刘晓艳,等.国内Barthel指数和改良Barthel指数应用的回顾性研究[J].中国康复医学杂志,2009,24(8):737-740.
[6] 全国第四届脑血管病学术会议.脑卒中患者临床神经功能损伤程度评分标准(1995)及临床疗效评定标准[J].中华神经科杂志,1996,29(6):381-383.
[7] 刘媛媛,潘莉,郭晋,等.急性脑梗死患者血清VEGF及Ang-1水平的动态变化及其意义[J].蚌埠医学院学报,2012,37(10):1178-1180.
[8] 段新旺,黄亮,李辉华.急性脑梗死患者血糖、肌酐、尿素氮及血清ET-1水平的研究[J].中华急诊医学杂志,2011,20(10):1089-1091.
[9] 史福平,王惠凌,邸卫英,等.急性脑梗死患者MMP-9和VEGF的动态变化及其意义[J].临床医学,2014,34(1):3-5.
[10] 陈海恋,何超明,庞明武,等.丁本酞治疗老年急性脑梗死的疗效及对细胞因子和神经功能的影响[J].中华老年心脑血管病杂志,2016,18(11):1173-1177.
[11] 刘凌云,汤永红.丁本酞对急性脑梗死患者疗效及VEGF、BDNF、bFGF水平的影响[J].国际神经病学神经外科学杂志,2014,41(5):419-422.
[12] Tokuda K,Shindo S,Yamada K,et al.Acute embolic cerebral in farction and coronary artery embolism in a patient with atrial fibrillation caused by similar thrombi[J].J Stroke Cerebrovasc Dis,2016,25(7):1797-1799.
[13] 朱慧.ACI患者S100b、NSE、D-D和Hcy联检的意义[J].放射免疫学杂志,2013,26(2):229-230.
[14] 汤菲,安黎云,贾志然.动态观察急性脑梗死患者血清S100B蛋白的表达与神经功能缺损程度的关系[J].检验医学与临床,2014,11(16):2216-2217.
[15] Nguyen TV,Frye JB,Zbesko JC,et al.Erratum to:multiplex immunoassay characterization and species comparison of inflammation in acute and non-acute ischemic infarcts in human and mouse brain tissue[J].Acta Neuropathol Commun,2016,26;4(1):104.
[16] 张作念,王志晔,顾伟,等.急性脑梗死患者血清炎症因子与颈动脉粥样硬化斑块性质关系的临床研究[J].重庆医学,2016,45(10):1375-1377.
[17] Hacioglu G,Senturk A,Ince I,et al.Assessment of oxidative stress parameters of brain-derived neurotrophic factor heterozygous mice in acute stress model[J].Iran J Basic Med Sci,2016,19(4):388-393.
[18] 郭自清,周颖,舒孔亮,等.丁本酞软胶囊对急性脑梗死患者氧化损伤及抗氧化能力的影响[J].国际神经病学神经外科学杂志,2014,41(1):27-29.
(本文编辑薛妮)
河南省许昌市人民医院(河南许昌 461000),E-mail:liuwenshuai269@163.com
信息:张军亚.丁本酞对老年急性脑梗死病人血清Ang-Ⅰ、内皮素1、VEGF水平的影响[J].中西医结合心脑血管病杂志,2017,15(14):1781-1784.
R743 R255.2
B
10.3969/j.issn.1672-1349.2017.14.033
1672-1349(2017)14-1781-04
2017-02-21)
