正常颈髓磁共振扩散张量成像的定量分析
2017-08-11南京医科大学附属南京医院医学影像科江苏南京210006
1.南京医科大学附属南京医院医学影像科 (江苏 南京 210006)
2.江苏省第二中医院医学影像科(江苏 南京 210017)
倪 丰1单 华2殷信道1
正常颈髓磁共振扩散张量成像的定量分析
1.南京医科大学附属南京医院医学影像科 (江苏 南京 210006)
2.江苏省第二中医院医学影像科(江苏 南京 210017)
倪 丰1单 华2殷信道1
目的 通过对正常颈髓磁共振张量成像(DTI)的研究,探讨磁共振张量成像的临床应用价值。方法 对30例正常志愿者行颈椎磁共振常规序列(MRI)及磁共振张量成像(DTI)检查,测量并比较所有椎间盘层面颈髓的各向异性(FA)值及表观扩散系数(ADC)值,同时重建并分析磁共振弥散张量纤维束成像(DTT)。结果 所有受检者的颈髓DTI均得到FA图及ADC图;不同节段颈髓FA值及ADC值有统计学差异(P<0.05)。C2/3椎间盘水平颈髓的FA值最高、ADC值最低,C6/7椎间盘水平颈髓FA值最低、ADC值最高;FA值与ADC值之间呈负相关。结论 DTI能客观、定量地分析颈髓情况,有重要的临床应用价值。
颈髓;磁共振成像;扩散张量成像
磁共振扩散张量成像(Diffusion Tensor Imaging, DTI)由Basser等人在1994年首次提出[1-2],是在磁共振弥散加权成像(diffusion weighted imaging,DWI)基础上发展起来的一种新的成像方法。DTI利用组织中水分子扩散运动存在各相异性的原理,对水分子在组织中扩散进行量化,探测组织微观结构及病理生理改变。近年来,由于MRI技术的飞速发展,DTI技术不再局限于脑部疾病的研究[3-7],已延伸到脑外疾病的研究[8-11],脊髓就是其中研究之一。能否DTI技术对颈髓进行客观、定量分析,进而为颈髓病变患者的治疗预后提供新的安全无创的评价,是目前临床关注的热点之一。
1 材料与方法
1.1 临床资料选择正常志愿者30名作为研究对象,男13名、女17名,年龄23~27岁,平均年龄24岁。所有研究对象均为临床上无上下肢神经压迫症状,如麻木、疼痛、无力等,且影像上椎间盘均无膨出、突出征象的正常成年人。
所有研究对象均无磁共振检查禁忌,剔除伪影较大或成像质量差的图像。所有受检者均了解本研究目的、内容,并签署知情同意书。
1.2 磁共振图像数据采集所有扫描采用GE公司生产的1.5T signa磁共振成像系统,有效梯度场强为33mT/m,最大切换率为120T/ m/s,应用4通道相控阵脊柱线圈。常规颈椎MRI采用自旋回波(spin echo,SE)序列扫描,分别为矢状位T1WI、矢状位T2WI、轴位T2WI,矢状位DTI成像,矢状位DTI成像范围自延髓至胸1椎体水平,轴位T2WI分别对C2/3-C6/7各椎间盘扫描。矢状位DTI检查与常规扫描定位相同,采取单次激发自旋回波平面成像技术(single-shot spin echo planar imaging,SS-SE-EPI),弥散加权系数(b)分别取0和500,弥散敏感梯度取15个不同方向。具体参数如下:①矢状位T1WI:TR 425ms,TE 14.5ms,FOV 24cm,矩阵128×128,层厚3mm,层间距0,共扫描8层;②矢状位T2WI:TR 2320ms,TE 120ms,FOV 24cm,矩阵128×128,层厚3mm,层间距0,共扫描8层;③轴位T2WI:TR 3100ms,TE 129ms,FOV 24cm,矩阵128×128,层厚3mm,层间距0,共扫描10层;④矢状位DWI:TR 3100ms,TE min,FOV 24cm,矩阵128×128,NEX=6,b值分别取0和500,弥散敏感梯度取15个不同方向,层厚3mm,层间距0,共扫描8层。
1.3 DTI图像后处理与数据测量颈髓FA值与ADC值的测量:将DTI的原始数据导入GE functool软件进行后处理。处理后的每一个层面分别获得ADC图和FA图。然后使用DTI与T2WI矢状位图像融合辅助定位。在b=0的图像上放置感兴趣区(region of interest,ROI),ROI位于每个颈椎间盘相对应的颈髓前份区域测量FA值与ADC值,ROI尽量保持大小一致,约12-16个测量体素。测量时须避开脑脊液。

2 结 果
2.1 正常颈髓扩散张量成像研究30例志愿者顺利完成常规MRI扫描及DTI成像,常规MRI图像清晰,清晰显示颈髓的形态、信号及周围组织结构。DTI成像FA图及ADC图质量好,颈髓在FA图中表现为高信号呈白色,在ADC图中表现为低信号呈灰色。颈髓DTT成像,纤维束光滑完整。见图1-8。
2.2 颈髓不同节段FA值、ADC值分析研究组共30例,150个节段颈髓,不同节段颈髓FA值及ADC经正态性检验,为正态性分布,总体均数比较采用单因素方差分析,FA值及ADC值在各节段之间差异有统计学意义(表1);从FA及ADC均值可发现,其中C2/3水平FA值最高、ADC值最低,C6/7水平FA值最低、ADC值最高,从C2/3至C6/7节段颈髓FA值逐渐降低(图1)、而ADC值逐渐增高(图2)。
2.3 颈髓各节段两两之间FA值及ADC值分析颈髓各节段的FA值方差齐性检验显著性0.97,方差齐,各节段两两之间比较采用LSD-t检验,各节段FA值两两之间比较均有统计学意义(P<0.05)。各节段ADC值方差齐性检验方差不齐,各节段两两之间比较采用Tamhane's T2(M)检验,各节段ADC值两两之间比较,C2/3与C5/6、C6/7有统计学差异,C3/4、C4/5与C6/7之间有统计学差异(P<0.05),余各节段颈髓ADC值两两之间无统计学差异(P>0.05)(表2)。FA值与ADC值之间呈负相关,相关系数为-0.717,有统计学意义(P<0.05)(表3)。
3 讨 论
3.1 DTI基本原理及技术1827年Robert Brown发现分子或微观粒子之间发生的各种无规则的随机碰撞,这种无规律的运动称之为布朗运动[12]。人体中大约有70%的水,水分子在不停地随机无序运动着,这种运动即为弥散。常规MRI序列对水分子弥散运动的敏感性很低。DWI是目前最理想的观察水分子扩散的方法,但不能反映组织弥散各向异性。DTI是在DWI技术基础上发展起来的一项新型MRI技术,它利用扩散敏感梯度从多个方向对水分子的扩散各向异性进行量化,能在活体反映细微的病理生理结构的信息。
表1 颈髓不同节段FA值、ADC值总体均数单因素方差分析
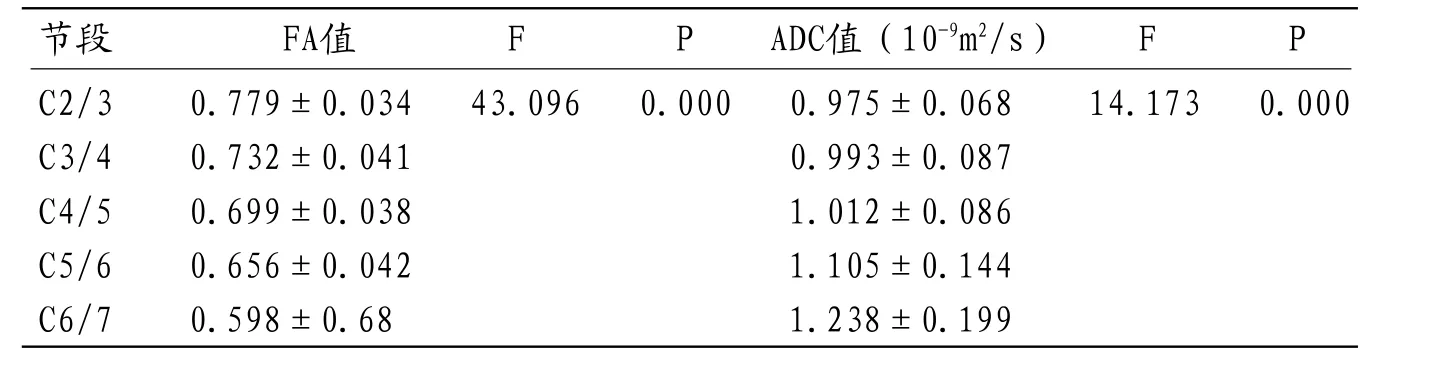
表1 颈髓不同节段FA值、ADC值总体均数单因素方差分析
节段 FA值 F P ADC值(10-9m2/s) F PC2/3 0.779±0.034 43.096 0.000 0.975±0.068 14.173 0.000 C3/4 0.732±0.041 0.993±0.087C4/5 0.699±0.038 1.012±0.086C5/6 0.656±0.042 1.105±0.144C6/7 0.598±0.68 1.238±0.199
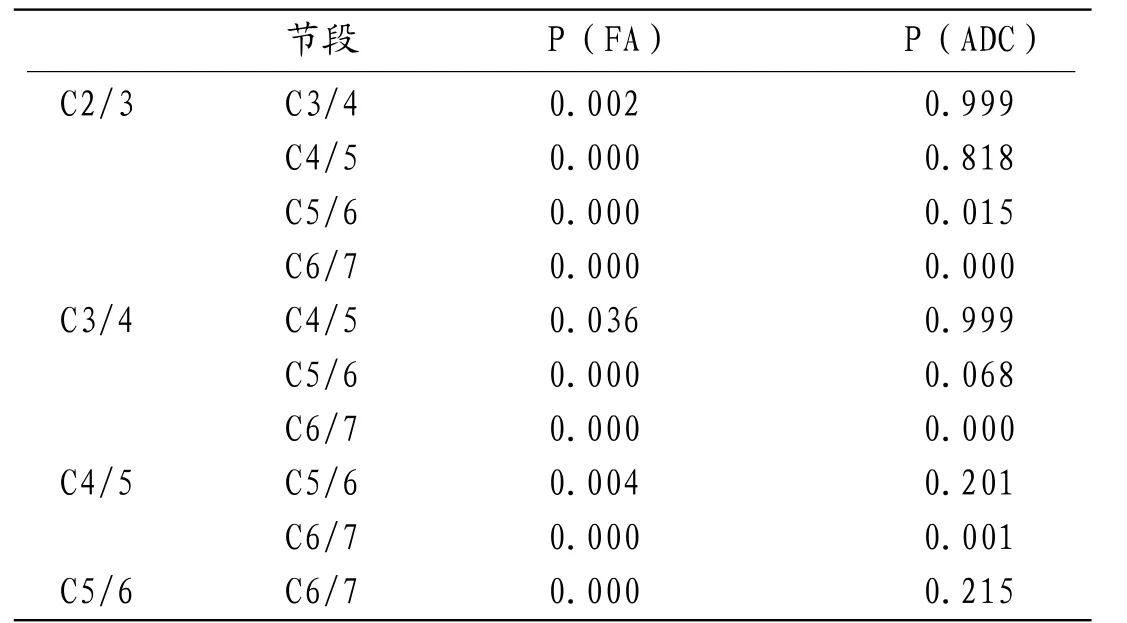
表2 颈髓5个节段的FA值两两之间LSD-t检验,ADC值两两之间Tamhane's T2(M)检验

表3 FA值与ADC值之间的关系比较Pearson相关分析
DTI是基于组织中水分子在不同方向的弥散速率成像的。水分子在各个方向的弥散速率不同称之为各向异性。它主要是由于组织特殊的排列方式或者某些方向上存在限制水分子弥散的因素造成的。图像中的每一个体素都被假设成一个三维的椭球体,每个球体的水分子在三个方向的弥散速率分别用三个本征弥散值(λ1,λ2,λ3)表示,其中λ为最大值的方向,为主要弥散方向。当λ1=λ2=λ3时,水分子的扩散运动在各个方向的速度相同,即扩散为各向同性,扩散椭球体呈球体,脑脊液即属于这种扩散方式。当λ1≠λ2=λ3时,水分子在特定方向上的扩散速度不同,即扩散具有各向异性。当2λ1>λ2+λ3时,代表水分子在椭球体最长径λ1方向上的扩散系数或扩散强度远比其他方向要大,椭球体较细长,说明具有很强的各向异性。已有学者[13]证明在脑部神经纤维中的水分子扩散即为此扩散方式,且最大扩散方向与神经纤维的长轴方向一致。
FA:即各向异性分数,计算公式为:

取值范围介于0到1之间,代表测量体素中的弥散异性程度,FA值趋于0时,代表弥散各向同性,表明纤维束被破坏或发育不全,细胞膜、髓鞘及轴索的方向一致性被破坏;F值趋于1时,代表趋于很强的弥散各向异性,纤维束的细胞膜、髓鞘及轴索具有良好的完整性,并且发育完好[14]。
ADC:又称平均扩散(mean diffusion,MD),计算公式MD=(λ1+λ2+λ3)/3;ADC值越大,水分子弥散越强,ADC值越小,弥散受限。ADC反应了人体组织中每个测量体素弥散强度的指标,但忽略了各向异性。
3.2 正常颈髓的FA值及ADC值研究近年来弥散成像已被许多国内外学者应用于腰椎间盘退变的定量分析,但目前国内外脊髓型颈椎病的DTI研究仍在初步研究阶段,不同节段、不同年龄段颈髓FA值、ADC值改变尚无统一说法。在国内,郑奎宏等[15]研究结果显示颈髓C1水平ADC值明显高于C2-C7水平ADC值,颈髓C1水平FA值明显低于C2-C7水平FA值,颈髓C2-C7水平的ADC值及FA值之间差异无统计学意义;王岩等[16]研究表明颈髓C3水平FA值较其余水平高、各ADC值之间差异无统计学意义;孟祥水[17]、涂灿[18]等认为正常脊髓不同节段FA值及ADC值均无明显差异;在国外也有Wheeler-Kingshott CA、Hickman SJ等[19]学者的研究结果认为各节段FA值及ADC值之间差异无统计学意义。本研究中不同节段的FA值结果经统计学分析表明:正常人颈髓C2-C7各椎间盘水平不同节段的FA值不相同,C2/3水平颈髓FA值最高,C6/7水平颈髓FA值最低,差别有统计学意义,这与多数国内外相关报道[20-27]的研究结果基本一致。FA值的变化主要原因可能是由于不同节段颈髓内白质和灰质比例不同。在解剖学上,颈髓内的灰白质并非均匀一致分布,除了在颈髓与延髓交界处含有较多的灰质核团,越往足侧灰质比例越高,白质比例减少,在颈膨大处(C4-T1)灰质核团明显增多。由于水分子在白质内沿神经纤维长轴方向的扩散相对自由,而垂直于它的方向则受到限制,导致其各向异性程度较高,FA值较高;水分子在灰质其内的扩散受限程度较小,显示出较低的各向异性,FA值较低;所以脊髓中的白质各向异性高于灰质。颈髓的这种解剖特点可能是颈髓FA值从头侧向足侧递减的主要原因之一。另外,可能与臂丛神经进出颈髓也有关,越往足侧越粗大的臂丛神经的进出,会导致神经纤维束方向一致性的改变,这可能也是导致FA值逐渐递减的原因。
本研究中不同节段的ADC值有统计学差异,从头侧向足侧逐渐升高,进一步节段ADC值两两之间比较,C2/3与C5/6、C6/7有统计学差异,C3/4、C4/5与C6/7之间有统计学差异(P<0.05)。从头侧向足侧ADC值的逐渐递增,其原因可能与FA值变化的原因类似:颈髓中的灰质核团逐渐增多,水分子扩散受限较少,垂直方向的本征弥散值(λ2,λ3)增高,ADC值逐渐增高。但是,关于不同节段ADC值的变化,目前国内外学者争议很多,尚无统一说法,这可能与ADC值的敏感性较FA值低有关,同时也受机器扫描参数的影响较大,Dudink J,Yoshiura T[28-29]等研究认为脑部的DTI研究中随着b值的增加,ADC值呈线性降低,FA值无显著性改变。b值的变化直接影响ADC值,b值越大,对扩散的速度差异越敏感,但对运动伪影也越敏感,图像质量差、信噪比低;b值过小,虽然图像质量好,但会产生T2穿透效应,成像容易受T2WI影响,对水分子的扩散差异难以区分;以往的研究中,大家对b值的选取各不相同,本研究中,参照以往的研究成果,再结合设备的实际情况多次反复实验,最终DTI成像时取b值为500,既兼顾了扩散速度的差异,又获得了质量较高的图像。因此我们猜测,机器不同、参数设置不同,可能是导致ADC值争议较多的原因所在。
综上所述,SE-EPI序列DTI成像技术可以无损伤地对颈髓进行水分子弥散的定量评估;正常人颈髓不同节段FA值、ADC值存在差异,FA值从C2/3至C6/7节段逐渐降低;ADC值从C2/3至C6/7节段值逐渐升高;FA值与ADC值之间呈负相关;DTI能对颈髓进行客观、定量地分析,有重要的临床应用价值。

图1-8 女,24岁,临床无神经系统症状。图1-3:矢状位T1WI、T2WI及轴位T2WI图像,未见明显椎间盘膨出或突出;图4-7:FA图、ADC图、FA彩图、ADC彩图;图8:脊髓DTT重建图,显示颈髓纤维束光滑完整无受压。图9-10 颈髓不同节段FA值及ADC值均值图。
[1]Basser PJ,Mattiello J,and Le Bihan D.Estimation of the effective self-diffusion tensor from the NMR spine eho[J] Magn Reson B,1994,103:247-254.
[2]Basser PJ,Mattiello C,and Le Bihan D.MR diffusion tensor spectroscopy and imaging[J]. Biophys,1994,66:259-267.
[3]You R,MeNeil JJ,O’Malley HM,et al.Risk factors for lacunjar infarction syndromes[J]. Neurology,1999,45(8):1483-1487.
[4]Sullivan M O,Morris R G, Huckstep B, et al. Diffusion tensor MRI correlates with executive dysfunction in patients with ischaemic leukoaraiosis[J].Neurol Neurosurg Psychiatry,2004, 75(3):441-447.
[5]Jaivijal ramu,Juan herrera. B r a i n f i b e r t r a c t plasticity experimental spinal cord injury:diffusion t e n s o r i m a g i n g[J].E x p Neurol,2008,212(1):100-107.
[6]吴文军.腔隙性脑梗死60例临床分析[J].临床和实验医学杂志,2006,5 (5):536-537.
[7]N o b u h a r a K,O k u g a w a G, Minami T,et al.Effects of electroconvul-sive therapy on frontal white matter in latelife depression: a diffusion tensor imaging study[J]. Neuropsychobiology,2004, 50:48-53.
[8]C R U Z L C,D O M I N G U E S R C,G A S P A R E T T O E L,e t al.Diffusion tensor imagingof the cervical spinal cord of patients with relapsingremising multiple sclerosis: a study of 41 cases[J].Arq Neuropsiquiatr,2009,67(2B): 391-395.
[9]Budde MD,Xie M,Cross AH,et al.Axial diffusivity is the Primary correlate of axonal injury in the experimental autoimmune encephalomyelitis spinal cord: a quantitative p i x e l w i s e a n a l y s i s[J] Neurosei,2009,29(9):2805-2813.
[10]KHALIL C,HANCART C,THUC L,et al.Diffusion tensor imaging and tractography of the median nerve in carpal tunnel syndrome: preliminary results [J].Eur Radiol,2008,18(10):2283-2291.
[11]VARGAS M I,VIALLON M,NGUYEN D,et al.Diffusion tensor imaging(DTI) and tractography of the brachial plexus: feasibility and initial experience in neoplastic conditions[J].Neuroradiology, 2010,52(3):237-245.
[12]严华刚,李海云.从随机行走模型到磁共振扩散加权重成像[J].中国医学物理学杂志,2010,27(5):2105-2108.
[13]Lin Cp,Tseng WY,Cheng HC,et al.Validation of diffusion tensor magnetic resonace axonal fibel imaging with r e g i s t e r e d m a n g a n e s eenhanced optictracts[J]. Neuroimage,2001,14(5):1035-1047.
[14]KARAMPINOS D C,MELKUS G,S H E P H E R D T M,e t a l. Diffusion tensor imaging and T(2) relaxometry of bilateral lumbar nerve roots :feasibility of in-plane imaging[J].NMR Biomed,2013,26(6):630-637.
[15]郑奎宏,马林,郭行高,等.正常人颈髓MR扩散张量成像的初步研究[J].中华放射学杂志,2006,40(5):490-493.
[16]王岩,马林,郭行高,等.正常人颈髓扩散张量成像的定量分析[J].中国医学影像技术,2009,25(8):1371-1374.
[17]孟祥水,侯金文,屈传强,等.探讨3T磁共振DTI成像技术及其参数在颈髓中的特点[J].山东大学学报(医学版),2007,45(8):830-834.
[18]涂灿,汪建华,廖海波,等.磁共振扩散张量成像与纤维束成像在脊髓型颈椎病中的应用研究[J]中国骨伤,2016,29(3):200-204.
[19]Wheeler-Kingshott CA,Hickman SJ,Parker GJ,Ciccarelli O, Symms MR, Miller DH, Barker GJ.Investigating c e r v i c a l s p i n a l c o r d s t r u c t u r e u s i n g a x i a l diffusion tensor imaging[J]. Neuroimage,2002,16(1):93-102.
[20]Chang Y,Jung TD,Yoo DS,et al.Diffusion tensor imaging and fiber tractography of patients with cervical spinal cord injury[J].J Neurotrauma,2010,27(11):2033-2040.
[21]和一帆,闫东,赵新湘,等.正常人颈髓不同节段磁共振扩散张量成像分析[J].实用放射学,2012,28(7):1002-1005.
[22]由长城,朱凯,闫景龙,等.3.0T磁共振弥散张量成像技术对轻度脊髓型颈椎病的诊断价值[J].中国脊柱脊髓杂志,2011,21(10):839-842.
[23]Mamata H,Jolesz FA,Maier SE,et al.Apparent diffusion coefficient and fractional anisotropy in spinal cord: age and cervical spondylosisrelated changes[J].Magn Reson Imaging,2005,22(1):38-43.
[24]Budzik JF, Balbi V,Le Thuc V, Duhamel A,Assaker R, Cotten A.Diffusion tensor imaging and fibre tracking in cervical spondylotic myelopathy[J].Eur Radiol,2010.
[25]Onu M,Gervai P,Cohen-Adad J, et al. Human cervical spinal cord funiculi: investigation with magnetic resonance diffusion tensor imaging[J].J Magn Reson Imaging,2010,31(4):829-837.
[26]赵鹏,陈学明,刘亚东,等.无骨折脱位型颈脊髓损伤患者颈髓的弥散张量成像[J].中国康复理论与实践,2015,21(7):838-840.
[27]陈士跃.正常颈髓扩散张量成像扩散参数的影响因素和相关性研究[J].中国CT和MRI杂志,2016,14(1):1-4.
[28]Dudink J,Larkman DJ,Kapellou O,e t a l.H i g h b-v a l u e diffusion tensor imaging of the neonatal brain at 3T[J]. AJNR,2008,29(10):1966-1972.
[29]Yoshiura T,Wu O,Zaheer A,et al. Highly diffusion-sensitized MRI of brain: dissociation of gray and white matter[J].Magn Reson Med,2001,45(5):734-740.
(本文编辑: 张嘉瑜)
Quantitatively Analysis of Diffusion Tensor Imaging of the Cervical Spinal Cord
NI Feng, SHAN Hua, YIN Xin-dao. Department of Medical Imaging, Nanjing Hospital Affiliated of Nanjing Medical University, Nanjing 210006, Jiangsu Province, China
ObjectiveTo explore the clinical application value of diffusion tensor imaging(DTI), by studying normal diffusion tensor imaging of the cervical spinal cord in healthy volunteers.MethodsCervical spinal cord routine MRI and DTI were performed in 30 cases of healthy volunteers. The radiological findings were analyzed, and the fractional anisotropy (FA) values and the apparent diffusion coefficient (ADC) values were calculated, and the diffusion tensor tracking (DTT) images were reconstructed.ResultsThe FA and ADC maps were obtained by every volunteer. The FA values and ADC values are significant difference among different segments of cervical spinal cord(P<0.05).C2/3 segment is the highest FA value, the lowest ADC value. C6/7 segment is the lowest FA value and the highest ADC value. It's a negative correlation between the FA values and the ADC values.ConclusionDTI can objectively and quantitatively analyze cervical spinal cord, and it has important clinical application value.
Cervical Spinal Cord; Magnetic Resonance Imaging; Diffusion Tensor Imaging
R445.2
A
10.3969/j.issn.1672-5131.2017.08.001
2017-07-11
殷信道
