LLC种植瘤靶向USPIO标记间充质干细胞MRI活体示踪试验
2017-08-10王雪芹张永峰赵荣荣王希臻王海宇
王雪芹,张永峰,赵荣荣,王希臻,王海宇
(1.潍坊医学院附属医院影像中心,山东潍坊 261031;2.潍坊医学院附属医院儿科,山东潍坊 261031)
LLC种植瘤靶向USPIO标记间充质干细胞MRI活体示踪试验
王雪芹1,张永峰2,赵荣荣1,王希臻1,王海宇1
(1.潍坊医学院附属医院影像中心,山东潍坊 261031;2.潍坊医学院附属医院儿科,山东潍坊 261031)
将超顺磁性氧化铁微粒-多聚赖氨酸(USPIO-PLL)标记的人脐带间充质干细胞(HUMSCs)移植入小鼠Lewis肺癌细胞(LLC)种植瘤模型小鼠,利用3.0TMR对HUMSCs的活体示踪技术,观察移植小鼠体内的HUMSCs 磁共振(MRI)信号及肿块大小的变化,探讨HUMSCs移植肺癌动物模型后的定向迁移、转化情况及间充质干细胞(MSCs)对肿瘤的影响。以PLL为转染剂,用USPIO对HUMSCs-PLL进行磁性标记;将磁标记的HUMSCs通过鼠尾静脉移植入Lewis肺瘤细胞(LLC)种植瘤小鼠体内,分别于移植前、移植后1 d、10 d进行MRI观察。结果显示,USPIO-PLL可安全有效标记HUMSCs,标记率大于96%,细胞活性达标。移植后1 d MRI可监测到HUMSCs到达肿瘤区,10 d到达肿瘤区MSCs增多,MRI信号显著降低(P<0.05)。建模成功后,各试验组移植后1 d和10 d肿瘤体积差异不显著(P>0.05);移植后1 d和10 d抑瘤率均为正值。说明3.0T MRI可以有效进行标记干细胞移植后的活体示踪。HUMSCs对LLC种植瘤有定向趋化作用,可以聚集至肿瘤区域发挥抑瘤作用,又可促进肿瘤血管生成,多种影响相互交叉最终抑制肿瘤生长。
人脐带间充质干细胞;肺癌;超微超顺磁性氧化铁微粒;磁共振成像
肺癌是我国发病率和病死率居首位的恶性肿瘤,治疗疗效不理想,5年生存期不到15%[1]。间充质干细胞(mesenchymal stem cells,MSCs) 是具有多向分化潜能的成体干细胞,它不单具有多向分化潜能,还能靶向迁移到毁伤组织、炎症区域及肿瘤部位[2]。间充质干细胞对恶性肿瘤的影响越来越吸引医疗界的关注,但观点分歧较大[2-7],主要分为促进肿瘤成长与转移、抑制肿瘤成长与转移、对肿瘤的成长与转移没有明显影响3种不同观点。随着对肿瘤研究新思路的不断扩展,MSCs必将成为研究肿瘤发展和治疗的热点。
1 材料与方法
1.1 材料
1.1.1 实验动物 选健康4周龄~6周龄SPF级Balb/c小鼠30只,体重 20 g~30 g,全部小鼠均购自山东省实验动物中心,许可证号:SCXK(鲁)20140007。小鼠随机编号,按如下条件饲养:温度23 ℃±2 ℃,相对湿度40%~70%;饲养笼具为小鼠笼(290 mm×180 mm×160 mm),分笼饲养;笼具、垫料、饮用水及饲料均按试验要求标准方法准备,小鼠自主饮食。
1.1.2 主要试剂与药物 小鼠Lewis肺癌细胞(Lewis lung cancer cells,LLC)株,购自中国科学院上海生命科学研究院细胞库; 多聚赖氨酸(poly-L-lysine, PLL),美国Sigma公司产品;胎牛血清( fetal bovine serum, FBS),北京Solarbio公司产品;超小型超顺磁氧化铁粒子(uhrasmall superparamagntiec iron oxide,USPIO),美国Guerbet公司产品。
1.1.3 主要仪器设备 Signa 3.0T 磁共振(magnetic resonance imaging, MRI)扫描仪,美国通用电气公司产品;HERAcell150i型CO2培养箱,Thermo公司产品;CKX41倒置显微镜,日本奥林帕斯公司产品;SW-CJ-2F型双人双面净化工作台,苏州博莱尔净化设备有限公司产品。
1.2 方法
1.2.1 制备小鼠LLC种植瘤模型
1.2.1.1 小鼠LLC细胞的解冻与培养 从液氮罐取出小鼠肺癌细胞(lewis lung carcinoma,LLC)冻存管,即刻置于37℃水浴解冻。待全部解冻后,置于净化工作台,吸取细胞悬液,注入10倍DMEM培养液的培养瓶内,置于37℃、体积分数为5%CO2培养箱培养,每2 d~3 d传代1次。
1.2.1.2 小鼠肺癌LLC移植瘤模型制作 将成长状况佳的LLC细胞悬液离心(1 000 r/min,5 min),上清弃尽,然后加入培养液,细胞浓度调达到5×106个/mL,用注射器刺入小鼠左侧腋部皮下组织内,0.2 mL/只。接种后每天观察小鼠进食、饮水、活动度等一般状况及成瘤情况。
1.2.2 人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUMSCs)的体外分离、培养及传代 在净化工作台,将脐带剪碎至约1 mm×1 mm×1 mm小粒,接种在含有100 mL/L FBS的DMEM/F12培养基,培养出原代细胞。原代细胞接种到T-25培养瓶中,置于37℃、体积分数为5%CO2、95%湿度的培养箱,遵照干细胞培养方法进行消化传代。
1.2.3 USPIO标记HUMSCs和表面标记物鉴定 USPIO加到P3代MSCs培养液中进行标记,细胞用体积分数100 mL/L FBS和双抗DMEM/F12培养基培养传代3代后,取对数生长期第4代细胞,配制成细胞悬液,用鼠抗人PE标记的CD73及同型对照10 μL,4℃避光孵育30 min,PBS液洗涤3次后流式细胞仪检测分析。
1.2.4 实验动物分组及磁标记HUMSCs移植 LLC移植瘤模型建模成功后进行细胞移植,小鼠称重,随机分成2组:对照组15只(NS组),试验组15只(MSCs组)。NS组,注射生理盐水0.2 mL/只;MSCs组,用1 mL医用注射器将0.2 mL USPIO标记HUMSCs(细胞浓度3×106/mL)细胞悬液经鼠尾静脉注射。
1.2.5 USPIO标记HUMSCs移植后小鼠3.0TMRI动态观察
1.2.5.1 MRI扫描方式及条件 分别于建模成功后及HUMSCs移植后1 d和10 d进行MR观察,常规准备后,用GE3.0MR扫描仪和腕关节线圈,将麻醉后小鼠按标准姿势固定于大注射管内,小鼠置入腕关节线圈内。扫描体位、扫描序列及扫描参数(略)。
1.2.5.2 信号变化 信号改变以下列公式计算:△SI=[(SIL-SIU)/SIU]×100%(△SI为信号变化率,SIL为肿瘤区标记细胞信号,SIU为肿瘤组织信号)。
1.2.5.3 肿瘤MRI变化 MRI观察间充质干细胞移植肺癌小鼠后生殖存活、迁移、归巢情况,并分别于HUMSCs移植前、后行MRI,观察记录肿瘤的大小、部位、形态、信号变化等情况,测量肿瘤体积。
1.2.5.4 计算抑瘤率 移植10 d后进行MRI扫描,然后断颈椎处死全部小鼠,完整切除小鼠肺瘤体后称重,按公式计算抑瘤率,抑瘤率=(NS组瘤重均值-HUMSCs组瘤重均值)/NS组瘤重均值×100%,正值表示间充质干细胞抑制肿瘤生长,负值表示促进肿瘤生长。
1.2.6 统计学处理 依据不同的统计学资料、不同的目的采取相应的统计方法,所有的统计学分析均使用统计软件SPSS12.0完成。
2 结果
2.1 成功培养脐带间充质干细胞
显微镜下观察干细胞形态特征及成长状况,用人脐带成功培养出间充质干细胞,用USPIO-PLL作为细胞内对比剂可以安全高效的标记HUMSCs,标记率大于96%,细胞成长状况良好。
2.2 3.0MRI图像结果
2.2.1 病变区信号变化 肿瘤在T1加权序列呈等或稍低信号,T2WI、T2FLAIR序列呈稍高信号(图1),移植后 1 d和10 d MR FSE T2WI扫描序列上在肿瘤周围可见呈现点状、短线状低信号,即USPIO标记的MSCs MR信号,1 d时MRI低信号位于肿瘤边缘(图2);10 d时病灶区低信号明显多于1 d,且有向病灶中心迁移趋势(图3和表1),说明MSCs可向小鼠肿瘤区定向趋化,且10 d到达病灶MSCs数目较1 d增多并向肿瘤中心迁移,进行增殖、分化。NS对照组于 FSE T2WI 加权像上未见明显信号减低区。
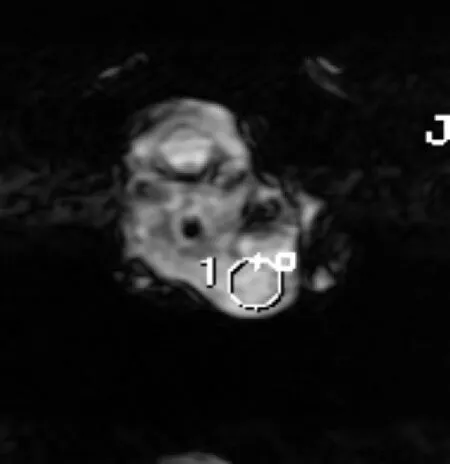
图1 LLC种植成功后MRI图像
2.2.2 肿瘤体积比较 建模成功后肿瘤体积为1.92cm3±1.16 cm3,MSCs组移植后1 d为1.86 cm3±1.36 cm3,移植后10 d为 1.12 cm3±1.06 cm3,MSCs移植后10 d体积较NS组及移植前有所降低,但无统计学意义(P>0.05);NS组不同时间体积差别无统计学意义(表2)。
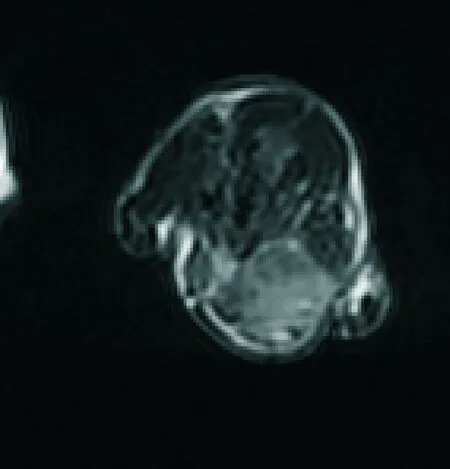
图2 MSCs移植1天MRI图像

图3 MSCs移植10MRI图像


序列Sequence移植后1d1dayaftertransplantation移植后10d10daysaftertransplantationFPFSET2WI21.66±5.3852.68±4.3559.16<0.01
2.3 抑瘤率
表3显示,移植10 d抑瘤率为19.8%, 1 d为抑瘤率为5.08%,均为正值。
3 讨论
3.1 MSCs与肿瘤关系
近年来,MSCs对肿瘤作用成为医疗界研究热点,来自不同实验室的研究带来不同声音[2,5-8],主要有3种不同的观点,即可促进肿瘤的成长与转移,可抑制肿瘤的成长与转移,对肿瘤的成长与转移没有明显影响。例如,Pang P等[5]报道MSCs具有向肿瘤归巢的能力,抑制肿瘤生长;Paholak H J等[7]报道干细胞可以抑制胸部肿瘤的生长与转移;另有研究却表明MSCs能够促进肿瘤的生长和转移,有研究认为MSCs促进肿瘤的生长发展主要作用机制是参与肿瘤间质形成及增强肿瘤细胞活性有关。Zhang C等[8]通过研究发现人间充质干细胞向肿块定向趋化后,可以分化成具有内皮细胞特征的新细胞;大鼠骨髓来源的MSCs移植后可促进病灶周围VEGF表达[9]。本试验显示,MSCs移植10 d肿瘤体积较移植前减少,但差别无统计学意义。抑瘤率为正值,说明MSCs对肿瘤作用机制复杂,它一方面可以通过促进VEGF表达、血管生成增多,促进肿瘤的生长甚至转移,另一方面又可以通过定向趋化、分化及等抑制肿瘤生长,最终产生抑制肿瘤生长的作用。

表2 MSCs组与NS组肿瘤体积变化比较

表3 抑瘤率
3.2 MR活体示踪技术在观察移植磁标记干细胞转归、分化中的作用
3.2.1 干细胞移植后示踪现状 干细胞移植后,如何有效安全观察其在受体中的生存状况,迁移,转化,归巢等,一直是亟待解决的关键性技术。自1999年分子影像学概念提出,随着不断深入研究,分子影像成为解决这一难题的有效手段。目前为止,众多研究显示MRI成为干细胞活体示踪的最佳选择[3-4,6,10-11]。本研究用多聚赖氨酸转染,包裹氧化铁纳米颗粒,使带负电荷的细胞易于摄取Feridex-PLL结合物,并与间充质干细胞组成靶向迁移的分子探针,进行肺癌与间充质干细胞相关研究。应用3.0TMR活体观察移植干细胞在小鼠LLC移植瘤模型转归情况,目前为止相关研究不多[11-13],本试验采用多种序列对LLC移植瘤模型移植干细胞前后进行扫描,成功筛选出合适的扫描参数,为MSCs 移植肿瘤后的3.0T MR观察进一步提供试验数据。
3.2.2 MRI显示肿瘤区信号变化 肿瘤T1WI序列呈等或稍低信号,T2WI、T2FLAIR序列呈稍高信号,移植后1 d和10 d MR FSE T2WI扫描序列图像上于肿瘤区周围可见呈现点状、短线状低信号,即标记的HUMSCs MR信号,1 d MR低信号位于肿瘤边缘;10 d时病灶区低信号明显多于1 d,且有向病灶中心迁移趋势,证明MSCs能够向小鼠肿瘤区定向趋化,且10 d到达病灶MSCs数目较1 d增多并向中心迁移,进行增殖、分化。NS对照组于 FSE T2WI 加权像上未见明显信号减低区。
3.2.3 肿瘤体积比较及抑瘤率 移植10 d,HUMSCs组较NS组小鼠肿块体积减少;较移植前体积也有所减少,但差别无统计学意义。本试验HUMSCs移植后1 d和10 d抑瘤率均为正值,说明其对LLC移植瘤有抑制作用。
本试验结果显示,HUMSCs对肿瘤作用机制复杂多样[14-15],移植HUMSCs既有肿瘤定向趋化、分化特性,从而抑制肿瘤生长;又可刺激VEGF表达,促进血管形成而一定程度上促进肿瘤生长;抑肿瘤生长在本试验占优势。后续研究将会扩大实验动物数量,延长观测时间,从而得到更确切的试验数据。
[1] Wang L,Yu C,Liu Y,et al.Lung cancer mortality trends in China from 1988 to 2013:new challenges and opportunities for the government[J].Int J Environ Res Public Health,2016,13(11): pii:E1052.
[2] Ye Y,Peng Y R,Hu S Q,et al.Invitrodifferentiation of bone marrow mesenchymal stem cells into neuron-like cells by cerebrospinal fluid Improves motor function of middle cerebral artery occlusion rats[J].Front Neurol,2016,27(7):183.
[3] Varghese B,Xavier R,Manoj V C,et al.Magnetic resonance imaging spectrum of perinatal hypoxic-ischemic brain injury[J].Indian J Radiol Imaging,2016,26(3):316-327.
[4] Shim J,Kwak B K,Jung J,et al.Evaluation of engraftment of superparamagnetic iron oxide-labeled mesenchymal stem cells using three-dimensional reconstruction of magnetic resonance imaging in photothrombotic cerebral infarction models of rats[J].Korean J Radiol,2015,16(3):575-585.
[5] Pang P,Wu C,Gong F,et al.Nanovector for gene transfection and MR imaging of mesenchymal stem cells[J].J Biomed Nanotechnol,2015,11(4):644-656.
[6] Lobsien D,Dreyer A Y,Stroh A,et al.Imaging of VSOP labeled stem cells in agarose phantoms with susceptibility weighted and T2* weighted MR Imaging at 3T:determination of the detection limit[J].PLoS One,2013,8(5):e62644.
[7] Paholak H J,Stevers N O,Chen H,et al.Elimination of epithelial-like and mesenchymal-like breast cancer stem cells to inhibit metastasis following nanoparticle-mediated photothermal therapy[J].Biomaterials,2016,104:145-157.
[8] Zhang C,Yang S J,Wen Q,et al.Human-derived normal mesenchymal stem/stromal cells in anticancer therapies[J].J Cancer,2017,8(1):85-96.
[9] Quittet M S,Touzani O,Sindji L.Effects of mesenchymal stem cell therapy,in association with pharmacologically active microcarriers releasing VEGF,in an ischaemic stroke model in the rat[J].Acta Biomater,2015,15(5):77-88.
[10] 张晶晶,李晓晶,李嘉欣,等.Survivin维持小鼠胚胎干细胞多潜能性的研究[J].动物医学进展,2014,35(2):58-62.
[11] 孙 凤,杨汉丰,张 川,等.MRI体外定量测定 SPIO标记兔骨髓间充质干细胞[J].临床放射学杂志,2015,34(4):647-65.
[12] Wang Y,Xu F,Zhang C,et al.High MR sensitive fluorescent magnetite nanocluster for stem cell tracking in ischemic mouse brain[J].Nanomedicine,2011,7(6):1009-1019.
[13] Sahin E,Baycu C,Koparal A T,et al.Resveratrol reduces IL-6 and VEGF secretion from co-cultured A549 lung cancer cells and adipose-derived mesenchymal stem cells[J].Tumor Biol,2016,37(6):7573-782.
[14] Agrawal V,Maharjan S,Kim K,et al.Direct endothelial junction restoration results in significant tumor vascular normalization and metastasis inhibition in mice [J].Oncotarget,2014,5(9):2761-2777.
[15] Poggi A,Giuliani M.Mesenchymal stromal cells can regulate the immune response in the tumor microenvironment[J].Vaccines (Basel),2016,4(4).pii:E41.
Experimental Study on LLC Implanted Tumor Targeting USPIO Labeled Mesenchymal Stem Cells by MRIinVivo
WANG Xue-qin1,ZHANG Yong-feng2,ZHAO Rong-rong1,WANG Xi-zhen1,WANG Hai-yu1
(1.ImageCenterofWeifangMedicalSchoolAffiliatedHospital,Weifang,Shandong,261031,China; 2.PediatricsofWeifangMedicalSchoolAffiliatedHospital,Weifang,Shandong,261031,China)
In this study,human umbilical cord mesenchymal stem cells (HUMSCs) labeled with ultra-superparamagnetic iron oxide microparticle-polylysine (PLL) were transplanted into lung cancer LLC mice,and the HUMSCs were expressed by 3.0TMR.MRI signal and tumor size in transplanted mice were observed to investigate the directional migration and transformation of HUMSCs transplanted lung cancer and the effect of HUMSCs on the tumor.HUMSCs-PLL was magnetically labeled with USPIO.Magnetic marker HUMSCs through rat caudal vein transplantation into the LLC growing tumor mice.MRI was observed before transplantation,1d and 10d after transplantation.Results: HUUSPIO-PLL could safely and effectively label umbilical cord mesenchymal stem cells with a labeling rate more than 96% and cell viability reaching the standard; 1 day after transplantation,the mesenchymal stem cells reached the tumor area,There were more MSCs reached the tumor area at 10 days after transplantation,the difference was statistically significant (P<0.05).There was no significant difference in the tumor volume between the experimental group and the 10 days after transplantation (P>0.05).The tumor inhibition rate was positive at 1 day and 10 days after transplantation.So,3.0T MRI can be used for stem cell transplantationinvivo; HUMSCs on LLC implantation have a directional chemotactic effect,can be gathered to the tumor area,and play an anti-tumor effect; but also promote tumor angiogenesis; multiple effects cross each other to ultimately inhibit the tumor growth.
human umbilical cord mesenchymal stem cells; lung cancer; uhrasmall superparamagntiec iron oxide; 3.0 T magnetic resonance imaging
2016-12-18
山东省医药卫生科技发展项目(2013WS0294);山东省自然科学基金项目(ZR2014HP008)
王雪芹(1976-),女,山东烟台人,副主任医师,硕士,主要从事肿瘤影像诊断工作。
R363
A
1007-5038(2017)07-0052-05
