CD4+CD29+T细胞在溃疡性结肠炎患者血清及结肠黏膜组织中的表达变化
2017-08-09封艳玲南京医科大学附属淮安市第一人民医院江苏淮安223300
封艳玲(南京医科大学附属淮安市第一人民医院,江苏淮安223300)
CD4+CD29+T细胞在溃疡性结肠炎患者血清及结肠黏膜组织中的表达变化
封艳玲
(南京医科大学附属淮安市第一人民医院,江苏淮安223300)
目的 观察CD4+CD29+T细胞血管细胞黏附分子1(VCAM-1)及髓过氧化物酶(MPO)在溃疡性结肠炎(UC)患者血清及结肠黏膜组织中的表达变化。方法 选取UC患者60例(UC组),其中活动期及缓解期各30例,设立同期查体健康者30例为健康对照组,收集血清,采用流式细胞术测定定周血中CD4+CD29+T细胞百分率,肠镜下取UC组及健康对照组结肠黏膜组织,采用免疫荧光法测定结肠中CD4+CD29+T细胞的表达量,用免疫组化法测定结肠中髓过氧化物酶(MPO)及血管细胞黏附分子1(VCAM-1)表达,用皮尔森相关法分析CD4+CD29+T细胞与MPO的相关性。结果 UC组CD4+CD29+T细胞、VCAM-1及MPO在活动期及缓解期UC患者血清及结肠黏膜组织中的表达均较健康对照组升高,且活动期高于缓解期,P均<0.05;CD4+CD29+T细胞在健康对照组血清中有表达而在结肠中未检测到表达;外周血CD4+CD29+T细胞与MPO呈正相关(r=0.543,P<0.05)。结论 CD4+CD29+T细胞在UC患者血清及结肠黏膜组织中均呈高表达,且与UC的病情程度密切相关。
溃疡性结肠炎;CD4+CD29+T细胞;血管细胞黏附分子1;髓过氧化物酶
溃疡性结肠炎(UC)是一组病因未明的复发与缓解交替的肠道慢性非特异性炎症。UC的发病涉及免疫反应的整个过程,是多个免疫因素共同作用的结果。目前多数研究认为肠道的调节性T细胞不能抑制效应细胞对肠道菌群及食物抗原的过度反应是UC发病的重要免疫学机制[1]。CD4+T细胞是UC发生发展过程中起作用的主要效应细胞,CD4+CD29+T细胞是从CD4分化的记忆性效应细胞。CD29主要表达于先前活化的T细胞上,在对抗原的再次反应中起重要作用,在多发性硬化、风湿性关节炎和系统性红斑狼疮等自身免疫性疾病中均有重要作用[2,3]。UC属于自身免疫性疾病的一种,CD4+CD29+T细胞在UC发生发展中可能发挥重要作用,而CD4+CD29+T细胞在UC中的表达及其作用机制研究甚少。故本研究主要通过检测CD4+CD29+T细胞及其配体血管细胞黏附分子1(VCAM-1)在UC患者血清及结肠黏膜组织中的表达,分析其与反映UC疾病严重程度的指标髓过氧化物酶(MPO)的相关性。
1 资料与方法
1.1 临床资料 选取2013年6月~2014年1月本院消化内科门诊、住院部及消化内镜中心的UC患者60例(UC组),男26例、女34例,年龄20~60岁。均符合2000年成都会议制定的UC诊断标准,排除合并风湿免疫类疾病、感染及肿瘤,并据该标准将患者分为活动期30例,缓解期30例。健康对照组30例,男16例、女14例,年龄20~50岁,均来自我院查体健康者。
1.2 外周血及结肠黏膜CD4+CD29+T细胞检测 每例入选者各抽静脉血4 mL,分离出血清,用流式细胞术检测UC活动期、缓解期及健康对照组入选者CD4+CD29+T细胞百分比。经肠镜下于病变处取结肠黏膜1块,用4%多聚甲醛固定,经脱水-包埋-切片等步骤制作成石蜡切片,用免疫荧光双标法检测各组结肠黏膜组织中CD4+CD29+T细胞表达。免疫荧光双标结果半定量:随机选取3个视野,用Image pro plus 6.0软件计算出每个视野的平均光密度(平均光密度=阳性表达的荧光强度/总面积),取3个视野的平均值作为CD4+CD29+T细胞的表达量。
1.3 结肠黏膜组织中MPO及VCAM-1表达检测 将结肠黏膜制作成石蜡切片后用免疫组化法检测结肠黏膜组织中MPO及VCAM-1表达。免疫组化结果半定量判定:随机选取3个视野,用Image pro plus 6.0软件计算出每个视野的平均光密度(阳性表达的荧光强度/总面积),取3个视野的平均值作为该抗原的表达量。
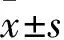
2 结果
两组血清中CD4+CD29+T细胞百分比表达比较见表1;UC组患者血清CD4+CD29+T细胞百分比较健康对照组升高(P均<0.05),且UC组活动期高于缓解期(P均<0.01)。CD4+CD29+T细胞在UC组活动期及缓解期患者的结肠黏膜组织中表达量分别为0.370±0.04、0.140±0.03,活动期高于缓解期(P<0.05),在健康对照组的结肠黏膜组织中未见明显表达。UC组血清CD4+CD29+T细胞百分比与结肠黏膜组织中MPO水平呈正相关(r=0.543,P<0.05)。
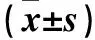
表1 三组血清CD4+CD29+T细胞百分比及结肠黏膜组织中MPO、VCAM-1表达比较
注:与健康对照组比较,*P<0.05;与同组缓解期比较,△P<0.05,○P<0.01。
3 讨论
UC的持续性炎症刺激及其易复发性给患者带来沉重负担。目前UC的具体发病机制尚不明确,对效应细胞的免疫耐受不足被认为是UC的主要免疫机制,研究者认为CD4+T细胞在UC发生发展中起主要作用[4]。CD4+CD29+T细胞属于记忆性效应细胞,在UC中研究甚少,在所阅文献中,仅有江学良等[5]学者对UC患者及UC大鼠的外周血进行检测,发现UC患者及大鼠外周血CD4+CD29+T细胞明显高于对照组,认为其可作为UC免疫监测指标,但未做深入研究。
本研究发现UC患者血清及结肠黏膜组织中CD4+CD29+T细胞百分比升高,且活动期明显高于缓解期。MPO存在于中性粒细胞嗜天青颗粒中,其在肠道组织中的表达与UC炎症的严重程度呈正相关,被作为UC患者病情严重程度的监测指标[6]。本研究结果提示血清CD4+CD29+T细胞百分比与MPO呈正相关,结合既往的研究发现CD29可调节UC小鼠中性粒细胞的聚集及炎症活动性[7],我们认为CD4+CD29+T细胞与UC的严重程度密切相关,可能通过调节MPO水平及活动性而在UC中发挥促进作用。
白细胞尤其是效应性及记忆性T细胞向结肠的黏附聚集在UC炎症的发生及持续过程中起重要作用,且研究认为与其他CD29-类T细胞相比,CD4+CD29+T细胞有更强的血管黏附能力,黏附分子的表达可能导致CD4+CD29+T细胞向炎症部位聚集[8]。
VCAM-1是VLA-4/CD29的配体,介导淋巴细胞与内皮细胞间的稳定黏附。VCAM-1在正常情况下表达很少,在体内存在炎症时表达会有所升高。既往文献研究亦证实VCAM-1在UC白细胞聚集中起重要作用,与UC的炎症程度呈正相关,对UC小鼠模型进行VCAM-1的抗体治疗可改善UC的疾病活动指数及MPO活性等指标[9]。本研究结果表明VCAM-1在健康对照组结肠黏膜组织中无明显表达,而在UC组表达明显升高,活动期高于缓解期。同时,对各组结肠黏膜组织中CD4+CD29+T细胞表达检测发现,CD4+CD29+T细胞与VCAM-1表达呈一致性,均在健康对照组中无明显表达,而在UC组明显表达,结合外周血中各组CD4+CD29+T细胞水平,我们推测VCAM-1在CD4+CD29+T细胞向结肠炎症部位的归巢中起了黏附聚集作用。我们认为,VCAM-1通过与CD29的黏附作用,将CD4+CD29+T细胞黏附聚集到结肠炎症部位,发挥对MPO的调节作用。
综上所述,CD4+CD29+T细胞在UC患者血清及结肠黏膜组织中均呈高表达,且与UC的病情程度密切相关。
[1] 龚菲力.医学免疫学[M].北京:科学出版社,2003:158.
[2] Ossege LM, Sindern E, Patzold T, et al. Immunomodulatory effects of interferon -beta- 1b in patients with multiple sclerosis[J]. Int Immunopharmacol, 2001,1(6):1085-1100.
[3] Emery P, Gentry KC, Mackay IR, et al. Deficiency of the suppressor inducer subset of T-lympho-cytes in rheumatoid arthritis[J]. Arthritis Rheum, 1987,30(8):849-856.
[4] Mottet C, Uhlig HH, Powrie F. Cutting edge:cure of colitis by CD4+CD25+regulatory T cells[J]. J Immunol, 2003,170(8):3939-3943.
[5] 江学良,权启镇,王东,等.复合法建立大鼠溃疡性结肠炎模型[J].青海医学院学报,1999,20(4):1-3.
[6] Opavsky MA, Martino T, Rabinovitch M, et al. Enhanced ERK-1/2 activation in mice susceptible to coxsachievirus-induced myocarditis[J]. J Clin Invest, 2002,109(12):1561-1569.
[7] Lundberg S, Lindholm J, Lindbom L, et al. Integrinafa2β1Regulates Neutrophil Recruitment and Inflammatory Activity in Experimental Colitis in Mice[J]. Inflamm Bowel Dis, 2006,12(3):172-177.
[8] Mackay CR. T-cell memory: the connection between function, phenotype and migration pathways[J]. Immunol Today, 1991,12(6):189-192.
[9] Guri AJ, Hontecillas R, Bassaganya-Riera J. Abscisic acid ameliorates experimental IBD by downregulating cellular adhesion molecule expression and suppressing immune cell infiltration[J]. Clin Nutr, 2010,29(6):824-831.
10.3969/j.issn.1002-266X.2017.25.016
R574
B
1002-266X(2017)25-0051-03
2017-04-03)
