miR-145靶向抑制MMP-9表达对大鼠脑动脉血管平滑肌细胞增殖和迁移的影响
2017-08-09李文婷邹伟曹琳张平南华大学附属南华医院湖南衡阳421002
李文婷,邹伟,曹琳,张平(南华大学附属南华医院,湖南衡阳421002)
miR-145靶向抑制MMP-9表达对大鼠脑动脉血管平滑肌细胞增殖和迁移的影响
李文婷,邹伟,曹琳,张平
(南华大学附属南华医院,湖南衡阳421002)
目的 观察miR-145对大鼠脑动脉血管平滑肌细胞(VSMC)增殖和迁移的影响,并探讨其作用机制。方法 利用组织贴块法分离大鼠脑基底动脉VSMC,将细胞分为3组,对照组转染空载体;miR-145组转染miR-145;miR-145+MMP-9组转染miR-145后再转染MMP-9。采用qPCR方法检测各组MMP-9 mRNA表达,Western blotting法检测MMP-9蛋白表达。向三组细胞中加入50 ng/mL TNF-α刺激细胞增殖,采用CCK8法检测细胞增殖情况,Transwell小室检测细胞迁移能力。根据TargetScan和miRanda数据库预测,野生型MMP-9的3′-UTR区域含有miR-145靶向结合片段,采用双荧光素酶报告基因检测验证miR-145和MMP-9的靶向关系。结果 miR-145组MMP-9 mRNA和蛋白表达均低于对照组(P均<0.05),miR-145+MMP-9组MMP-9 mRNA和蛋白表达均高于miR-145组(P均<0.01)。加入TNF-α处理后,miR-145组的细胞增殖OD值低于对照组,miR-145+MMP-9组的细胞增殖OD值高于miR-145组(P均<0.01);miR-145组细胞迁移数低于对照组,miR-145+MMP-9组细胞迁移数高于miR-145组(P均<0.01)。双荧光素酶报告检测结果显示,miR-145能够抑制野生型MMP-9的荧光素酶活性(P<0.01),但不能抑制突变型MMP-9的荧光素酶活性。结论 miR-145能够通过下调MMP-9抑制TNF-α诱导的大鼠脑动脉VSMC增殖和迁移。
脑梗死;血管平滑肌细胞;微小RNA;miRNA-145;基质金属蛋白酶9;细胞增殖;细胞迁移
脑梗死的发病率、病死率和致残率均很高,严重影响人类的身体健康和生活质量[1]。在我国,超过30%的脑梗死是由颅内动脉粥样硬化性狭窄所致[2]。在动脉粥样硬化(AS)斑块形成的不同阶段,血管平滑肌细胞(VSMC)的结构和功能都发生异常改变[3],其释放的基质金属蛋白酶(MMP)是AS斑块形成和破裂的重要因子[4]。MMP-9作为MMP家族成员,不仅可以充分降解Ⅳ型胶原-细胞基底膜成分,而且能够促进炎症反应和VSMC增殖、迁移,导致AS斑块不稳定,从而形成血栓[5]。因此,探讨MMP-9在AS中的调节机制,对预防AS的发生发展具有重要意义。微小RNA(miRNA)是由21~22个核苷酸组成的非编码小RNA片段,通过与靶蛋白mRNA的3′-UTR结合发挥负向调控作用,参与细胞增殖、凋亡和分化的过程[6, 7]。肿瘤坏死因子TNF-α能够通过与受体TNFR结合,激活NF-κB、MAPK和JNK等多条信号通路,来调节炎症反应以及细胞增殖和转移。miR-145作为VSMC中含量最多的miRNA,能够通过KLF5和CD40及其下游信号因子来调节血管新生内膜病变形成[8, 9]。2016年6~12月,我们从大鼠脑基底动脉分离VSMC,转染miR-145和MMP-9,加入TNF-α刺激细胞增殖,观察细胞增殖和迁移能力的变化;并假设MiR-145靶向作用于MMP-9,对此假设进行验证。
1 材料与方法
1.1 材料 雄性SD大鼠2~3只,体质量150~250 g,购自上海斯莱克实验动物中心。20%胎牛血清(Bioind公司),DMEM培养液(Gibco公司),抗MMP-9抗体和山羊抗兔二抗(Goodhere生物公司),质粒DNA(上海吉玛制药公司合成空载体NC和miR-145 mimics;美国Invitrogen公司合成miR-145 mimics和pcDNA3.1+HA-MMP-9),脂质体2000(Invitrogen公司),双荧光素酶报告检测试剂盒(Promega生物技术公司),细胞增殖检测试剂盒(日本同仁公司),二氧化碳培养箱(美国Thermo公司),光学显微镜(美国Olympus公司),多功能酶标仪(美国Thermo公司),流式细胞仪(美国BD公司),荧光定量PCR仪(美国ABI公司)。
1.2 大鼠脑基底动脉VSMC的分离和原代培养 将大鼠腹腔注射50 mg/kg戊巴比妥钠麻醉,并放血处死。迅速取出整脑,解剖显微镜下分离大脑基底动脉。将基底动脉剪成0.5 mm×0.5 mm的组织块,置入细胞培养瓶中,加入含20%胎牛血清和1%青链霉素混合液的DMEM培养液,竖直放置于37 ℃、5% CO2培养箱内培养3~5 h。待组织块与瓶底贴附后,将培养瓶轻轻翻转平放,继续培养3 d。培养10 d左右观察到组织块周围的细胞相互融合且融合度达80%,即可进行传代,取3代后细胞用于进一步实验。
1.3 细胞分组与处理 将VSMC分为对照组(转染空载体)、miR-145组(转染miR-145)、miR-145+MMP-9组(转染miR-145后再转染MMP-9)共3组。将细胞接种于24孔板中,待细胞生长融合度达80%时进行转染。将质粒DNA与脂质体2000以1∶2.5的比例混合后加入到培养板中,6 h后更换为含10%胎牛血清和500 mg/mL G418的DMEM培养基,培养15 d左右观察转染效率,挑出克隆细胞进行鉴定和扩大培养。miR-145+MMP-9组先加入miR-145 mimics,筛选出稳定表达miR-145的细胞,再加入pcDNA3.1+HA-MMP-9,挑选共表达miR-145和MMP-9的细胞进行实验。
1.4 MMP-9 mRNA检测 采用qPCR方法。取三组细胞,TRIzol法提取细胞总RNA,逆转录合成cDNA。以β-actin为内参基因,设计并合成引物。引物序列:MMP-9上游5′-GATCATTCCTCAGTGCCGGA-3′,下游5′-TTCAGGGCGAGGACCATAGA-3′;β-actin上游5′-AGCGAGCATCCCCCAAAGTT-3′,下游5′-GGGCACGAAGGCTCATCATT-3′。qPCR反应条件:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,共40个循环。读取基因扩增的Ct值,采用2-ΔΔCt法计算MMP-9 mRNA的相对表达量。
1.5 MMP-9蛋白检测 采用Western blotting法。取三组细胞,加入细胞裂解液提取细胞总蛋白;BCA法测定蛋白浓度;聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白,分离胶浓度为10%;将蛋白质湿转到醋酸纤维素膜上,脱脂牛奶室温封闭2 h;加入一抗(1∶1 000稀释)4 ℃孵育过夜;二抗(辣根过氧化物标记的羊抗兔抗体)室温下孵育1 h;目的条带经ECL显色后在BIO-RAD荧光成像仪检测分析。Image Lab软件对蛋白条带进行半定量分析,以目标蛋白与β-actin的比值表示蛋白的相对表达量。
1.6 细胞增殖能力观察 采用CCK8法。取三组细胞,加入胰酶消化后制备单细胞悬液,以8×103/孔加入96孔板中。细胞贴壁后,分别加入50 ng/mL TNF-α刺激细胞增殖,培养72 h后加入10 μL CCK8试剂,检测各孔吸光度值。
1.7 细胞迁移能力观察 取三组细胞,分别加入50 ng/mL TNF-α培养48 h。取细胞铺在Transwell小室中,培养液换成不含血清的DMEM培养基,下室加入含20%胎牛血清的培养液。细胞在血清的吸引下向下室迁移。48 h后,4%多聚甲醛溶液固定小室下表面的细胞,并进行结晶紫染色,镜下观察迁移至小室下表面的细胞,随机选取5个视野进行计数。
1.8 miR-145对MMP-9的靶向作用观察 采用双荧光素酶报告实验。经过TargetScan和miRanda数据库预测,野生型MMP-9的3′-UTR区域含有miR-145靶向结合的片段(图1)。合成突变型MMP-9 3′-UTR质粒,插入pGL3空载体中。取VSMC接种于24孔板中,将野生型MMP-9 3′-UTR质粒(WT)、突变型MMP-9 3′-UTR质粒(MUT)与miR-145 mimics(WT miR-145组、MUT miR-145组)或空载体(WT对照组、MUT对照组)共转染。双荧光素酶报告检测试剂盒检测各组荧光素酶的活性。
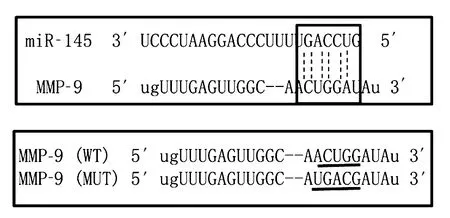
图1 野生型MMP-9的3′-UTR区域含有miR-145靶向结合片段

2 结果
2.1 三组MMP-9 mRNA及蛋白表达比较 对照组、miR-145组、miR-145+MMP-9组MMP-9 mRNA的相对表达量分别为1、0.42±0.23、1.24±0.23,MMP-9蛋白表达量分别为0.89±0.12、0.34±0.13、1.16±0.06。miR-145组MMP-9 mRNA和蛋白表达均低于对照组(P均<0.05),miR-145+MMP-9组MMP-9 mRNA和蛋白表达均高于miR-145组(P均<0.01)。
2.2 TNF-α处理后三组细胞增殖情况比较 对照组、miR-145组、miR-145+MMP-9组的细胞增殖OD值分别为2.32±0.15、1.84±0.18、2.37±0.11,miR-145组OD值低于对照组,miR-145+MMP-9组OD值高于miR-145组(P均<0.01)。
2.3 TNF-α处理后三组细胞迁移情况比较 对照组、miR-145组、miR-145+MMP-9组的迁移细胞数分别为(102±3)、(36±8)、(110±5)个,miR-145组细胞迁移数低于对照组,miR-145+MMP-9组细胞迁移数高于miR-145组(P均<0.01)。
2.4 miR-145对MMP-9 mRNA的靶向作用结果 WT对照组、WT miR-145组、MUT对照组、MUT miR-145组的荧光素酶相对活性分别为5.24±0.35、2.28±0.19、5.19±0.48、5.16±0.36。WT miR-145组的荧光素酶相对活性低于WT对照组(P<0.01),MUT miR-145组与MUT对照组比较无统计学差异(P>0.01)。
3 讨论
AS是一种炎症性疾病,其发生发展始终伴随着炎症反应[10]。miRNA通过转录后水平调节蛋白质的表达从而参与动脉粥样硬化的发生发展,内皮细胞和平滑肌细胞中miRNA的表达与AS斑块的形成密切相关[8]。血管内皮细胞的损伤与活化是AS的启动因素,活化后的内皮细胞分泌血管细胞黏附分子1,促使中性粒细胞渗入内皮细胞层。SPRED1是一种细胞内血管新生信号的抑制子,破坏内皮细胞的完整性[11]。miR-126能够靶向作用于血管细胞黏附分子1和SPRED1,当miR-126在内皮细胞中表达增高时,血管细胞黏附分子1和SPRED1表达下调,从而调控血管炎症[12, 13]。VSMC的增生和迁移也是AS斑块形成的重要因素。在miRNA与VSMC增生关系的研究中发现,当小鼠颈动脉管壁受损时,miR-221和miR-222表达上调;而在体外和活体小鼠颈动脉低表达miR-221和miR-222时,VSMC的增殖会受到抑制[14]。
研究表明,miR-145是血管壁及其新分离出来的VSMC上含量最为丰富的miRNA。miR-145的表达在血管新生内膜损伤时明显下降,而体外过表达miR-145会显著抑制VSMC的增殖和迁移[15]。冠状动脉疾病患者体内miR-145会发生显著变化,其在外周血中的表达水平与梗死灶面积相关,这表明miR-145在AS的研究中是很有价值的标志物,靶向调节miR-145对AS的治疗具有很好的应用前景。Cheng等[16]发现,miR-145可以作为VSMC的表面标记调节细胞的表型转化并参与细胞的功能调节,同时还通过KLF5、CD40等及下游信号分子参与血管新生内膜的损伤形成。
本研究从大鼠脑基底动脉中分离并鉴定VSMC,首先对该细胞进行miR-145转染,发现MMP-9 mRNA和蛋白表达均受到明显抑制,对稳定表达miR-145的VSMC继续转染MMP-9后,细胞中MMP-9 mRNA和蛋白表达升高。向三组细胞加入TNF-α刺激细胞增殖,结果显示对照组和miR-145+MMP-9组的细胞增殖和细胞迁移均高于对照组。表明miR-145能够减少VSMC内MMP-9表达,抑制由TNF-α诱导的细胞增殖和细胞迁移,而细胞内MMP-9的高表达又能够显著逆转miR-145的作用。在AS斑块形成过程中,VSMC释放的MMP是斑块形成和破裂的重要因子[4,17]。有研究显示,脂联素能够通过抑制MMP-9表达降低心脑血管的发生风险[18]。Guo等[19]在对新生内膜异常增生机制研究过程中发现,TNF-α可通过上调MMP-9表达而促进VSMC的迁移作用。另外,双荧光素酶报告基因检测结果显示,MMP-9 mRNA含有miR-145的作用靶点,miR-145能够显著抑制野生型MMP-9(WT)的荧光素酶活性,但不能抑制突变型MMP-9(MUT)的荧光素酶活性。进一步证实了miR-145很可能是通过下调MMP-9来抑制大鼠脑动脉血管平滑肌细胞的增殖和迁移。
综上所述,miR-145能够抑制VSMC中的MMP-9 mRNA和蛋白表达,降低TNF-α对VSMC的增殖和迁移诱导增加作用;对稳定转染miR-145的VSMC进行MMP-9转染后,MMP-9能够有效逆转miR-145对于TNF-α诱导的细胞增殖和迁移抑制作用;miR-145很可能是通过下调MMP-9来抑制VSMC的增殖和迁移。另外,miR-145对于靶基因MMP-9的具体调节机制还不清楚,仍需进一步探索。miR-145对于MMP-9的靶向调节关系为进一步研究miRNA对动脉粥样硬化的靶向治疗提供新的思路,同时为脑梗死的治疗带来新的希望。
[1] Bonita R, Mendis S, Truelsen T, et al. The global stroke initiative[J]. Lancet Neurol, 2004,3(7):391-393.
[2] Yu F, Lu J, Li Z, et al. Correlation of Plasma Vascular Endothelial Growth Factor and Endostatin Levels with Symptomatic Intra- and Extracranial Atherosclerotic Stenosis in a Chinese Han Population[J]. J Stroke Cerebrovasc Dis, 2017,26(5):1061-1070.
[3] Ross R. Atherosclerosis--an inflammatory disease[J]. N Engl J Med, 1999,340(2):115-126.
[4] Popovic S, Canovic F, Ilic M, et al. Matrix metalloproteinase-9 index as a possible parameter for predicting acute coronary syndrome in diabetics[J]. Vojnosanit Pregl, 2015,72(5):421-426.
[5] Kim HS, Kim HJ, Park KG, et al. Alpha-lipoic acid inhibits matrix metalloproteinase-9 expression by inhibiting NF-kappaB transcriptional activity[J]. Exp Mol Med, 2007,39(1):106-113.
[6] Paul P, Chakraborty A, Sarkar D, et al. Interplay between miRNAs and Human Diseases: A Review[J]. J Cell Physiol, 2017,232(10):617-624.
[7] Gu H, Liu Z, Zhou L. Roles of miR-17-92 Cluster in Cardiovascular Development and Common Diseases[J]. Bio Med Res Int, 2017,2017:9102909.
[8] Hutcheson R, Terry R, Chaplin J, et al. MicroRNA-145 restores contractile vascular smooth muscle phenotype and coronary collateral growth in the metabolic syndrome[J]. Arterioscler Thromb Vasc Biol, 2013,33(4):727-736.
[9] Shimizu C, Kim J, Stepanowsky P, et al. Differential expression of miR-145 in children with Kawasaki disease[J]. PLoS One, 2013,8(3):e58159.
[10] Guo X, Li D, Chen M, et al. miRNA-145 inhibits VSMC proliferation by targeting CD40[J]. Sci Rep, 2016,6:35302.
[11] Harris TA, Yamakuchi M, Kondo M, et al. Ets-1 and Ets-2 regulate the expression of microRNA-126 in endothelial cells[J]. Arterioscler Thromb Vasc Biol, 2010,30(10):1990-1997.
[12] Kar S, Bali KK, Baisantry A, et al. Genome-Wide Sequencing Reveals MicroRNAs Downregulated in Cerebral Cavernous Malformations[J]. J Mol Neurosci, 2017,61(2):178-188.
[13] Chu M, Wu R, Qin S, et al. Bone Marrow-Derived MicroRNA-223 Works as an Endocrine Genetic Signal in Vascular Endothelial Cells and Participates in Vascular Injury From Kawasaki Disease[J]. J Am Heart Assoc, 2017,6(2):e004878.
[14] Liu X, Cheng Y, Zhang S, et al. A necessary role of miR-221 and miR-222 in vascular smooth muscle cell proliferation and neointimal hyperplasia[J]. Circ Res, 2009,104(4):476-487.
[15] Ji R, Cheng Y, Yue J, et al. MicroRNA expression signature and antisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation[J]. Circ Res, 2007,100(11):1579-1588.
[16] Cheng Y, Liu X, Yang J, et al. MicroRNA-145, a novel smooth muscle cell phenotypic marker and modulator, controls vascular neointimal lesion formation[J]. Circ Res, 2009,105(2):158-166.
[17] Peeters W, Moll FL, Vink A, et al. Collagenase matrix metalloproteinase-8 expressed in atherosclerotic carotid plaques is associated with systemic cardiovascular outcome[J]. Eur Heart J, 2011,32(18):2314-2325.
[18] Ohashi K, Ouchi N, Matsuzawa Y. Anti-inflammatory and anti-atherogenic properties of adiponectin[J]. Biochimie, 2012,94(10):2137-2142.
[19] Guo L, Ning W, Tan Z, et al. Mechanism of matrix metalloproteinase axis-induced neointimal growth[J]. J Mol Cell Cardiol, 2014,66:116-125.
Effects of microRNA-145 on proliferation and migration of rat arterial vascular smooth muscle cells through targeting MMP-9
LIWenting,ZOUWei,CAOLin,ZHANGPing
(NanhuaHospitalAffiliatedtoUniversityofSouthChina,Hengyang421002,China)
Objective To observe the effects of microRNA-145 on proliferation and migration of rat arterial vascular smooth muscle cells (VSMC) and its mechanism.Methods The rat brain basilar arterial VSMC was isolated by tissue patch assay. Then the cells were divided into three groups: the control group (transfection with empty carrier), miR-145 group (transfection with miR-145 mimics), and miR-145+MMP-9 group (transfection with miR-145 mimics and MMP-9). The mRNA and protein expression of MMP-9 was detected by qPCR and Western blotting, respectively. We added 50 ng/mL TNF-α to stimulate the cell proliferation, which was then examined by CCK8 assay. Transwell chamber was used to detect the cell migration ability. TargetScan and miRNAda identified 3′-UTR of MMP-9 mRNA had the target sequence of miR-145 in VSMCs. Luciferase reporter gene was used to validate the correlation between miR-145 and MMP-9.Results The MMP-9 mRNA and protein expression of the miR-145 group was significantly lower than that of the control group (bothP<0.05), while the MMP-9 mRNA and protein expression in miR-145+MMP-9 group was higher than that of the miR-145 group (bothP<0.05). After TNF-α treatment, OD value of the miR-145 group was lower than that of the control group, and OD value in miR-145+MMP-9 group was higher than that of miR-145 group (bothP<0.05). Meanwhile, the miR-145 group had a significantly smaller number of migration cells than the control group, while the migration cells in miR-145+MMP-9 group were more than those of the miR-145 group (bothP<0.01). Luciferase reporter revealed that miR-145 inhibited the relative luciferase activity of wild type MMP-9, but did not inhibit the mutant MMP-9.Conclusion MiR-145 inhibits the proliferation and migration of rat basilar arterial VSMC through down-regulating MMP-9.
cerebral infarction; vascular smooth muscle cell; microRNA; miR-145; matrix metalloproteinase 9; cell proliferation; cell migration
湖南省医药卫生科研计划项目(C2016087)。
李文婷(1983-),女,主治医师,主要研究方向为脑血管疾病及神经退行性疾病。E-mail: liwentinghnhy@163.com
10.3969/j.issn.1002-266X.2017.26.007
R743.3
A
1002-266X(2017)26-0025-04
2017-02-19)
