硒蛋白Se-76P对STZ诱导的小鼠糖尿病肾病模型肾功能及生化指标的影响
2017-08-09田福俊魏子敬吉林医药学院检验学院免疫技术教研室吉林吉林303吉林医药学院临床医学院医学影像系吉林吉林303吉林医药学院基础医学院生物化学教研室吉林吉林303
李 强,田福俊,魏子敬,葛 鑫,胡 超,王 程(.吉林医药学院检验学院免疫技术教研室,吉林吉林 303; .吉林医药学院临床医学院医学影像系,吉林吉林 303; 3.吉林医药学院基础医学院生物化学教研室,吉林吉林 303)
硒蛋白Se-76P对STZ诱导的小鼠糖尿病肾病模型肾功能及生化指标的影响
李 强1,田福俊2,魏子敬2,葛 鑫2,胡 超2,王 程3,*
(1.吉林医药学院检验学院免疫技术教研室,吉林吉林 132013; 2.吉林医药学院临床医学院医学影像系,吉林吉林 132013; 3.吉林医药学院基础医学院生物化学教研室,吉林吉林 132013)
研究含硒蛋白(Se-76P)对链脲佐菌素(STZ)诱导的小鼠糖尿病肾病的保护作用。C57BL/6J雄性小鼠腹腔注射STZ(40 mg/kg)制备糖尿病肾病模型,将60只小鼠分为六组,正常对照组(Ⅰ组)、糖尿病肾病模型组(Ⅱ组)、模型+Se-76P低剂量组(Ⅲ组)、模型+Se-76P中剂量组(Ⅳ组)、模型+Se-76P高剂量组(Ⅴ组)和模型+胰岛素治疗组(Ⅵ组)。各组小鼠均采用皮下注射方式给药,Ⅰ组和Ⅱ组给予生理盐水;Ⅲ、Ⅳ、Ⅴ组分别给予低(20 μmol/kg)、中(40 μmol/kg)、高(60 μmol/kg)浓度Se-76P蛋白;Ⅵ组给予5 U/kg·d胰岛素。各组连续给药4周,每周测量小鼠体重;实验结束后检测各组小鼠空腹血糖、血清肌酐(SCr)和尿素氮(BUN)水平;检测各组小鼠尿肌酐(UCr)和尿微量白蛋白(MAU)水平,并计算肌酐清除率(CCr);检测肾组织丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)水平。与模型组相比,Se-76P各治疗组空腹血糖值均降低;SCr、BUN、UCr、MAU水平以及CCr均显著降低(p<0.01或0.05);肾组织中MDA水平明显降低(p<0.01),而SOD和GPx活性明显升高(p<0.01或0.05)。Se-76P可能通过提高SOD和GPx活性,提升抗氧化水平,改善STZ诱导的糖尿病肾病小鼠模型的肾功能。
硒蛋白,Se-76P,链脲佐菌素,糖尿病肾病
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病主要并发症之一,可引起终末期肾病(end stage kidney disease,ESKD),严重威胁患者生命。目前的治疗主要依赖早期诊断、血糖控制以及通过抑制肾素-血管紧张素系统严格控制血压等,但由于DKD的发病机制较为复杂,涉及血流动力学改变、体内代谢、氧化应激、炎症反应等很多环节,一旦发展成为ESKD则很难治疗。虽然近年来对DKD的病理生理学机制的研究有了很大进展,但是仍然没有较为有效的治疗方法。研究表明,氧化应激导致的脂质和蛋白质的过氧化,在糖尿病开始后的早期就表现出来[1],因此早期控制糖尿病患者的氧化应激损伤可能是DKD预防和治疗的关键。
人体内存在着酶抗氧化系统和非酶抗氧化系统,可以对抗氧化应激损伤,酶抗氧化系统包括超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)等,非酶抗氧化系统包括维生素C、维生素E、谷胱甘肽以及微量元素铜、锌、硒等。硒是人体必需的微量元素之一,大量研究表明,体内硒元素水平与糖尿病的发生和程度密切相关[2-3]。硒元素在体内主要以硒代半胱氨酸(SeCys)形式存在于各种硒蛋白中,如GPx就是一种含硒蛋白。早期研究发现多种硒蛋白具有类胰岛素功能[4],其降低血糖的作用可能与抑制促炎细胞因子及活性氧和活性氮的增加有关[5]。
含硒76肽(Se-76P)是一种SOD和GPx双酶活性中心的含硒多肽,同时具有很强的SOD和GPx活性,可以发挥很好的抗氧化作用[6]。前期研究表明,Se-76P能通过减少线粒体的氧化损伤,保护肝细胞[7]。目前尚没有Se-76P对肾脏保护作用的研究报道,本文将通过链脲佐菌素(streptozocin,STZ)诱导的DKD小鼠模型,研究Se-76P对DKD的保护作用及可能的作用机制。
1 材料与方法
1.1 材料与仪器
C57BL/6J小鼠 雄性,SPF级,8~12周龄,由长春市亿斯实验动物技术有限公司提供,动物许可证号:SCXK(吉)2011-0004;硒蛋白(Se-76P) 由本课题组表达并纯化;STZ(货号:S0130) 美国Sigma公司;柠檬酸、柠檬酸钠 上海实验试剂有限公司;诺和灵N注射液 丹麦诺和诺德公司;肌酐(creatinine,Cr)检测试剂盒、尿素氮(blood urea nitrogen,BUN)检测试剂盒、SOD检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、GPx检测试剂盒、尿微量白蛋白(microalbuminuria,MAU)定量检测试剂盒 南京建成生物工程研究所有限公司。
Model 550型酶标仪 美国Bio-rad公司产品;TD4型台式低速离心机 湘仪离心机仪器有限公司产品;SSW-420-2S型电热恒温水槽 上海博迅实业有限公司产品;BS124S型分析天平 北京赛多利斯仪器系统有限公司产品;AU480型全自动生化分析仪 贝克曼库尔特商贸有限公司产品;GA-3三诺血糖仪 三诺生物传感股份有限公司产品。
1.2 实验分组及给药
1.2.1 实验分组 60只C57BL/6J雄性小鼠分为6组,分别为正常对照组(Ⅰ组)、糖尿病肾病模型组(Ⅱ组)、模型+Se-76P低剂量组(Ⅲ组)、模型+Se-76P中剂量组(Ⅳ组)、模型+Se-76P高剂量组(Ⅴ组)和模型+胰岛素治疗组(Ⅵ组)。
1.2.2 试剂配制 pH4.5的柠檬酸缓冲液配制:A液(柠檬酸2.1 g 加入双蒸水100 mL),B 液(柠檬酸钠2.94 g 加入双蒸水100 mL),用时A液和B液1∶1混合,调pH至4.5。STZ的配制:STZ用pH4.5的柠檬酸缓冲液配成50 mmol/L的浓度[8]。Se-76P的配制:分别取0.3、0.6和0.9 g的Se-76P蛋白溶于10 mL双蒸水中,配成20、40和60 μmol/kg 三个浓度。胰岛素配制:用生理盐水配成0.5 U/mL。
1.2.3 糖尿病肾病模型建立 实验前适应环境5 d,实验第1 d,注射STZ前4 h,禁食不禁水,按40 mg/kg浓度腹腔注射STZ(每组现用现配)连续5 d,期间饮用10%蔗糖水。实验第6 d,恢复为正常水(不用蔗糖水)。实验第7 w,以上述给予STZ方法再次强化糖尿病模型(此次不给予蔗糖水),以维持STZ处理模型的高血糖。超过50%小鼠空腹血糖值>300~600 mg/dL(16.7~33.3 mmol/L)可判定为重度高血糖,成功获得糖尿病肾病模型[9]。
1.2.4 实验给药 将造模成功小鼠随机分入Ⅱ~Ⅵ组中,每组10只。各组小鼠均采用皮下注射方式给药。Ⅰ组和Ⅱ组给予生理盐水;Ⅲ、Ⅳ、Ⅴ组分别给予低(20 μmol/kg)、中(40 μmol/kg)、高(60 μmol/kg)浓度Se-76P,每日1次;Ⅵ组给予5 U/kg·d胰岛素,每日2次,各组连续给药4 w,期间监测血糖和小鼠状态。所有实验动物末次给药后,禁食不禁水12 h后,10%水合氯醛(4 mL/kg)麻醉,眼球取血,取肾组织。
1.3 小鼠体重变化
实验期间按100 g/kg·d定量喂食,每周记录体重,实验结束后比较各组小鼠体重变化。
1.4 血清指标检测
实验结束后,小鼠眼球取血,3000 r/min离心5 min分离血清,测定空腹血糖值;试剂盒测定血清BUN和血清肌酐(serum creatinine,SCr)水平。
1.5 尿液指标检测
实验结束前,代谢笼中留取24 h尿液,试剂盒测定MAU和尿肌酐(urine creatinine,UCr)水平,并计算小鼠的肌酐清除率(creatinine clearance,CCr),CCr=UCr×[24 h尿量/(24 h×60 min)]/SCr/体重。
1.6 组织生化指标检测
取肾组织称重,按照1∶9比例加入的生理盐水稀释,4 ℃下将组织研磨成10%的匀浆组织,2500 r/min离心10 min,取上清液,试剂盒测定肾组织匀浆中SOD、MDA、GPx水平。
1.7 统计分析
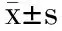
2 结果与分析
2.1 体重变化
体重减轻是糖尿病常见症状,在较长时间内,监测糖尿病模型小鼠体重改变,可以在一定程度上反映药物对糖尿病模型小鼠的治疗效果。结果显示,与Ⅰ组相比,Ⅱ组小鼠体重在实验第1 w和第2 w无明显改变,而在第3 w和第4 w明显降低(p<0.01或0.05);与Ⅱ组相比,Ⅲ组和Ⅵ组小鼠体重在实验第3 w和第4 w明显增加(p<0.01或0.05),而其他组无明显差异(见图1)。表明正常组小鼠体重随时间延长而增加,而糖尿病肾病模型组小鼠体重随时间延长增加不明显,3 w开始体重增长明显低于正常组小鼠,而注射Se-76P后,各剂量组小鼠体重随时间延长而明显增加,并在4 w左右开始,接近正常组小鼠,提示Se-76P能够改善糖尿病肾病小鼠的体重。

图1 各组小鼠体重改变Fig.1 Body weight changes in each group(n=10,±s)注:与正常组比较#p<0.05,##p<0.01;与模型组比较*p<0.05,**p<0.01;图2、表1~表3同。
2.2 空腹血糖、SCr和BUN水平比较
结果显示,与Ⅰ组相比,Ⅱ组空腹血糖值明显增高(p<0.01);与Ⅱ组相比,Ⅲ组、Ⅳ组和Ⅵ组小鼠空腹血糖值明显降低(p<0.01或0.05),而Ⅴ组虽然也降低,但无明显差异(见图2)。表明糖尿病肾病模型组小鼠空腹血糖值明显高于正常组,而胰岛素治疗组空腹血糖值明显低于模型组,Se-76P各剂量治疗组中,低剂量组对空腹血糖的降低作用最为明显,高剂量组虽然也显示出降低空腹血糖的作用,但与模型组相比没有明显统计学差异,结果提示,Se-76P具有降低血糖的作用。

图2 各组小鼠血糖改变Fig.2 Blood glucose changes in each group(n=10,±s)
研究表明血清中硒水平与糖尿病程度有相关性[10],2型糖尿病患者每天补充200 μg硒,可以明显降低血清胰岛素水平[11],人体硒的水平可以作为高血压病人2型糖尿病早期预测标志物[12]。硒的降血糖机制可能与其胰岛素样作用相关,研究发现硒能够通过Akt的激活以及p70 S6激酶等其他胰岛素信号级联激酶的激活产生胰岛素样作用[13],此外硒还可以抑制肠葡萄糖的转运,加速肾糖排泄[14]。硒的降血糖作用也与其抗氧化作用有关,无论是有机还是无机的硒化合物都已经显示出能通过减少氧化应激改善糖尿病的作用。但需要指出的是,并不是体内硒的剂量越高,降血糖效果越好,在一些研究中也显示,体内硒的水平过高,反而可能与糖尿病风险的增加有相关性[3]。
SCr和BUN都是肾功能改变的重要指标[15],结果显示,与Ⅰ组相比,Ⅱ组SCr和BUN均明显升高(p<0.05),与Ⅱ组相比,Ⅲ组、Ⅳ组和Ⅵ组SCr和BUN水平显著降低(p<0.01或0.05),而Ⅴ组虽然也降低,但无明显差异(见表1),表明Se-76P各剂量治疗组都在一定程度上,改善了降低了糖尿病肾病模型组小鼠的SCr和BUN水平。

表1 各组SCr和BUN水平比较Table 1 Comparison of levels of SCr and BUN
高血糖状态下,增加的多元醇通路和蛋白激酶C的激活诱发了ROS的大量产生[16],ROS可使肾细胞DNA、蛋白、脂质等损伤,进而引起肾细胞功能改变,最终导致肾功能损伤[17]。抗氧化物能够中和ROS,有效的阻止实验诱导的糖尿病的发生,也能减少糖尿病肾病的损伤程度[18]。上述实验结果提示,Se-76P对改善肾功能有明显作用。
2.3 尿MAU、UCr和CCr水平比较
尿MAU及CCr是反映肾功能的最直接和最重要的两个指标[15],糖尿病肾病时尿MAU升高,而CCr在糖尿病肾病早期升高,晚期降低。实验结果显示,与Ⅰ组相比,Ⅱ组MAU、UCr和CCr均明显升高(p<0.01),与Ⅱ组相比,Ⅲ组、Ⅳ组和Ⅵ组MAU、UCr和CCr水平显著降低(p<0.01或0.05),而Ⅴ组虽然也降低,但无明显差异(见表2)。表明糖尿病肾病模型组小鼠表现出肾功能失调,而Se-76P各剂量组都可以改善糖尿病肾病模型组小鼠的尿MAU和CCr,提示Se-76P可以改善糖尿病肾病小鼠的肾功能。

表2 各组尿液中MAU、UCr及CCr的比较Table 2 Comparison of levels of MAU,UCr and CCr
2.4 肾组织SOD、MDA及GPx水平比较
糖尿病肾病的发生机制较为复杂,但多种机制都与氧化应激损伤密切相关[19-21]。SOD、MDA和GPx等都是反应机体氧化应激水平的重要标志。肾组织中SOD、MDA和GPx的检测结果显示,与Ⅰ组相比,Ⅱ组SOD和GPx均明显降低(p<0.05),而MDA水平明显升高(p<0.01);与Ⅱ组相比,Ⅲ组、Ⅳ组、Ⅴ组和Ⅵ组SOD和GPx水平均显著升高(p<0.01或0.05),而MDA水平则显著降低(p<0.01或0.05)(见表3)。结果表明,糖尿病肾病模型小鼠的抗氧化指标SOD和GPx均明显下降,而氧化损伤指标MDA水平升高,而Se-76P各剂量组都可以明显的降低MDA水平,提高SOD和GPx水平,提示Se-76P可以通过抗氧化作用改善肾功能。

表3 各组肾组织SOD、MDA及GPx水平的比较Table 3 Comparison of levels of SOD,MDA and GPx in each group(n=10,±s)
研究表明,各种有机硒和无机硒都可以通过抗氧化作用改善糖尿病肾病的肾损伤程度。如亚硒酸钠不仅能够保护糖尿病诱导的氧化损伤[22],也能保护STZ诱导的大鼠的肾损伤[23];依布硒啉可以清除自由基,减轻糖尿病肾病小鼠的肾损伤[24];纳米硒不仅能够降低血糖,而且具有抗氧化作用,对STZ诱导的大鼠糖尿病肾病具有很好的保护作用[25],而这种抗氧化作用可能与Bax和Bcl-2的调控相关[26]。
体内的抗氧化酶GPx是一种硒蛋白,对保护细胞的氧化损伤具有重要的作用[27],糖尿病患者血清中硒的水平与GPx的抗ROS活性程度相关[28]。本实验中使用的含硒76肽(Se-76P),是一种具有SOD和GPx双酶活性中心的含硒多肽,同时具有很强的SOD和GPx活性。前期研究表明,Se-76P能通过减少线粒体的氧化损伤,而降低ROS、MDA、LDH、AST产生,从而保护肝细胞,这种作用可能与凋亡相关基因(Bad、Bax、Bcl-xL和Bcl-2)以及凋亡相关蛋白(caspase3和PARP)的调控相关[7]。因此有理由相信,Se-76P的改善肾损伤的抗氧化机制可能与上述凋亡基因或凋亡相关蛋白相关,具体机制仍需进一步研究。
3 结论
本实验中模型组的SCr、UCr、BUN和MAU均较正常组明显升高,提示模型组出现了肾功能失调,而Se-76P作用后,各剂量组均一定程度地降低了SCr、UCr、BUN和MAU水平,表明Se-76P对糖尿病肾病模型小鼠肾功能具有一定程度的改善作用。模型组小鼠肾组织中MDA升高,SOD和GPx均降低,表明模型组小鼠肾组织存在氧化应激损伤,抗氧化酶保护作用降低,而Se-76P作用后,SOD和GPx活性均显著提高,MDA水平下降,表明Se-76P的抗氧化作用一定程度上改善了小鼠肾组织的氧化应激损伤。本实验结果提示,Se-76P对糖尿病诱导的肾的生化改变具有改善作用,能降低糖尿病肾病发病风险,这种保护作用可能与Se-76P的抗氧化作用有关,但是Se-76P长期应用后可能的毒性作用以及具体的作用机制需要进一步研究。
[1]Shrilatha B,Muralidhara. Early oxidative stress in testis and epididymal sperm in streptozotocin-induced diabetic mice:its progression and genotoxic consequences[J]. Reprod Toxicol,2007,23(4):578-587.
[2]Kong FJ,Ma LL,Chen SP,et al. Serum selenium level and gestational diabetes mellitus:a systematic review and meta-analysis[J]. Nutr J,2016,15(1):94.
[3]Lu CW,Chang HH,Yang KC,et al. High serum selenium levels are associated with increased risk for diabetes mellitus independent of central obesity and insulin resistance[J]. BMJ Open Diabetes Res Care,2016,4(1):e000253.
[4]Hwang D,Seo S,Kim Y,et al. Selenium acts as an insulin-like molecule for the down-regulation of diabetic symptoms via endoplasmic reticulum stress and insulin signalling proteins in diabetes-induced non-obese diabetic mice[J]. J Biosci,2007,32(4):723-735.
[5]Zeng J,Zhou J,Huang K. Effect of selenium on pancreatic proinflammatory cytokines in streptozotocin-induced diabetic mice[J]. J Nutr Biochem,2009,20(7):530-536.
[6]Yan F,Yan G,Lv S,et al. A novel 65-mer peptide imitates the synergism of superoxide dismutase and glutathione peroxidase[J]. Int J Biochem Cell Biol,2011,43(12):1802-1811.
[7]Wang C,Shen N,Yan GL,et al. The protective effect of a metallic selenopeptide with superoxide dismutase and glutathione peroxidase activities against alcohol induced injury in hepatic L02 cells[J]. Int J Pept Res Ther,2014,20(3):307-324.
[8]Furman BL. Streptozotocin-Induced Diabetic Models in Mice and Rats[J]. Curr Protoc Pharmacol,2015,70:5.47.1-5.47.20.
[9]Chow BS,Allen TJ. Mouse Models for Studying Diabetic Nephropathy[J]. Curr Protoc Mouse Biol,2015,5(2):85-94.
[10]Wang XL,Yang TB,Wei J,et al. Association between serum selenium level and type 2 diabetes mellitus:a non-linear dose-response meta-analysis of observational studies[J]. Nutr J,2016,15(1):48.
[11]Farrokhian A,Bahmani F,Taghizadeh M,et al. Selenium Supplementation Affects Insulin Resistance and Serum hs-CRP in Patients with Type 2 Diabetes and Coronary Heart Disease[J]. Horm Metab Res,2016,48(4):263-268.
[12]Gouaref I,Bellahsene Z,Zekri S,et al. The link between trace elements and metabolic syndrome/oxidative stress in essential hypertension with or without type 2 diabetes[J]. Ann Biol Clin,2016,74(2):233-243.
[13]Steinbrenner H,Speckmann B,Pinto A,et al. High selenium intake and increased diabetes risk:experimental evidence for interplay between selenium and carbohydrate metabolism[J]. J Clin Biochem Nutr,2011,48(1):40-45.
[14]Becker DJ,Reul B,Ozcelikay AT,et al. Oral selenate improves glucose homeostasis and partly reverses abnormal expression of liver glycolytic and gluconeogenic enzymes in diabetic rats[J]. Diabetologia,1996,39(1):3-11.
[15]Nabi SA,Kasetti RB,Sirasanagandla S,et al. Antidiabetic and antihyperlipidemic activity of Piper longum root aqueous extract in STZ induced diabetic rats[J]. BMC Complement Altern Med,2013,13:37.
[16]Kanwar YS,Wada J,Sun L,et al. Diabetic nephropathy:mechanisms of renal disease progression[J]. Exp Biol Med(Maywood),2008,233(1):4-11.
[17]Jiang T,Huang Z,Lin Y,et al. The protective role of Nrf2 in streptozotocin-induced diabetic nephropathy[J]. Diabetes,2010,59(4):850-860.
[18]Wang GG,Lu XH,Li W,et al. Protective Effects of Luteolin on Diabetic Nephropathy in STZ-Induced Diabetic Rats[J]. Evid Based Complement Alternat Med,2011,2011:323171.
[19]Bhor VM,Raghuram N,Sivakami S. Oxidative damage and altered antioxidant enzyme activities in the small intestine of streptozotocin-induced diabetic rats[J]. Int J Biochem Cell Biol,2004,36(1):89-97.
[20]Giacco F,Brownlee M. Oxidative stress and diabetic complications[J]. Circ Res,2010,107(9):1058-1070.
[21]Kashihara N,Haruna Y,Kondeti VK,et al. Oxidative stress in diabetic nephropathy[J]. Curr Med Chem,2010,17(34):4256-4269.
[22]Ayaz M,Celik HA,Aydin HH,et al. Sodium selenite protects against diabetes-induced alterations in the antioxidant defense system of the liver[J]. Diabetes Metab Res Rev,2006,22(4):295-299.
[23]Roy S,Dontamalla SK,Mondru AK,et al. Downregulation of apoptosis and modulation of TGF-β1 by sodium selenate prevents streptozotocin-induced diabetic rat renal impairment[J]. Biol Trace Elem Res,2011,139(1):55-71.
[24]Tan SM,Sharma A,Yuen DY,et al. The modified selenenyl amide,M-hydroxy ebselen,attenuates diabetic nephropathy and diabetes-associated atherosclerosis in ApoE/GPx1 double knockout mice[J]. PLoS One,2013,8(7):e69193.
[25]Kumar GS,Kulkarni A,Khurana A,et al. Selenium nanoparticles involve HSP-70 and SIRT1 in preventing the progression of type 1 diabetic nephropathy[J]. Chem Biol Interact,2014,223:125-133.
[26]Dkhil MA,Zrieq R,Al-Quraishy S,et al. Selenium Nanoparticles Attenuate Oxidative Stress and Testicular Damage in Streptozotocin-Induced Diabetic Rats[J]. Molecules,2016,21(11):1517.
[27]Naziroglu M,Cay M. Protective role of intraperitoneally administered vitamin E and selenium on the antioxidative defense mechanisms in rats with diabetes induced by streptozotocin[J]. Biol Trace Elem Res,2001,79(2):149-159.
[28]Gonzalez de Vega R,Fernandez-Sanchez ML,Fernandez JC,et al. Selenium levels and Glutathione peroxidase activity in the plasma of patients with type II diabetes mellitus[J]. J Trace Elem Med Biol,2016,37:44-49.
Effect of selenium Se-76P on STZ-induced renal function
and biochemical indexes in mice with diabetic nephropathy
LI Qiang1,TIAN Fu-jun2,WEI Zi-jing2,GE Xin2,HU Chao2,WANG Cheng3,*
(1.Department of Immune Technology,Laboratory Medical College of Jilin Medical University,Jilin 132013,China; 2.Department of Medical Imaging,Clinical Medical Sciences College of Jilin Medical University,Jilin 132013,China; 3.Department of Biochemistry,Basic Medical Sciences College of Jilin Medical University,Jilin 132013,China)
To explore the role and mechanism of selenium protein(Se-76P)on streptozocin-induced diabeticnephropathy in mice. Diabetic nephropathy model were prepared with streptozocin(40 mg/kg)by intraperitoneal injection in male C57BL/6J male mice. 60 mice were divided into six groups,normal control group(group Ⅰ),model of diabetic nephropathy group(group Ⅱ),model+low-dose Se-76P group(group Ⅲ),model+middle-dose Se-76P group(group Ⅳ),model+high dose Se-76P group(group Ⅴ)and insulin treatment group(group Ⅵ). Both groups of mice were administrated by subcutaneous injection way,group Ⅰ and group Ⅱ was given saline,group Ⅲ,Ⅳ and Ⅴwere given low(20 μmol/kg),middle(40 μmol/kg)and high(60 μmol/kg)concentration of Se-76P protein,group Ⅵ was given insulin,5 U/kg·d. All groups were treated for 4 weeks,and body weights were measured every week. After the experiment,blood glucose,serum creatinine(SCr)and urea nitrogen(BUN)levels were measured in serum. The urine creatinine(UCr)and microalbuminuria(MAU)levels were detected and the creatinine clearance(CCr)was calculated,renal tissue malondialdehyde(MDA),superoxide dismutase(SOD)and glutathione peroxidase(GPx)levels were also detected. Compared with model group,fasting blood sugar were decreased in Se-76P administrated groups,the levels of SCr,BUN,UCr,MAU and CCr were significantly decreased(p<0.01 or 0.05). The MDA level was decreased in kidney tissues significantly(p<0.01),SOD and GPx activity were increased significantly(p<0.01 orp<0.05). Se-76P may improve renal function in STZ-induced diabetic nephropathy mice by increasing SOD and GPx activities,enhancing antioxidant levels.
selenoprotein;Se-76P;streptozocin;diabetic kidney disease
2016-12-12
李强(1979-),男,博士研究生,讲师,研究方向:炎症机制,E-mail:liq1126@126.com。
*通讯作者:王程(1979-),男,博士研究生,副教授,研究方向:分子模拟酶,E-mail:wangcheng10@mails.jlu.edu.cn。
吉林省科技厅自然科学基金项目(20150101131JC);吉林省教育厅“十二五”科学技术研究项目(吉教合字2015-405);吉林省卫生厅科技计划基金资助项目(2013ZC015)。
TS201.4
A
1002-0306(2017)14-0280-05
10.13386/j.issn1002-0306.2017.14.055
