番木瓜籽蛋白质的提取工艺及其功能性质
2017-08-09王标诗曾亿均胡小军彭元怀岭南师范学院化学化工学院广东湛江524048
王标诗,曾亿均,娄 孟,江 敏,胡小军,彭元怀,杨 娟(岭南师范学院化学化工学院,广东湛江 524048)
番木瓜籽蛋白质的提取工艺及其功能性质
王标诗,曾亿均,娄 孟,江 敏,胡小军,彭元怀,杨 娟
(岭南师范学院化学化工学院,广东湛江 524048)
以番木瓜籽为原料,经脱脂以酸沉碱溶法提取其中的蛋白质,并研究其乳化、起泡等功能性质。结果表明,最佳的提取工艺条件:料液比1∶40,pH为9.3,温度50 ℃,碱提时间120 min时最高提取率达到48.53%。番木瓜籽蛋白质的乳化性及稳定性随着蛋白质的浓度升高而升高,在pH3时最小,其乳化性在NaCl浓度为0.2%时最大,而稳定性呈下降趋势;起泡性及稳定性随蛋白浓度升高而升高,在pH3.0,其起泡性和泡沫稳定性最小,在离子浓度(NaCl)为0.2 mol/L时,其起泡性和泡沫稳定性最高。可见,此提取工艺效果较好,能将部分番木瓜籽蛋白质提取出来;番木瓜籽分离蛋白质乳化性和起泡性良好,这为番木瓜籽蛋白质的开发利用提供参考依据。
番木瓜籽,蛋白质,提取,乳化性,起泡性
番木瓜(CaricapapayaL.),属番木瓜科,番木瓜属,又名木瓜、万寿果等。番木瓜在热带、亚热带地区种植较多。在我国主要分布在广东、海南、广西等南方地区。成熟的番木瓜,营养十分丰富,具有助消化、治疗胃病等多种作用[1]。番木瓜既可以鲜食,又可以加工成相关番木瓜产品如果酱和果汁等[2-5]。番木瓜中含有丰富的木瓜蛋白酶,是生产木瓜蛋白酶的主要原料,木瓜蛋白酶在医药、食品、制革及美容等行业有广泛应用[6]。
番木瓜籽是番木瓜鲜食或加工成产品后的副产物,往往将其作为废弃垃圾扔掉,这样不仅污染环境,而且浪费资源。据研究报道[7-8],番木瓜籽提取物具有多种生理功能,如木瓜籽中含有丰富的三萜类化合物,具有一定的免疫活性;木瓜籽的乙醇提取物具有明显的镇痛和抗感染作用;李文钊等[9]通过单因素实验和Box-Behnken实验设计响应面分析对番木瓜籽中硫代葡萄糖苷(硫苷)的酶解条件进行优化;研究表明[10]异硫氰酸酯类物质具有降低某些癌症发生的作用;李幼梅等[11]对番木瓜籽中抗氧化成分进行了研究;袁竹连[12]采用超声波辅助提取法提取番木瓜籽多酚,通过单因素和正交实验确定番木瓜籽多酚的最佳提取条件。除上述成分外,番木瓜籽中还含有丰富的油脂。番木瓜籽油脂属于植物油,其中的必需脂肪酸油酸的含量高,其营养含量指标符合食用植物油的要求。文献[13-18]报道了有机溶剂法、超临界萃取技术、超声波技术和水酶法等对番木瓜籽油的提取效果、理化性质及影响因素等。
此外,番木瓜籽中还含有一定量的蛋白质,是植物蛋白质的良好来源,但是目前对于番木瓜籽中的蛋白质的研究鲜有报道。为此,本论文以番木瓜籽为研究对象,研究了番木瓜籽中蛋白质的提取工艺条件,并对提取的蛋白质进行乳化性和起泡性等功能性质研究,以期为番木瓜的综合开发高值化利用提供新的途径。对番木瓜籽的高值化综合开发利用,不仅有利于解决废弃物造成的环境污染问题,还将带来良好的经济效益和社会效益。
1 材料与方法
1.1 材料与仪器
番木瓜(九成熟) 购于当地市场;考马斯亮蓝G-250、牛血清蛋白 均购自专业生化试剂供应商;其他化学试剂 均为分析纯。
FA2104N-电子天平、PHS-3C精密酸度计 上海雷磁仪器厂;HH-4数显恒温水浴锅 常州国华有限公司;DHG-9240电热恒温鼓风干燥箱 上海精宏实验设备有限公司;SXT-0索式提取器 上海洪纪一仪器设备有限公司;料理机 山东九阳股份有限公司;V-1100D型可见光分光光度计 上海美谱仪器有限公司;冰箱 青岛海尔股份有限公司;KDN-103F自动定氮仪 上海纤检仪器有限公司;HC-3518高速离心机 安徽中科中佳科学仪器有限公司;SHZ-D(III)型循环水式真空泵 巩义市英峪仪器厂。
1.2 实验方法
1.2.1 番木瓜籽蛋白质提取工艺及提取率的测定 番木瓜籽(干燥)→粉碎→60目过筛→石油醚脱脂→一定温度,一定pH水浴浸提→离心分离→上清液→调pH到等电点→分离沉淀→干燥→蛋白质成品。
工艺要点:将番木瓜籽洗净,50 ℃烘干。用粉碎机粉碎并60目过筛。再用沸程30~60 ℃的石油醚进行脱脂处理,抽提10 h后样品50 ℃烘干备用。准确称取1.0 g脂肪木瓜籽粉,加入蒸馏水,用浓度为5%的NaOH溶液调节其pH9.3,在料液比1∶30、温度50 ℃、时间150 min条件下提取后离心收集上清液,用5%稀盐酸调到pH3.3后静置24 h,抽滤,沉淀物水洗至中性,50 ℃恒温下干燥得番木瓜籽分离蛋白成品。
蛋白质的提取率(%)=提取液中蛋白质质量×100/番木瓜籽中蛋白质总质量。
1.2.2 番木瓜籽蛋白质含量的测定 蛋白质测定:凯式定氮法,参考GB 5009.5-2010。
1.2.3 可溶性蛋白质的测定 采用考马斯亮蓝法测定[19]。
1.2.4 番木瓜籽蛋白质等电点的测定 参考李剑玄[20]方法。称取番木瓜籽粉20 g,加200 mL蒸馏水浸泡,并用5%的NaOH调节蒸馏水pH至9.3,磁力搅拌20 min后,用4000 r·min-1离心20 min,沉渣再加200 mL蒸馏水调节pH至11,磁力搅拌20 min后,4000 r·min-1离心20 min,然后合并两次离心的上清液。分别取上清液20 mL,用10%盐酸调节pH从2.1到4.8间隔0.3,4000 r·min-1离心沉淀20 min后将上清液定容至50 mL,采用考马斯亮蓝法测出各上清液蛋白质浓度。
1.2.5 番木瓜籽蛋白提取的单因素实验
1.2.5.1 碱提pH对番木瓜籽蛋白质提取率的影响 在料液比1∶30,碱提温度50 ℃,碱提时间60 min不变的情况下,分别考察在pH为8.2、9.2、10.2、11.2、12.2的条件下番木瓜籽蛋白质的提取率。
1.2.5.2 碱提温度对番木瓜籽蛋白质提取率的影响 在料液比1∶30,碱提pH9.2,碱提时间60 min 不变的情况下,分别考察在碱提温度为40、45、50、55、60 ℃的条件下番木瓜籽蛋白质的提取率。
1.2.5.3 碱提时间对番木瓜籽蛋白质提取率的影响 在料液比1∶30,碱提pH9.2,碱提温度50 ℃不变的情况下,分别考察在碱提时间为30、60、90、120、150 min的条件下番木瓜籽蛋白质的提取率。
1.2.5.4 料液比对番木瓜籽蛋白质提取率的影响 在碱提pH9.2,碱提时间60 min,碱提温度50 ℃不变的情况下,分别考察在料液比为1∶20、1∶30、1∶40、1∶50、1∶60的条件下番木瓜籽蛋白质的提取率。
1.2.6 正交试验 在单因素实验的基础上,以蛋白质提取率为指标,以温度、时间、料液比和pH为实验因素,进行正交实验,正交试验的因素水平见表1。

表1 正交试验因素水平表Table 1 Factors and levels table of orthogonal test
1.2.7 番木瓜籽分离蛋白乳化性及乳化稳定性的测定

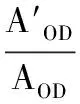
1.2.7.2 pH对番木瓜籽分离蛋白乳化性及乳化稳定性的影响 控制pH分别为 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0,其他步骤同1.2.7.1,考察pH对乳化指数和乳化稳定性的影响。
1.2.7.3 离子浓度(NaCl)对番木瓜籽分离蛋白乳化性及乳化稳定性的影响 控制NaCl浓度分别为0.0、0.1、0.2、0.4、0.6、0.8 mol/L,其他步骤同1.2.7.1,考察离子浓度对乳化指数和乳化稳定性的影响。
1.2.8 番木瓜籽分离蛋白起泡性及泡沫稳定性的测定
1.2.8.1 蛋白质浓度对番木瓜籽分离蛋白起泡性及泡沫稳定性的影响 参考李剑玄等[20-22]方法。称取一定量的番木瓜籽分离蛋白,溶于50.0 mL的蒸馏水中,分别配制成浓度为1.0%、3.0%、5.0%、7.0%的蛋白质浓度,调pH至7.0,磁力搅拌1 h,在组织捣碎机中均质 2 min后,记录总体积(V1),然后分别静置10、30、60、90、120 min后记录泡沫和蛋白质溶液的总体积(V2),由以下公式计算起泡性和泡沫稳定性:

1.2.8.2 pH对番木瓜籽分离蛋白起泡性及泡沫稳定性的影响 控制pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0,其他步骤同1.2.7.1,考察pH对起泡性及泡沫稳定性的影响。
1.2.8.3 离子浓度(NaCl)对番木瓜籽蛋白起泡性及泡沫稳定性的影响 控制NaCl浓度分别达到0.0、0.1、0.2、0.4、0.6、0.8 mol/L,其他步骤同1.2.7.1,考察离子浓度对起泡性及泡沫稳定性的影响。
1.3 统计分析
所有的实验至少进行三次,根据三次实验结果计算相应的标准偏差。结果以均值或均值±标准偏差的形式表示。
2 结果与分析
2.1 番木瓜籽中蛋白质的含量
经凯氏定氮法测得未脱脂的番木瓜籽粉的蛋白质含量(26.21±0.15) mg/100 mg,脱脂的番木瓜籽中蛋白质为(37.41±0.21) mg/100 mg。邓楚津等[23]研究表明番木瓜籽中粗蛋白质的含量为24.91%,Marfo等[24]研究表明未脱脂的番木瓜籽中蛋白质含量为27.8%,脱脂的番木瓜籽中蛋白质含量为44.4%,这些数据都与本实验的结果较为接近,产生的差别可能由于番木瓜来源和成熟度等不同所致。
2.2 番木瓜籽中蛋白质等电点的确定
图1为番木瓜籽蛋白质等电点的测定结果。从图1可以看出番木瓜籽提取液蛋白质含量从pH2.1到3.0有上升趋势,然后迅速下降,在pH3.3时,番木瓜籽提取液中蛋白质含量最低为0.254 mg/mL,此时对应的溶解度达到最小值。这说明绝大部分蛋白质在此pH已经沉淀,再增加pH,提取液中蛋白质含量又逐渐增加。因此,在提取番木瓜籽蛋白质工艺时,酸沉淀pH在3.3时最好,能使蛋白质沉淀率达到最高。
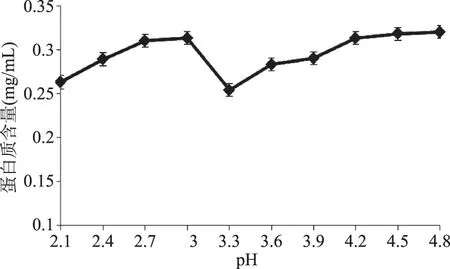
图1 番木瓜籽蛋白质等电点测定结果Fig.1 Determination of the isoelectric point ofprotein of papaya seeds
2.3 单因素实验
2.3.1 碱提pH对番木瓜籽蛋白质提取率的影响 图2为碱提pH对番木瓜籽中蛋白质提取率的影响结果。由图2可知,随着碱提pH的升高,蛋白质的提取率也随之增大,在pH从8.2增加到9.2时,增加幅度较大。但是当pH超过9.2时,提取率的增加非常缓慢,而在太高的pH条件下,提取液粘度变大,这不利于番木瓜籽中蛋白质的下一步离心分离。因此从实际操作的可行性分析,碱提pH最好不要超过9.2。而MARFO等[25]报道了在NaCl盐溶液中番木瓜籽中蛋白质溶解度较好,在pH为8时溶解度最大,这与本实验结果略有差别,可能由于盐离子浓度的加入改变了其溶解性能。

图2 碱提pH对番木瓜籽中蛋白质提取率的影响Fig.2 Effect of pH on extraction rate protein of papaya seeds
2.3.2 碱提温度对番木瓜籽蛋白质提取率的影响 图3为碱提温度对蛋白质提取率的影响结果。由图3可知,随着碱提温度的升高提取率增大,当碱提温度达到55 ℃时,番木瓜籽蛋白质提取率达到最大。随着温度继续升高,番木瓜籽蛋白质的提取率略有下降。这可能是因为温度高于55 ℃,部分蛋白质开始变性,降低了蛋白质的提取率。因此确定碱提最佳温度为55 ℃。
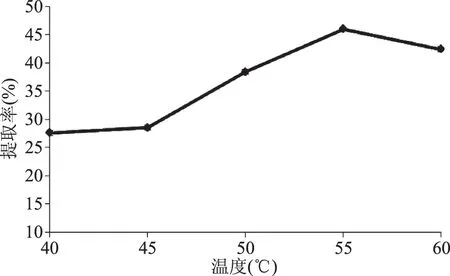
图3 碱提温度对番木瓜籽中蛋白质提取率的影响Fig.3 Effect of temperature on extraction rate protein of papaya seeds
2.3.3 碱提时间对番木瓜籽蛋白质提取率的影响 图4为碱提时间对番木瓜籽中蛋白质提取率的影响。由图4可知,随着碱提时间的延长,番木瓜籽蛋白质提取率增大,当碱提时间达到90 min以后,增加变缓,从提取效率考虑,番木瓜籽蛋白质的提取时间以90 min为宜。

图4 碱提时间对番木瓜籽中蛋白质提取率的影响Fig.4 Effect of time on extraction rate protein of papaya seeds
2.3.4 料液比对番木瓜籽蛋白质提取率的影响 图5所示为料液比对番木瓜籽蛋白质提取率的影响结果。由图5可知,料液比从1∶20增加到1∶30时,提取率显著增加,而当料液比从1∶30到1∶60之间,番木瓜籽蛋白质的提取率逐渐减小,提取率由45.68%下降到41.21%。这是因为随着料液比的增大,蛋白质溶解于水中的浓度变低。因此确定料液比在1∶30为宜。
2.4 正交实验
由表2极差分析结果表明:各因素对番木瓜籽蛋白质提取率的影响大小为A>B>D>C,最佳条件为A2B2C3D3,即确定碱提温度50 ℃,碱提pH为9.3,碱提时间120 min,料液比1∶40为最优工艺组合。由于此组合不在正交实验组合中,需对此最优组合进行验证实验,重复三次,结果表明蛋白质提取率为48.53%,高于正交实验中最高的结果47.32%。
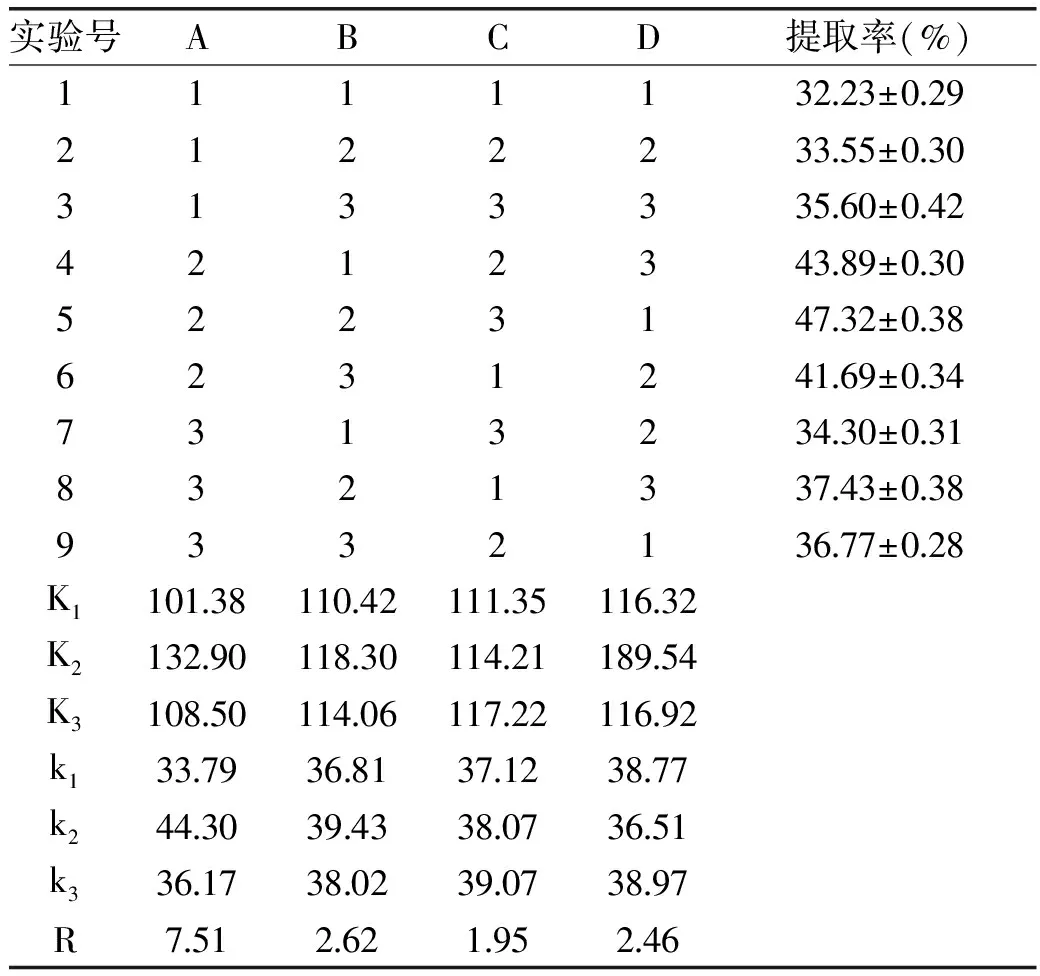
表2 L9(34)正交实验结果Table 2 Results of L9(34)orthogonal test
2.5 番木瓜籽分离蛋白质的乳化性及乳化稳定性
2.5.1 蛋白质浓度对番木瓜籽分离蛋白质乳化性及乳化稳定性的影响 图6为蛋白质浓度对番木瓜籽分离蛋白乳化性及乳化稳定性的影响结果。由图6可知,当蛋白质浓度为0.10%~0.70%时,木瓜籽分离蛋白质的乳化性及乳化稳定快速升高,且蛋白质的乳化性略高于蛋白质的乳化稳定性。这可能是因为随着蛋白质浓度的增加,油-水界面的蛋白质分子吸附量增加,从而使更多的蛋白质吸附到油-水界面上,所形成的乳状液油滴粒径逐渐减小,形成的乳状液滴的数量逐渐增多,吸附油量也逐渐增多,因而蛋白质的乳化性和乳化稳定性也增大。当蛋白质浓度为0.70%~0.90%时,乳化稳定性增加较快而乳化性增加缓慢,可能浓度太高对其溶解性和与油的相互作用带来一定影响。

图6 蛋白质浓度对番木瓜籽分离蛋白乳化性及乳化稳定性的影响Fig.6 Effect of protein concentration on the emulsification and stability
2.5.2 pH对番木瓜籽分离蛋白乳化性及乳化稳定性的影响 图7为pH对番木瓜籽分离蛋白乳化性及乳化稳定性的影响结果。由图7可知,pH对木瓜籽分离蛋白的乳化性及乳化稳定性的影响较大,而且两者的变化趋势几乎一致。当pH在等电点3.0时,蛋白质的乳化性和乳化稳定性都达到最小值,分别为15.20和23.03,此时蛋白几乎不带净电荷,蛋白质分子之间的相互作用力为最小,蛋白的溶解度也最低,蛋白质的亲水性降低,吸附在油-水界面的蛋白质减少,因而在该点处乳化活性和稳定性都为最低。当溶液pH大于3.0时,随着pH的增大,乳化性和乳化稳定性逐渐增大,增加的幅度逐渐降低,这可能是因为蛋白质-油相和蛋白质-水相的相互作用影响了油-水界面上蛋白质膜的稳定性,使蛋白质具有很好的溶解性,蛋白所带静电荷越高,电荷互相排斥,从而增加了分子间的静电斥力,使离散双电层增加,溶液界面膜增厚,分子分散性好,从而使乳化性及乳化稳定性得以提高。

表3 蛋白质浓度对番木瓜分离蛋白质起泡性及泡沫稳定性的影响Table 3 Effect of protein concentration from the papaya seeds on foaming and foam stability

图7 pH对番木瓜籽分离蛋白乳化性及乳化稳定性的影响Fig.7 Effect of pH on the emulsification and stability of protein from the papaya seeds
2.5.3 离子浓度(NaCl)对番木瓜籽分离蛋白乳化性及乳化稳定性的影响 图8为离子浓度对番木瓜籽分离蛋白乳化性及乳化稳定性的影响结果。由图8可知,NaCl浓度在0.0~0.2 mol/L之间,番木瓜籽分离蛋白质的乳化性上升,这可能是因为在低盐水浓度时,蛋白质分子的展开度增加,从而有助于蛋白质的溶解度提高,蛋白质分子扩散到油/水体系中的量增多,乳化性增加,即盐溶效应,从而更充分的发挥其表面活性作用。而NaCl浓度在0.2~0.8 mol/L之间,随着离子强度增加乳化性反而下降,但是乳化稳定性则一直呈下降的趋势。这是因为过高的盐浓度会出现蛋白质的盐析效应,蛋白质的乳化液胶体的水层会逐渐变薄,导致蛋白质发生凝聚,所以蛋白质的乳化性降低。因此,一定范围内的NaCl浓度增加有利于提高其乳化性,浓度过高则会导致蛋白质的乳化性及乳化稳定性下降。

图8 离子强度(NaCl)对番木瓜籽分离蛋白乳化性及乳化稳定性的影响Fig.8 Effect of NaCl concentration on the emulsification and stability of protein from the papaya seeds
2.6 番木瓜籽分离蛋白质起泡性及泡沫稳定性
2.6.1 蛋白质浓度对番木瓜籽分离蛋白起泡性及泡沫稳定性的影响 表3为蛋白质浓度对番木瓜籽分离蛋白起泡性及泡沫稳定性的影响结果。由表3可知,番木瓜籽分离蛋白质的起泡性及泡沫稳定性随蛋白质浓度提高而提高,即蛋白质浓度与蛋白的起泡性及泡沫稳定性呈正比关系。在浓度为1.0%~3.0%时,蛋白质的起泡性及稳定性增加幅度较大,而在浓度为5.0%~7.0%时,蛋白质的起泡性增加的幅度较小,这可能是因为浓度越高的蛋白质溶液,就越有利于在界面上形成坚硬的泡沫,蛋白质膜的黏附性也会变大,从而更有利于蛋白质起泡性及泡沫稳定性。
2.6.2 pH对番木瓜籽分离蛋白质起泡性及泡沫稳定性的影响 由表4可知,pH对番木瓜籽分离蛋白质的起泡性及泡沫的稳定性有很大的影响。在pH3.0(等电点附近)时,番木瓜籽中蛋白质的起泡性及泡沫稳定性均为最低,同时泡沫的稳定性在10~120 min期间的变化幅度较小,说明泡沫稳定性相对较好。这是因为pH影响着蛋白质的电荷状态,进而改变了蛋白质溶解度、相互作用力和持水力。在pH3.0(等电点附近)时,可溶蛋白质的浓度低,形成的泡沫数量较少,但是那些不溶解的蛋白质粒子的吸附增加了蛋白质膜的粘合力,因此稳定了泡沫。

表4 pH对番木瓜籽分离蛋白质起泡性及泡沫稳定性的影响Table 4 Effect of pH on foaming and foam stability of protein from the papaya seeds

表5 离子浓度对番木瓜籽分离蛋白质起泡性及泡沫稳定性的影响Table 5 Effect of the NaCl concentration on foaming and foam stability of protein from the papaya seeds
2.6.3 离子浓度(NaCl)对番木瓜籽分离蛋白质起泡性及泡沫稳定性的影响 由表5可知,NaCl浓度在0.0~0.2 mol/L时,番木瓜籽分离蛋白质的起泡性和泡沫稳定性逐渐提高,这是因为在此浓度范围内番木瓜籽中蛋白质的溶解性与离子浓度成正比。而随着盐的浓度增大,蛋白溶解度却下降,导致其起泡性亦降低。NaCl浓度在0.2~0.8 mol/L时,随着离子浓度的增加,蛋白质的起泡性和泡沫稳定性都逐渐降低。这主要是由于低盐浓度带来的盐溶效应和高盐浓度的盐析效应,从而使蛋白质的溶解度发生变化进而影响其起泡性和泡沫稳定性。
3 结论
通过单因素和正交实验对番木瓜籽中蛋白质进行提取,确定最佳的工艺条件为:料液比为1∶40,碱提pH为9.3,碱提温度50 ℃,碱提时间120 min,其蛋白质提取率为48.53%。此酸沉碱溶工艺相对简单,能将番木瓜中部分蛋白质提取出来。番木瓜籽中蛋白质的乳化性及稳定性随着蛋白质的浓度增加而增加、在pH3.0时为最小值,其乳化性在离子浓度为0.2 mol/L时最大,而稳定性一直呈下降趋势;番木瓜籽中蛋白质的起泡性及稳定性随蛋白浓度升高而变大,在pH3.0时,其起泡性和泡沫稳定性最小,在离子浓度为0.2 mol/L时,其起泡性和泡沫稳定性最高。提取的番木瓜籽分离蛋白质具有较好的乳化性和起泡性,可作为植物蛋白进行开发利用,具有较好的应用前景。
[1]刘思,沈文涛,黎小瑛,等. 番木瓜的营养保健价值与产品开发[J]. 广东农业科学,2007(2):68-70.
[2]袁志超,汪芳安. 番木瓜的开发应用及研究进展[J]. 武汉工业学院学报,2006,25(3):1-6.
[3]夏杏洲,彭克东,彭球生. 番木瓜芹菜复合果蔬汁饮料的研制[J]. 食品工业科技,2003,24(12):62-63.
[4]王标诗,刘慧霞,吴锦铸. 番木瓜西番莲混合果汁饮料的研制[J]. 饮料工业,2004,7(5):29-32.
[5]张雁,徐志宏,魏振承. 番木瓜果奶的工艺研究[J]. 中国食物与营养,2005(9):35-37.
[6]刘淑霞,刘淑琴,王士杰,等. 木瓜籽提取物抗感染镇痛活性研究[J]. 中国医药导报,2008,5(2):13-15.
[7]王会堂,刘淑霞,冯耀勇,等. 木瓜籽提取物免疫活性研究[J]. 亚太传统医药,2008,4(12):32-33.
[8]Wilson R K,Kwan T K,Kwan C Y,et al. Effects of papaya seed extract and benzyl isothiocyanate on vascular contraction[J]. Life Sciences,2002,71(5):497-507.
[9]李文钊,杜依登,朱华平,等. 响应面实验优化番木瓜籽中硫代葡萄糖苷酶解工艺[J]. 食品科学,2014,35(18):28-31.
[10]Kermanshai R,Mccarry B E,Rosenfeld J,et al. Benzyl isothiocyanate is the chief or sole anthelmintic in papaya seed extracts[J]. Phytochemistry,2001,57(3):427-435.
[11]李幼梅,白新鹏,陆腾达,等. 番木瓜籽粕亚临界水提取物抗氧化活性研究[J].食品安全质量检测学报,2015,6(6):2036-2041.
[12]袁竹连. 超声波辅助提取番木瓜籽多酚的工艺研究[J]. 河南农业科学,2013,42(5):173-176.
[13]刘书成,邓楚津,钟益强,等. 番木瓜籽油的提取工艺优化及其理化特性[J]. 中国粮油学报,2010,25(8):42-45.
[14]叶丽红,王标诗,程漪婷,等. 水酶法提取番木瓜籽油工艺及其氧化稳定性分析[J]. 食品科学,2014,35(16):64-69.
[15]张海涛,张海容,徐撒撒. 提取因素对木瓜籽油提取率的影响[J]. 安徽农业科学,2012,40(2):1026-1027.
[16]邓楚津,董强,张常松,等. 神经网络优化番木瓜籽油的超临界CO2萃取工艺[J]. 中国粮油学报,2012,27(2):47-51.
[17]严小平,金建昌,饶桂维,等. 超声波辅助与溶剂萃取番木瓜籽油的比较研究[J]. 中国粮油学报,2016,31(4):81-84.
[18]Li Y M,Su N,Yang H Q,et al. The extraction and properties of carica papaya seed oil[J]. Advance Journal of Food Science and Technology,2015,7(10):773-779.
[19]曲春香,沈颂东,王雪峰,等. 用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究[J]. 苏州大学学报:自然科学版,2006,22(2):82-85.
[20]李剑玄. 浒苔蛋白质的分离提取及其功能特性的研究[D].武汉:武汉工业学院,2010.
[21]范三红,刘艳荣,原超. 南瓜籽蛋白质的制备及其功能性质研究[J].食品科学,2010,31(16):97-100.
[22]杨国燕,陈栋梁,刘莉,等. 菜籽分离蛋白及菜籽蛋白肽的功能特性研究[J]. 食品科学,2007,28(1):76-78.
[23]邓楚津,董强,张良,等. 番木瓜籽的营养成分及营养价值[J]. 食品研究与开发,2012,33(6):185-188.
[24]Marfo E K,Oke O L,Afolabi O A. Chemical composition of papaya(Caricapapaya)seeds[J]. Food Chemistry,1986,22(4):259-266.
[25]Marfo E K,Oke O L,Afolabi O A. Some studies on the proteins ofCaricapapayaseeds[J]. Food Chemistry,1986,22(4):267-277.
Extraction and functional properties of protein from the seeds ofCaricapapayaL.
WANG Biao-shi,ZENG Yi-jun,LOU Meng,JIANG Min,HU Xiao-jun,PENG Yuan-huai,YANG Juan
(School of Chemistry and Chemical Engineering,Lingnan Normal University,Zhanjiang 524048,China)
Protein from the seeds ofCaricapapayaL. was extracted with alkali solution and acid experimental methods after that the oil was taken off using soxhlet extraction. The results showed that the best extraction conditions were solid to liquid ratio of 1∶40,alkali mention pH9.3,the alkaline extraction temperature of 50 ℃,alkaline extraction time 120 min with extraction rate of 48.53%. The functional properties of protein were also evaluated. The emulsification and stability of protein increased with the increase of protein concentration at pH3. Its emulsifying property was the maximum when the ion concentration was 0.2% and its’ stability had been a downward trend. The foaming and stability increased with protein concentration increasing,and minimum foaming and foam stability were gotten at pH3.0. There were the highest foam ability and foam stability when ion concentration was 0.2 mol/L. So,most of protein could be extracted by this method and the protein from the seeds ofCaricapapayaL. had good emulsibility and foamability. The above study would provide the references for exploitation and utilization of the protein from the seeds ofCaricapapayaL..
seeds ofCaricapapayaL.;protein;extraction;emulsibility;foamability
2016-11-28
王标诗(1980-),男,博士,副教授,研究方向:食品化学、食品加工及安全,E-mail:hang_kong2002@163.com。
广东省自然科学基金项目(2016A030307018);岭南师范学院热带与南海资源协同创新中心项目(CIL1503);岭南师范学院自然科学培育项目(YL1403)。
TS209
B
1002-0306(2017)14-0181-07
10.13386/j.issn1002-0306.2017.14.036
