超声波辅助酶法提取骨明胶研究
2017-08-09曾小芳杨瑞金蔡体元李雪良江南大学食品学院江苏无锡食品科学与技术国家重点实验室江南大学江苏无锡吉林省添正医药股份有限公司吉林蛟河500
曾小芳,赵 伟,*,杨瑞金,蔡体元,李雪良(.江南大学食品学院,江苏无锡 4; .食品科学与技术国家重点实验室,江南大学,江苏无锡 4; .吉林省添正医药股份有限公司,吉林蛟河 500)
超声波辅助酶法提取骨明胶研究
曾小芳1,赵 伟1,*,杨瑞金2,蔡体元3,李雪良3
(1.江南大学食品学院,江苏无锡 214122; 2.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122; 3.吉林省添正医药股份有限公司,吉林蛟河 132500)
以脱脂脱矿骨粉为原料,利用超声波辅助胃蛋白酶法提取骨明胶。比较了骨素酶解前、酶解中以及酶解后经不同超声时间和功率处理对明胶得率的影响,单因素实验结果表明:骨素酶解前和酶解中经超声处理,明胶得率显著提高。在骨素酶解前和酶解中分别经250 W、20 min和250 W、10 min的超声处理,明胶的得率分别为81.35%和83.32%,与未经超声处理组相比,明胶得率分别提高了9.96%和11.93%,而骨素酶解后在300 W超声功率下处理10 min,明胶得率仅为71.59%,与未超声处理组71.39%接近。SEM图片显示,酶解前和酶解中经超声处理,会使骨素表面出现孔隙,而酶解后超声处理则会使骨素表面更加光滑,表明酶解前和酶解中超声处理对骨素具有疏松作用。SDS-PAGE结果显示,超声波辅助酶法提取明胶,对明胶分子量分布没有影响。超声波辅助酶法提取,提高了骨明胶的得率,可为工业上骨明胶的生产提供有益的参考和借鉴。
脱脂脱矿骨粉,超声波,胃蛋白酶,明胶
明胶(gelatin)是由动物的骨、腱、软骨、皮肤、肌膜等结缔组织中的胶原经温和而不可逆的断裂后的主要产物[1-3]。明胶是一种重要的高分子生物材料,具有胶凝、亲水性强、成膜性好等优良的物理化学性质[4],因而广泛应用于医药、食品、照相和其他行业。
明胶产业有一百多年的历史,目前骨明胶生产的方法主要是传统工艺碱法。碱法生产的明胶质量较高,但碱法生产明胶周期很长,长达2~3个月,其中浸灰时间约1~2个月。同时,碱法生产采用多道提胶,提胶温度高,提胶时间长达60 h左右,高品质的明胶得率不高[5]。此外,碱法每生产1 t骨明胶需要水量在600 t以上,生产过程中需要使用大量的酸碱试剂,环境污染严重,使企业面临巨大的环保压力[6]。
酶法制胶是用酶将胶原水解为明胶的方法[7],与传统制胶工艺相比,具有生产周期短、废水排放量少、好胶率高、纯度高等优点。韩应昌[5]等以牛骨为原料,采用中性蛋白酶酶解制照相明胶,生产周期减少50%左右,好胶率高达90%以上。张锋[8]等以中性蛋白酶酶解猪皮原料,生产周期大大缩短。Hossei ni-Parvar等[9]进行了酶法从牛骨中提取食用明胶的研究。
超声波是一种超过人的听力范围的声波(>20 kHz),因具有安全、无毒、环保等优势,近年来已经普遍应用于食品工业的加工、预处理和提取中[10-13]。杨萌萌等[14]以牦牛蹄筋为原料,利用超声波辅助酶法提取胶原蛋白,提取率提高了10.69%。殷涌光等[15]以鲜鹿皮为原材料,采用超声波辅助酶法对其蛋白的提取进行了研究,提取率可达56.86%。李敏等[16]采用超声预处理和常规方法分别进行了木瓜蛋白酶酶解草鱼鱼鳞胶原蛋白的研究。
本文以脱脂脱矿骨粉为原料,研究了超声波辅助胃蛋白酶提取骨明胶对得率的影响,分析了超声波处理后骨素结构特征及产品分子量分布,对超声波辅助酶法提取的机理进行初步探究,以期更好地指导实际应用。
1 材料与方法
1.1 材料与仪器
脱脂骨粒(来源于猪骨)、碱法明胶 吉林添正医药股份有限公司;胃蛋白酶、三羟甲基氨基甲烷(Tris)、甘氨酸、十二烷基磺酸钠(SDS)、醋酸、甲醇、盐酸、氢氧化钠、硫酸铜、硫酸钾、甲基橙指示剂、甲基红指示剂、硼酸 国药集团化学试剂有限公司;聚丙烯酰胺储备液(30%) 前尘生物科技公司;标准蛋白 Marker Bio-Rad公司;四甲基乙二胺(TEMED) MERCK公司。
脉冲多频超声波设备 无锡市华能超声电子有限公司;MP-501A超级恒温循环槽 上海一恒科学仪器有限公司;C-MAC HS 4 S25磁力搅拌器 上海圣科仪器设备有限公司;FE20实验室pH计 梅特勒托利多仪器(上海)有限公司;BS2202 S和BS 224 S精密天平 赛多利斯科学仪器有限公司;DK-824电热恒温水浴锅 上海精宏实验设备有限公司;KDN-103F自动定氮仪 上海纤检仪器有限公司;UV-1100型紫外可见光光度计 上海美谱达仪器有限公司;WK-1000A型高速药物粉碎机 青州市精诚机械有限公司;LXJ-11B低速大容量离心机 上海安亭科学仪器厂;Su1510扫描电子显微镜 日本日立公司;Bio-Rad mini-protein tetra cell电泳设备 美国Bio-Rad 公司。
1.2 实验方法
1.2.1 基本成分测定 粗蛋白含量测定:凯氏定氮法(GB 5009.5-2010),蛋白质换算系数为5.55;含水量测定:105 ℃恒重法(GB5009.3-2010);灰分含量测定:灼烧法(GB5009.4-2010);粗脂肪含量测定:索氏抽提法(GB/T5512-2008)。
1.2.2 骨素的制备 经前期脱矿脱脂优化实验,确定脱矿脱脂最佳条件。用高速药物粉碎机将骨粒粉碎,收集过30目筛的骨粉,将骨粉与0.48 mol/L的盐酸按1∶7(g∶mL)的比例于室温下搅拌脱矿3 h,每1 h更换1次盐酸溶液。将脱矿后的骨粉与0.6% NaOH溶液按1∶2(g∶mL)的比例于室温下搅拌脱脂12 h,每3 h更换1次NaOH溶液,每次更换溶液前均采用5000 r/min,室温下离心20 min,收集渣相,即为脱脂脱矿骨粉(骨素)。骨素的粗蛋白含量为(94.01%±0.03%),粗脂肪含量为(0.27%±0.01%),灰分含量为(1.30%±0.01%)。
1.2.3 骨素的酶解 将骨素分散于已预热至30 ℃的去离子水中,料液比1∶10,加盐酸溶液调至最适pH1.5并保持,加胃蛋白酶(60 U/g)后恒温搅拌,反应结束后采用水洗三次的方法灭酶,明胶得率为71.39%。
1.2.4 超声波辅助酶解 考察在酶解前、酶解中以及酶解后施加超声波对明胶得率的影响。单因素的水平设定为:固定超声功率250 W,研究超声时间5、10、20、30、40 min对明胶得率的影响;固定超声时间10 min,研究超声功率100、150、200、250、300 W对明胶得率的影响。
1.2.5 骨明胶得率 胶原蛋白含量采用凯氏定氮法测定,转化系数取5.55[17]。
骨明胶得率(%)=产品胶重/(骨素粉重×骨素粉中胶原蛋白含量)×100
1.2.6 扫描电子显微镜(SEM)分析 将未经超声处理骨素和超声处理骨素(酶解前、酶解中、酶解后250 W超声10 min)干燥,采用扫描电子显微镜对酶解后骨素进行拍照分析。
1.2.7 SDS-PAGE电泳分析 采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳对明胶进行电泳分析。0.2 mL样品加入0.05 mL 5×样品缓冲液(内含10% SDS,5%β-巯基乙醇,50%甘油,0.5%溴酚蓝,1 mol/L pH6.8 Tris-HCl缓冲液)处理后,于100 ℃沸水加热3 min后离心,待测。采用5%的浓缩胶、7.5%分离胶对已处理样品进行电泳分析。采用考马斯亮蓝R-250染色后,再用甲醇/乙酸溶液脱色。电泳胶采用GEL-DOC 2000凝胶成像系统进行采集。
1.3 数据处理
每个样品设3个平行,采用Excel和SPSS 22.0软件进行数据分析。测定结果以平均值±标准差表示。实验数据采用ANOVA进行Duncan’s差异分析,以p<0.05为差异显著。
2 结果与讨论
2.1 超声波辅助酶解对明胶得率的影响
2.1.1 酶解前超声处理对明胶得率的影响
2.1.1.1 酶解前超声时间对明胶得率的影响 如图1所示,在一定的超声时间范围内,明胶得率会随着超声时间的延长而逐渐提高并在20 min时达到最高(79.48%),超声波的“空穴效应”可能是造成这一现象的原因之一。一定程度的超声处理会在基质表面附近产生一系列声学效应和微射流,暴露出更多的酶结合位点,因此有助于提高酶解速度[18]。经20 min的超声处理,胶原纤维变得疏松,酶蛋白能够进入骨素内部与更多的酶作用位点结合,从而提高明胶得率。随着超声时间的进一步延长,胶原的螺旋结构可能会遭到破坏[19-20],有一部分胶原被水解过度变为胶原蛋白肽,从而导致明胶的得率随之下降。
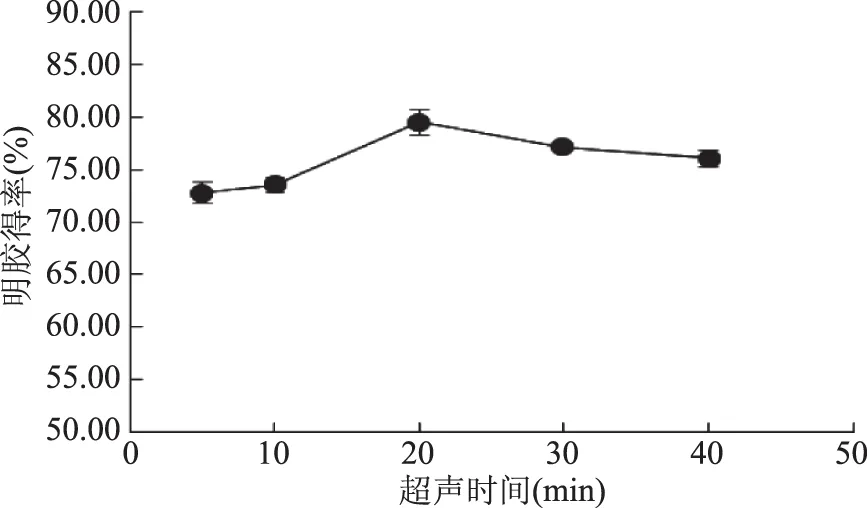
图1 超声时间对明胶得率的影响Fig.1 The effect of ultrasonic time on yield of gelatin
2.1.1.2 酶解前超声功率对明胶得率的影响 在较低超声功率和短时间下,骨素的结构可能会发生一定程度的再聚集,使得骨素表面原有的与酶作用的位点有可能会被包裹[21],此时酶解效率降低,且在一定范围内(≤200 W)随着超声功率的提高,骨素聚集的程度更高,酶解效率随之降低,导致明胶得率下降。继续增大超声功率,此时超声波的“空穴效应”使得胶原纤维的结构重新疏松,酶蛋白作用位点暴露的更多[19],因此明胶得率随超声功率的增加先下降后升高,在功率达到250 W时,明胶得率达到最高(81.35%),与未经超声处理的得率(71.39%)相比提高了9.96%。
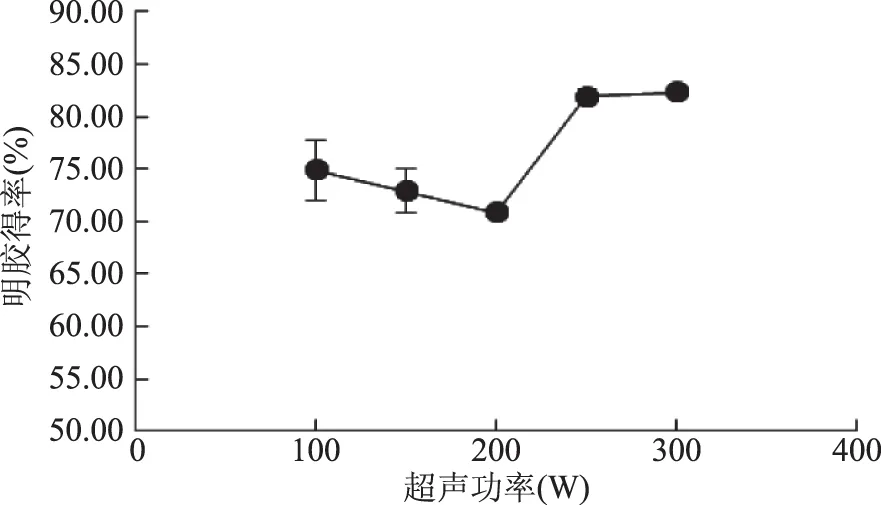
图2 超声功率对明胶得率的影响Fig.2 The effect of ultrasonic power on yield of gelatin
2.1.2 酶解中超声处理对明胶得率的影响
2.1.2.1 酶解中超声时间对明胶得率的影响 从图3可以看出明胶得率随超声时间的增加先逐渐升高,在10~30 min基本保持稳定,随后明胶得率缓慢下降,并且在10 min时明胶得率达到最高79.12%。
与图1酶解前超声时间对明胶提取率影响结果相比,在酶解中进行超声处理,明胶提取率达到最高值的时间从20 min(图1)缩短为10 min(图3),说明酶解中超声波处理不仅会对骨素表面结构产生影响,同时还可能对酶活产生一定的影响,即会在一定程度上提高所选用的胃蛋白酶的酶活。实验结果与Yu[22]的研究结果相一致,Yu研究中发现超声处理胃蛋白酶后,胃蛋白酶可以恢复到超声前的初始结构,同时在它的活性中心可能暴露出天冬氨酸残基,从而提高酶活。
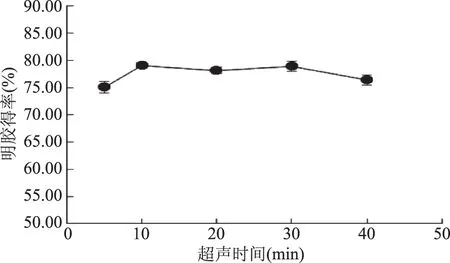
图3 超声时间对明胶得率的影响Fig.3 The effect of ultrasonic time on yield of gelatin
2.1.2.2 酶解中超声功率对明胶得率的影响 图4显示,明胶得率随超声功率的增加先下降后升高,在功率达到250 W时,明胶得率达到83.32%,与未经超声处理的得率(71.39%)相比提高了11.93%。与图2的趋势相同,图2在超声功率大于200 W时,得率开始呈现上升趋势,而图4在超声功率大于150 W时,得率已经呈现上升趋势,可能是因为在酶解过程中施加超声波,超声提高了胃蛋白酶的活性[22],从而降低了提高得率的最低超声功率。
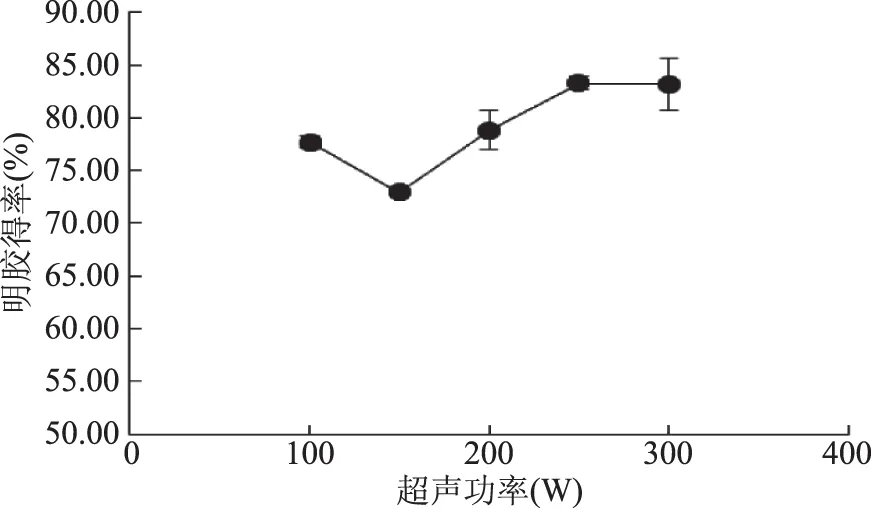
图4 超声功率对明胶得率的影响Fig.4 The effect of ultrasonic power on yield of gelatin
2.1.3 酶解后超声处理对明胶得率的影响
2.1.3.1 酶解后超声时间对明胶得率的影响 如图5所示,明胶得率随超声时间的增加先升高后缓慢下降,在10 min时得率达到最高71.45%。与图1、图3相比,尽管得率随时间变化的趋势类似,但是图5的得率均低于图1和图3。可以认为酶解后超声的效果差于酶解前超声处理和酶解时超声处理。胶原变为明胶主要包括两个过程:胶原的解聚集过程和胶原的解螺旋过程[23]。酶解后胶原解聚集还未解螺旋,经超声处理后,有可能暴露出一部分带不同电荷的基团,这些基团通过相互吸引重新聚集[21],骨素结构更紧密,从而明胶得率更低。
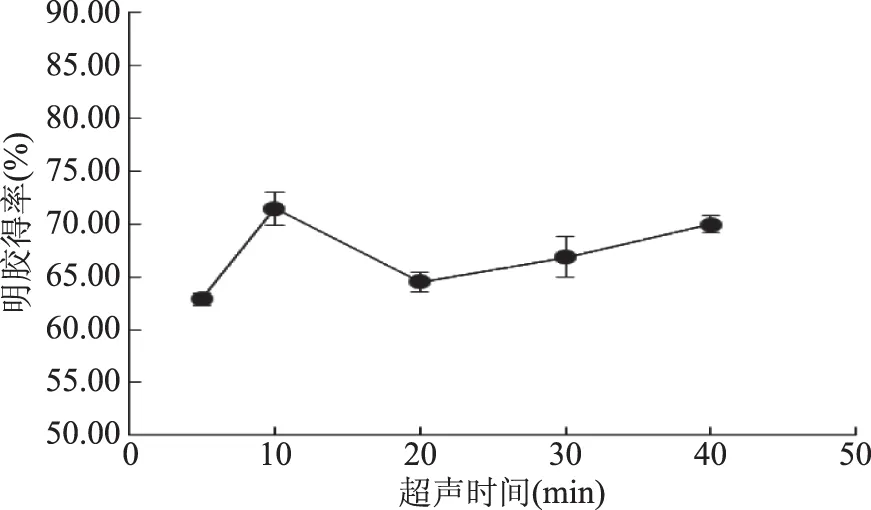
图5 超声时间对明胶得率的影响Fig.5 The effect of ultrasonic time on yield of gelatin
2.1.3.2 酶解后超声功率对明胶得率的影响 从图6可以看出,当超声功率为300 W时,明胶得率仅为71.59%,与未经超声处理的得率(71.39%)接近。骨素经超声处理后,有可能暴露出一部分带不同电荷的基团,这些基团通过相互吸引重新聚集[21],从而导致骨素结构更紧密。随着超声功率的增加,胶原结构会重新疏松,明胶得率随之上升[20],但是可能由于仪器本身的功率所限,得率最大与未经超声处理接近。
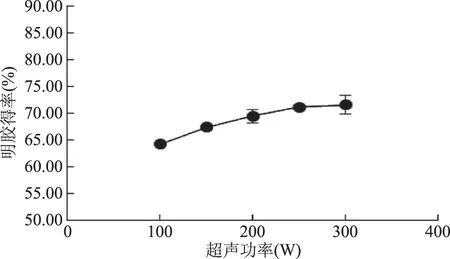
图6 超声功率对明胶得率的影响Fig.6 The effect of ultrasonic power on yield of gelatin
2.2 扫描电子显微镜分析
图7是未经超声处理和超声处理骨素的SEM照片,未超声骨素(A)表面没有小孔,说明结构紧密;酶解前(B)和酶解中(C)超声处理骨素表面分布很多小孔,说明超声处理在酶解前和酶解中对骨素结构都有疏松的作用;而酶解后超声处理骨素(D)与未超声骨素(A)比较表面更光滑,且没有小孔,说明酶解后超声波处理不仅没有疏松骨素,反而使骨素的结构更紧密,因此选择在酶解前或者酶解中超声处理骨素有助于明胶得率的提高。
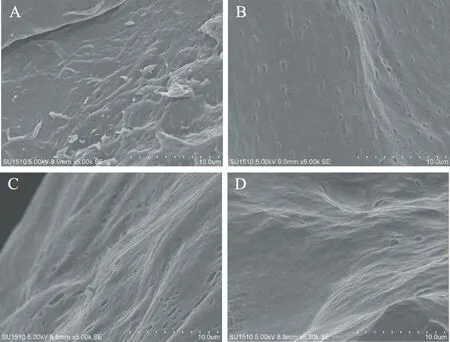
图7 未经超声处理骨素和超声处理骨素电镜图(5000×)Fig.7 The SEM photos of untreatedand treated defatted and demineralized bone powder by ultrasonic(5000×)注:A未经超声处理骨素;B酶解前超声处理骨素; C酶解中超声处理骨素;D酶解后超声处理骨素。
2.3 SDS-PAGE电泳分析
超声波辅助酶解与未经超声波处理所得的明胶SDS-PAGE电泳图如图8所示。泳道2是未经超声处理的酶法提取骨明胶,分子量主要分布在100 kDa和116 kDa附近,泳道6是传统方法碱法生产的明胶,分子量条带主要在140 kDa附近,在250 kDa以上有少量条带。酶法明胶与传统碱法明胶相比,高分子量组分略少,110 kDa附近的组分增加,说明酶对胶原的降解比碱法更严重。泳道3、4、5是超声辅助酶法提取的明胶,与泳道2未经超声处理的酶法胶相比,其分子量分布几乎一致,说明超声波处理对明胶分子量分布没有影响。这可能跟仪器本身的功率有关,本实验室的超声波发生器的最大功率为300 W,短时间(≤20 min)超声处理,能量不足以破坏胶原的结构。
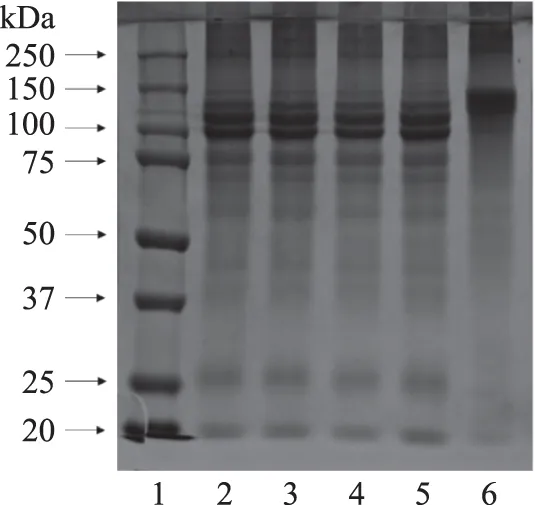
图8 超声处理骨素的产品和碱法明胶SDS-PAGE电泳图Fig.8 SDS-PAGE pattern of gelatin solutions under ultrasound treatment and alkaline type gelatins注:1:蛋白Marker;2:酶解未经超声;3:酶解后超声; 4:酶解前超声;5:酶解中超声;6:碱法;超声条件250 W,10 min。
3 结论
在超声波辅助酶解骨素提取明胶的研究中发现,酶解前和酶解中超声波处理骨素都可以显著提高明胶的得率(p<0.05)。骨素酶解前超声可以疏松骨素结构,增加骨素表面的酶作用位点;而酶解过程中超声处理则不仅可以疏松骨素结构,增加骨素表面的酶作用位点,同时激活胃蛋白酶,提高酶活。酶解前超声处理(250 W、20 min)和酶解中超声处理(250 W、10 min)与未经超声处理相比,得率分别提高了9.96%和11.93%;而骨素酶解后再经过超声波的得率没有提高甚至降低。SEM显示,酶解前和酶解中超声波处理使骨素表面出现小孔,酶解后超声波处理使骨素表面更加光滑,表明酶解前和酶解中超声波处理对骨素具有疏松作用。通过SDS-PAGE分析可知,超声波辅助酶法提取明胶,对明胶的分子量分布没有影响。由此可见,超声波辅助可为酶法提取骨明胶的研究提供新的思路。
[1]Ward A G,Courts A.明胶的科学与工艺学[M].北京:轻工业出版社,1982:80.
[2]Duconseille A,Astruc T,Sante-Lhoutellier V,et al. Gelatin structure and composition linked to hard capsule dissolution:A review[J]. Food Hydrocolloids,2015,43(43):360-376.
[3]Mariod A A,Adam H F. Review:gelatin,source,extraction and industrial applications[J]. Acta Scientiarum Polonorum. Technologia Alimentaria,2013,12(2):135-147.
[4]Djagny K B,Wang Z,Xu SY. Gelatin:a valuable protein for food and pharmaceutical industries:review[J]. Critical Reviews in Food Science and Nutrition,2001,41(6):481-492.
[5]韩应昌,许时婴.酶法制备骨明胶照相明胶工艺的研究[J].无锡轻工业学院学报,1993,12(1):1-13.
[6]张兵,郭燕川,史京京,等.酶解法制备骨明胶[J].明胶科学与技术,2011,31(3):133-135.
[7]Rubin A L,Drake M P,Davison P F,et al. Effects of Pepsin Treatment on the Interaction Properties of Tropocollagen Macromolecules[J].Biochemistry,1965,4(2):181-190.
[8]张锋.酶法制备明胶的研究[D].北京:北京化工大学,2002.
[9]Hossei N S H,Keramat J,Kadivar M,et al. Optimising conditions for enzymatic extraction of edible gelatin from the cattle bones using response surface methodology[J]. International Journal of Food Science and Technology,2009,44(3):467-475.
[10]Chandrapala J,Oliver C,Ashokkumar M,et al.Ultrasonics in food processing[J]. Ultrasonics Sonochemistry,2012,19(5):975-983.
[11]Chemat F,Zill-e-Huma,Khan M K. Applications of ultrasound in food technology:Processing,preservation and extraction[J]. Ultrasonics Sonochemistry,2011,18(4):813-835.
[12]Feng H,Yang W,Hielscher T. Power Ultrasound[J]. Food Science and Technology International,2008,14(5):433-436.
[13]Mason T J,Paniwnyk L,Lorimer J P. The uses of ultrasound in food technology[J]. Ultrasonics Sonochemistry,1996,3(3):253-260.
[14]杨萌萌,郭兆斌,余群力,等.超声波辅助法提取胶原蛋白工艺研究[J].甘肃农业大学学报,2013,48(3):121-126.
[15]殷涌光,齐越,李旭光,等.超声波辅助酶解鹿皮胶原蛋白[J].粮油加工,2014(11):67-70.
[16]李敏,陈柳萌,蒋柏泉,等.超声预处理酶解和常规酶解鱼鳞胶原蛋白的比较[J].食品工业,2015,36(11):22-26.
[17]刘小玲.鸡骨明胶的制备、结构及功能性质研究[D].无锡:江南大学,2005.
[18]Rolz C. Ultrasound effect on enzymatic saccharification[J]. Biotechnology Letters,1986,8(2):131-136.
[19]Song J,Tao W Y,Chen W Y. Ultrasound-accelerated enzymatic hydrolysis of solid leather waste[J].Journal of Cleaner Productin,2008,16(5):591-597.
[20]Tu Z C,Huang T,Wang H,et al. Physico-chemical properties of gelatin from bighead carp(Hypophthalmichthysnobilis)scales by ultrasound-assisted extraction[J]. Journal of Food Science and Technology,2015,52(4):2166-2174.
[21]何虹,杨俊,王亭杰,等.悬浮聚合法色粉制备条件及树脂性能控制[J].高校化学工程学报,2001,15(6):538-545.
[22]Yu Z L,Zeng W C,Shi B,et al. Effect of ultrasound on the activity and conformation ofα-amylase,papain and pepsin[J]. Ultrasonics Sonochemistry,2014,21(3):930-936.
[23]李德富,周玉玲,穆畅道,等.超声波对溶液中胶原蛋白聚集体和三股螺旋结构的影响[J].皮革科学与工程,2009,19(5):14-17.
Study on the extraction of gelatin from bone by ultrasonic-assisted enzymatic hydrolysis
ZENG Xiao-fang1,ZHAO Wei1,*,YANG Rui-jin2,CAI Ti-yuan3,LI Xue-liang3
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China; 2.State Key Laboratory of Food Science &Technology,Jiangnan University,Wuxi 214122,China; 3.Jilin Tianzheng Medical Co.,Ltd.,Jiaohe 132500,China)
Taking defatted and decalcified bone powder as raw material,the extraction of gelatin was studied by ultrasonic-assisted enzymatic hydrolysis using pepsin. The effects of ultrasonic treatment defatted and decalcified bone powder before,during and after enzymatic hydrolysis(different ultrasonic time and ultrasonic power)on the yield of gelatin were compared. The single factor experiment results showed that the yield of gelatin could be significantly increased by ultrasonic treatment before enzymatic hydrolysis and during enzymatic hydrolysis. The yields of gelatin reached 81.35% and 83.32% respectively at 250 W for 20 min and 250 W for 10 min by ultrasonic treatment before enzymatic hydrolysis and during enzymatic hydrolysis respectively,which was higher than without ultrasonic treatment,9.96% and 11.93% respectively. However,the yield of gelatin was only 71.59% by ultrasonic treatment at 300 W for 10 min after enzymatic hydrolysis,which had no advantage compared with without ultrasonic treatment. SEM showed that the surface of defatted and decalcified bone powder appeared small holes when treated with ultrasonic before enzymatic hydrolysis and during enzymatic hydrolysis. The surface of defatted and decalcified bone powder became smoother when treated with ultrasonic after enzymatic hydrolysis. It was indicated that the structure of defatted and decalcified bone powder with ultrasonic treatment before enzymatic hydrolysis and during enzymatic hydrolysis could be loosed. SDS-PAGE showed that ultrasonic-assisted enzymatic hydrolysis had no effect on the molecular weight distribution of gelatin. Ultrasonic-assisted enzymatic hydrolysis,which improved the yield of gelatin,could provide useful reference in industrial production of bone gelatin.
defatted and decalcified bone powder;ultrasound;pepsin;gelatin
2016-11-30
曾小芳(1991-),女,硕士研究生,研究方向:食品加工与配料,E-mail:zeng_xiaofang123@126.com。
*通讯作者:赵伟(1982-),男,博士,教授,研究方向:食品加工,E-mail:zhaow@jiangnan.edu.cn。
国家自然科学基金项目(31522044)。
TS201.3
A
1002-0306(2017)14-0167-05
10.13386/j.issn1002-0306.2017.14.033
