HPLC法测定四种食用坚果种子中还原型谷胱甘肽(GSH)和蛋白巯基(P-SH)含量
2017-08-09应译娴崔胜云延边大学长白山生物资源与功能分子教育部重点实验室吉林延吉133002
刘 畅,应译娴,邱 岳,崔胜云(延边大学,长白山生物资源与功能分子教育部重点实验室,吉林延吉 133002)
HPLC法测定四种食用坚果种子中还原型谷胱甘肽(GSH)和蛋白巯基(P-SH)含量
刘 畅,应译娴,邱 岳,崔胜云*
(延边大学,长白山生物资源与功能分子教育部重点实验室,吉林延吉 133002)
用5,5′-二硫双-2-硝基苯甲酸(DTNB)为柱前衍生化试剂,采用细胞破壁、衍生化为一体的同步衍生化提取,HPLC梯度洗脱,测定了市售开心果、巴旦木、澳洲坚果、腰果干品中谷胱甘肽(GSH)和含半胱氨酸残基的蛋白巯基(P-SH)含量。结果发现四种坚果均含较丰富的GSH和P-SH巯基,其含量分别为,开心果:GSH(1.2303±0.01126) μmol/g,P-SH(3.5414±0.0531) μmol/g;巴旦木:GSH(0.3069±0.0185) μmol/g,P-SH(1.9001±0.0194) μmol/g;澳洲坚果:GSH(1.5708±0.0216) μmol/g,P-SH(0.5905±0.0238) μmol/g;腰果:GSH(0.3373±0.0047) μmol/g,P-SH(2.2458±0.0225) μmol/g。在优化的选定条件下,测定方法的回收率为99.37%~101.45%,GSH和P-SH测定检测限分别为0.1386 μmol/g和0.2184 μmol/g。本研究对坚果活性成分的构成及其巯基化合物在保健防病作用研究及其功能性食品开发均提供了有用的参考数据。
高效液相色谱法,坚果,谷胱甘肽,巯基化合物
坚果为被子植物成熟后的子房,通常把成熟后裹着坚硬外壳的种子作为食用部分,习惯上称为坚果。坚果含有丰富的脂肪酸、蛋白质、氨基酸及各类维生素及矿物质等,长期食用坚果、对心血管疾病、糖尿病具有良好的预防作用,是备受人们青睐的功能性食品[1-2]。据文献报道,坚果中除了上述的主成分之外,特定坚果中还含有其它具有重要活性功能的多酚类及其他挥发性微量成分[3-4],但迄今对具有重要生物活性功能的含半胱氨酸残基的巯基肽和蛋白质(P-SH),如还原型谷胱甘肽(GSH)等含量测定鲜见报道。
GSH和P-SH等含巯基化合物在生物体内具有多种生物学功能,是构成抗氧化及抵御各类外源性胁迫的重要防御性物质、具有清除过量活性氧自由基、促氨基酸吸收、细胞信号转导、维持胞内氧化还原平衡等多种生物学功能[5-9]。研究表明:机体也摄入外源性的GSH等含巯基化合物,可有效抵抗各类胁迫、防止像心血管疾病、肝病、免疫系统紊乱、糖尿病及各种衰老有关的疾病[10-13]。因此,筛选富含GSH及P-SH等含巯基化合物的食材,对防病、治病及食品中活性成分及其功效关系的研究均具有实际意义。
本研究采用5,5′-二硫双-2-硝基苯甲酸(DTNB)巯基衍生化试剂,采用细胞破壁衍生化为一体的前处理方法,并筛选测定开心果、巴旦木、腰果、澳洲坚果中GSH和P-SH的巯基含量,为坚果的活性成分构成及其功效的研究提供参考数据。
1 材料与方法
1.1 材料与仪器
开心果、巴旦木、澳洲坚果、腰果 均为市售;还原型谷胱甘肽(GSH) 沃凯牌,国药试剂;半胱氨酸(Cys) Applichem,99%;5,5′-二硫双-2-硝基苯甲酸(DTNB) 沃凯牌,国药试剂;三乙胺 色谱纯,光复牌,98%;乙腈 色谱纯,Fisher;甲酸 色谱纯,沪试牌,98%;实验用水 三次蒸馏水。

图1 巯基化合物的衍生化反应Fig.1 Derivatizing reactions注:R-SH为小分子化合物,P-SH为巯基蛋白质。
HP1100高效液相色谱仪、二极管阵列检测器(DAD) 美国安捷伦公司;色谱柱为Inertsil ODS-SP(5 μm,4.6 mm×150 mm) 日本GL Science公司;SCIENT-IID 超声波细胞破碎机 宁波新芝生物科技股份有限公司;KQ-500DE数控超声波清洗器 江苏昆山超声仪器有限公司;Mini-10K微型离心机 珠海黑白医学仪器有限公司;pHS-3C型实验室酸度计 上海精密仪器有限公司;SZ-97全自动三重纯水蒸馏器 上海亚荣公司。
1.2 实验方法
1.2.1 巯基化合物的衍生化反应 DTNB与半胱氨酸及含半胱氨酸残基的化合物中的巯基在一定条件下(pH=7的磷酸盐缓冲液,PBS)发生选择性衍生化反应,见图1。
如图1所示,衍生化产物包括小分子巯基化合物,像半胱氨酸、还原型谷胱甘肽的水溶性衍生化产物(RS-TNB)和非水溶性的蛋白质巯基衍生化产物(P-S-TNB),同时定量释放出离子态的水溶性衍生化产物1-硫-5-硝基苯甲酸(TNB)或2-硝基-4-巯基-苯甲酸(NTB)。由于定量释放出的TNB或NTB的含量提供包括蛋白巯基在内的总巯基含量信息,因此HPLC法分别测定去蛋白后的RS-TNB和TNB或NTB的含量,可分别测定小分子巯基化合物和蛋白巯基含量。
1.2.2 标准溶液的配制与样品的制备 准确称取还原型谷胱甘肽(GSH)标准品0.0307 g和半胱氨酸(Cys)标准品0.0121 g,移入10 mL比色管中,加入三次蒸馏水稀释定容,分别制备1.0×10-2mol/L GSH和Cys贮备液。称取衍生化试剂DTNB 0.0792 g,向其中加入磷酸盐缓冲溶液(PBS,0.2 mol/L,pH=7)20 mL,制备DTNB最终浓度为1.0×10-2mol/L的缓冲溶液。
取一定量的坚果仁干品,用研钵将其研磨粉碎至粉末状。称量已经粉碎好的样品2.0 g移入50 mL具塞锥瓶中,加入20 mL含过量一定浓度DTNB(1.0×10-2mol/L)衍生化试剂的磷酸盐缓冲溶液(PBS),用超声细胞粉碎机破壁5 min、超声波清洗仪振荡30 min,离心,取上清液加入2倍体积的乙醇,静置30 min除蛋白,抽滤,最后用8000 r/min离心机离心10 min,将离心后的上清液用针孔过滤器过滤,滤液作为待测样品。
1.2.3 色谱条件 用紫外检测器的HPLC测定水溶性衍生化产物RS-TNB及定量释放出的TNB及NTB,其中TNB在可见区有较强的吸收,而半胱氨酸或谷胱甘肽等小分子衍生化产物(RS-TNB)和NTB在λmax=327 nm处均有较强的吸收[14]。为了消除TNB与NTB光谱特性差异导致的色谱测定的干扰,通过增加色谱洗脱液的酸度,使得在洗脱过程中TNB转化成NTB,并采用二元流动相程序化洗脱方法消除干扰。所选用的二元流动相组成为:A相为含1%甲酸、0.07%三乙胺的水相;B相为含1%甲酸、0.07%三乙胺的乙腈有机相。梯度洗脱程序:90% A+10% B(0 min);86% A+14% B(10 min);72% A+28% B(15 min);10% A+90% B(40 min);10% A+90% B(45 min);90% A+10% B(50 min)。其它色谱条件:流动相流速为0.8 mL/min,柱温为25 ℃,进样量为10 μL,检测波长为327 nm。
1.2.4 衍生化产物的稳定性实验 由于衍生化产物的稳定性与测定的准确度密切相关,故利用GSH(1.0×10-4mol/L)和DTNB(1.0×10-2mol/L)的PBS标准混合溶液,通过测定混合溶液衍生化反应后放置不同时间后的衍生化产物的色谱峰强度变化,探讨工作时间内衍生化产物中的巯基及其它可能的副反应对测定准确度的影响。

表1 衍生化产物的色谱峰强度Table 1 Chromatograms for the derivatized products
注:A代表色谱峰面积。
1.2.5 GSH和P-SH含量分析 由于在过量衍生化试剂(DTNB)的PBS缓冲溶液中,GSH和含半胱氨酸残基的巯基化合物分别定量释放出水溶性衍生化产物RS-TNB和NTB,且其色谱峰强度与巯基的浓度间呈良好的线性关系,其中NTB的色谱峰强度提供总的半胱氨酸残基量的信息。因此,利用GSH作为基准物质,利用外标法分别测定水溶性小分子巯基化合物GSH含量和包括蛋白巯基在内的总巯基含量。由于本实验所测得样品中,水溶性小分子巯基化合物只含有GSH,因此总巯基含量中扣去GSH含量即为P-SH的含量。
1.3 数据处理
色谱数据处理是利用安捷伦公司HP-1100工作站软件驱动,数据处理利用Origin 6.0画图和数据处理软件。
2 结果与讨论
2.1 色谱测定
为了探讨本实验条件下,Cys及GSH中的巯基与DTNB衍生化反应及色谱特性,用Cys和GSH标准品,在过量DTNB(1.0×10-4mol/L)的pH=7的PBS混合溶液中,分别测定了GSH(2.5×10-4mol/L)+DTNB混合溶液、GSH(1.0×10-4mol/L)+Cys(1.0×10-4mol/L)+DTNB混合溶液的色谱图,结果见图2。

图2 GSH(A)、GSH+Cys(B)与DTNB混合PBS缓冲溶液的色谱图Fig.2 Chromatograms for the mixture solutions of DTNB and GSH(A),GSH+Cys(B)in PBS buffer

图3 开心果提取液(A)及该提取液加标GSH和Cys后的色谱图(B)Fig.3 Chromatograms for pistachio extract(A) and for the extract spiked with GSH and Cys(B)
如图2所示,一定浓度的GSH和过量DTNB衍生化反应后,分别观察到衍生化产物GS-TNB、Cys-TNB、NTB及剩余DTNB的色谱峰。从所测定的衍生化产物的色谱峰强度分析(见表1)发现:a.在等量的GSH和Cys混合溶液中,对应的衍生化产物GS-TNB和Cys-TNB的色谱峰强度相近(色谱峰面积分别为356.4和373.2),说明在选定检测器波长下,两种衍生化产物的光谱特性相近;b.衍生化产物NTB色谱峰强度分别与GS-TNB及GS-TNB和Cys-TNB之和的色谱峰强度之比为0.8294(ANTB/AGS-TNB)和0.8355[ANTB/(AGS-TNB+ACys-TNB)],因两者比值非常接近,说明定量释放的NTB的色谱峰强度只与巯基的量有关,而与GSH和Cys的碳骨架结构无关,即定量释放的NTB的量只与半胱氨酸残基中巯基数目有关。
图3~图6分别为四种坚果提取液样品及该样品中加标GSH(1.0×10-4mol/L)和Cys(1.0×10-4mol/L)之后的色谱测定结果。

图4 巴旦木提取液(A)及该提取液加标GSH和Cys后的色谱图(B)Fig.4 Chromatograms for prenus duleis extract(A) and for the extract spiked with GSH and Cys(B)
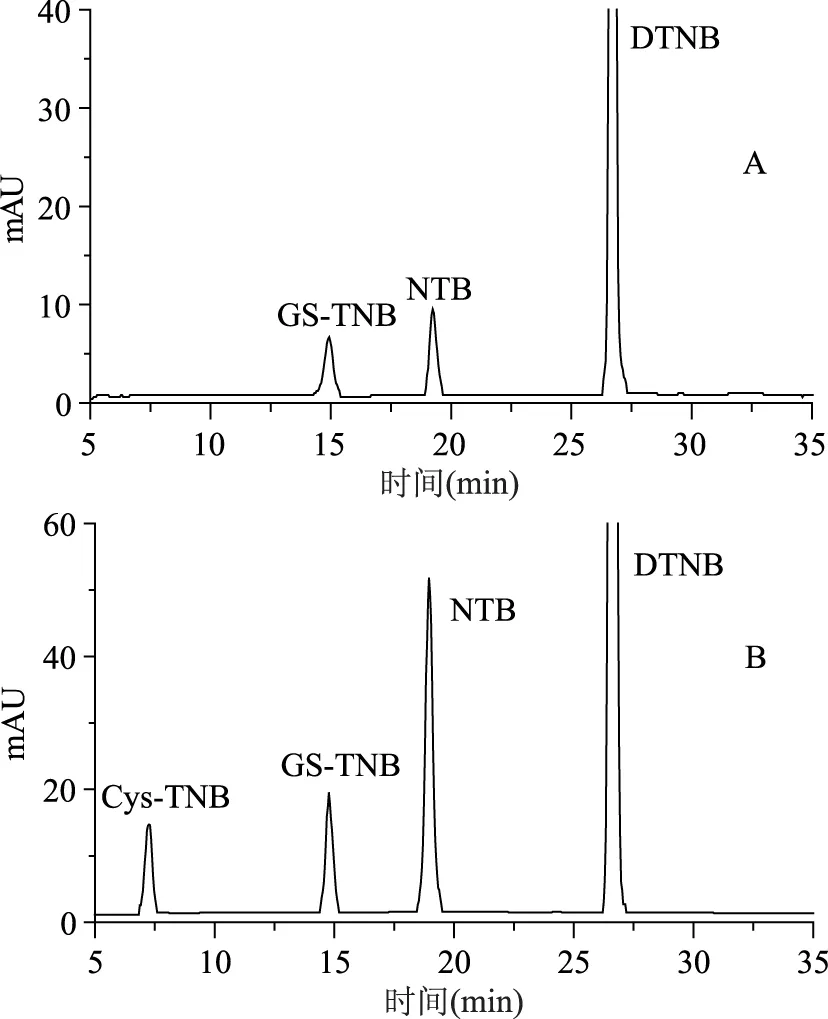
图5 澳洲坚果提取液(A)及该提取液加标GSH和Cys后的色谱图(B)Fig.5 Chromatograms for macadamias extract(A) and for the extract spiked with GSH and Cys(B)
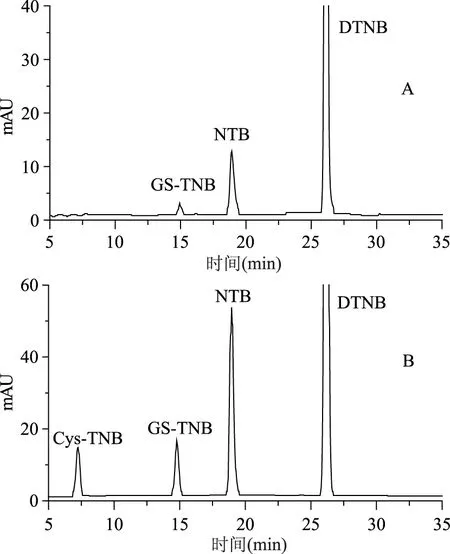
图6 腰果提取液(A)及该提取液加标GSH和Gys后的色谱图(B)Fig.6 Chromatograms for cashew nut extract(A) and for the extract spiked with GSH and Cys
如图3~图6所示,四种坚果提取液中观察到GS-TNB和NTB的色谱峰而观察不到Cys-TNB的色谱峰,而对此样品加标Cys和GSH后明显观察到Cys-TNB和增加的GS-TNB的色谱峰,即样品中检测不到Cys含量,说明样品中水溶性小分子巯基化合物只含有能检测到的GSH。对样品中衍生化产物的色谱峰强度进行了比较分析,结果见表2。
从表2的结果发现:样品中除了澳洲坚果NTB色谱峰面积略大于GS-TNB的色谱峰面积之外,其它的坚果样品前者的色谱峰面积远大于后者的色谱峰面积,其对应的NTB的色谱峰面积和GS-TNB峰面积之比(ANTB/AGS-TNB)分别为:开心果3.34,巴旦木4.84,澳洲坚果1.14,腰果6.46,且该比值均较图2B中的两者峰面积之比0.8355大,说明样品中含有较多的含半胱氨酸残基的蛋白巯基且该蛋白巯基导致与DTNB反应并释放出额外的NTB,使其色谱峰面积增大。

表2 坚果提取液中衍生化产物色谱峰强度比较Table 2 Chromatograms of derivatized products obtained from nut extracts
2.2 衍生化产物的稳定性
由于样品测定中色谱流出时间较长,样品制备后需放置较长时间,这就需要样品衍生化产物在工作时间内必须要稳定。表3为GSH、Cys及开心果提取液衍生化反应后,放置不同时间后测得的各目标衍生化产物的色谱峰面积和相对标准偏差。
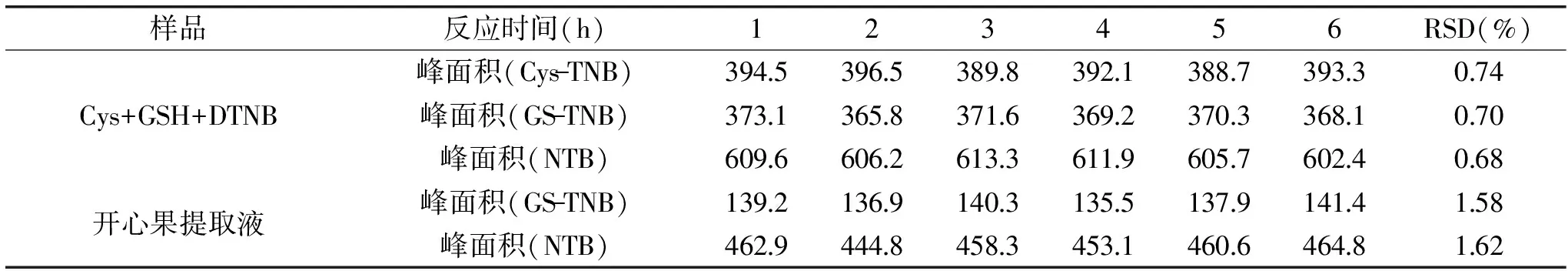
表3 不同反应时间后衍生化产物色谱峰强度变化及RSDTable 3 Deviations of chromatograms for the derivatized products with different time durations
表3的结果表明:无论在标准混合溶液或样品提取液中,衍生化产物的色谱峰面积在6 h之内变化并不明显,其色谱峰面积变化的相对标准偏差在0.68%~1.62%范围,说明衍生化产物在测定工作时间范围内基本稳定,满足准确测定的要求。
2.3 回收率和检测限
检测限:配制5.0×10-4mol/L的GSH溶液,用PBS缓冲溶液逐级稀释后在本实验确定的最佳衍生化条件下与DTNB进行衍生化反应后进样分析,记录色谱图,以S/N=3时的相应对照品进样量为检测限,GSH和-SH的检测限分别为0.1386 μmol/g和0.2184 μmol/g。采用加标回收率来进一步验证测定方法的准确度,分别量取一定量的坚果样品提取液,然后再分别加入一定体积不同浓度的GSH标准溶液,根据上文中所述的GSH和总-SH的HPLC测定结果分别对加标回收率进行计算,方法的回收率介于99.37%~101.45%之间,满足准确测定的要求。

表4 四种坚果中GSH、总巯基(-SH)、蛋白巯基P-SH测定结果Table 4 The amouts of GSH and total thiol as well as protein thiols detected in four different nuts
2.4 坚果中还原型谷胱甘肽与总巯基的含量
利用新配制的含有过量衍生化试剂DTNB(1.0×10-2mol/L)的PBS缓冲液分别配制不同浓度的GSH的标准系列溶液进行HPLC测定。实验结果表明:GSH的衍生化产物(GS-TNB)及总巯基(-SH)的衍生化产物(NTB)的色谱峰面积均与标准品GSH的浓度呈良好线性关系。图7为利用该线性关系制作的校正曲线和线性回归方程。

图7 GSH(A)和总巯基(B)含量测定的校正曲线Fig.7 Calibration pots for the detection of GSH(A)and total thiols(B)
如图7所示,利用此线性关系平行测定三次,线性回归方程分别为A=-5.01222+35.20443C和A=-51.87237+32.34489C,相关系数r分别为0.99996和0.99994。利用此校正曲线平行测定坚果样品中的GSH和总-SH含量,结果见表4。
从表4中结果发现:四种坚果中均含有丰富的GSH和P-SH,其中开心果中蛋白巯基含量最高,达3.5414 μmol/g,澳洲坚果中GSH含量最高,达1.5708 μmol/g。
3 结论
利用DTNB衍生化试剂,采用细胞破壁、衍生化为一体的同步前处理方法,避免了提取过程中胞外氧化性环境对巯基氧化变性导致的衍生化效率降低引起的灵敏度降低或漏检,并用HPLC法首次测定了四种坚果中GSH和P-SH中的巯基含量,其含量分别为,开心果:GSH(1.2303±0.01126) μmol/g,P-SH(3.5414±0.0531) μmol/g;巴旦木:GSH(0.3069±0.0185) μmol/g,P-SH(1.9001±0.0194) μmol/g;澳洲坚果:GSH(1.5708±0.0216) μmol/g,P-SH(0.5905±0.0238) μmol/g;腰果:GSH(0.3373±0.0047) μmol/g,P-SH(2.2458±0.0225) μmol/g。测定结果发现:开心果中GSH和P-SH的含量均较高,澳洲坚果中GSH的含量较高,但P-SH含量相对较少,巴旦木和腰果中含有较低的GSH,但均含有较高的P-SH。本测定结果说明,上述坚果中的GSH含量均比目前所测定的大部分食材中的GSH含量高[15],而且也提供了坚果中游离蛋白巯基含量的信息,说明坚果的防病治病的活性功能也可能与其含较丰富的活性巯基化合物有关,这也为功能性食材与巯基化合物的功效关系的研究提供了重要的参考数据。
[1]Yang J. Brazil nuts and associated health benefits:A review[J]. LWT-Food Science and Technology,2009,42:1573-1580.
[2]刘成梅,王芳,钟俊桢,等. 腰果蛋白的功能特性研究及其氨基酸组成分析[J].食品工业科技,2016,37(2):88-92.
[3]Chang S K,Alasalvar C,Bolling B W,et al. Nut and their co-products:the inpact of procedding(roasting)on phenolics,bioavailability and health benefits-A Comprehensive review[J]. Journal of Functional Foods,2016,26:88-122.
[4]卢静茹,林向阳,张如,等. HS-SPME-GC-MS联用分析美国巴旦木香气成分[J]. 食品科学,2015,36(2):120-125.
[5]Deponte M. Glutathione catalysis and the reaction mechanisms of glutathione-dependent enzymes[J]. Biochimica et Biophysica Acta,2013,1830:3217-3266.
[6]Winterbourn C C. Revisiting the reactions of superoxide with glutathione and other thiols[J]. Archives of Biochemistry and Biophysics,2016,595:68-71.
[7]金春英,崔京兰,崔胜云. 氧化性谷胱甘肽对还原型谷胱甘肽清除自由基的写工作用[J]. 分析化学,2009,37(9):1349-1353.
[8]陈亚琴,印大中. 氧化应激衰老与氧化电位的迷思[J]. 国际老年医学杂志,2011,32(1):13-20.
[9]Bachhawat A K,Thakur A,Jaspreet K,et al. Glutathione transporters[J]. Biochimica et Biophysica Acta,2013,1830:3154 - 3164.
[10]Schmitt B,Vicenzi M,Garrel C,et al. Effects of N-acetykcysteube,oral glutathione(GSH)and novel sublingual form of GSH on oxidative stresss:A comparative crossover study[J]. Redox Biology,2015,6:198-205.
[11]Loguercio C,Taranto D,Vitale L M,et al. Effect of liver cirrhosis and age on the gluthione concentration in the plasma,erythrocytes,and gastric mucosa of man[J]Free Radic Biol Med,1996,20:483-488.
[12]Giugliano D,Ceriello A,Paolisso G. Diabites mellitus,hypertension and cardiovascular deseae:which role for oxidative stress[J]. Metabolism,1995,44:363-368.
[13]Gul M,Kutay F Z,Temocin S,et al. Cellular and clinical implicatioins of glutathione[J]. Indian J Exp Biol,2000,38:625-634.
[14]魏斌,李鹏,崔胜云. HPLC法测定莲子中还原型谷胱甘肽(GSH)和总巯基(-SH)含量[J]. 食品研究与开发,2015,36(8):68-72.
[15]郑建仙.功能性食品[M]. 北京:中国轻工业出版社,1995:348.
Dertermination of reduced glutathione(GSH)and thiols in proteins(P-SH) in 4 kinds of nuts by high performance liquid chromatography(HPLC)
LIU Chang,YING Yi-xian,QIU Yue,CUI Sheng-yun*
(Key Laboratory of Natural Resources & Functional Molecules of
Changbai Mountain of Ministry of Education,Yanbian University,Yanji 133002,China)
The contents of reduced glutathione(GSH)and protein thiols in prunus duleis,cashew nut,pistachio nut,macadamia nut were detected by pre-column derivatization HPLC method using 5,5′-dithio-bis-2-nitrobenzoic acid(DTNB)as derivatizing agent with concomitant cell rupture sample pretreatments. The results showed that detected nuts contained relatively abundant GSH and thiols in P-SH. The amounts detected were GSH(1.2303±0.01126) μmol/g,P-SH(3.5414±0.0531) μmol/g for pistachio nut,GSH(0.3069±0.0185) μmol/g,P-SH(1.9001±0.0194) μmol/g for prenus duleis,GSH(1.5708±0.0216) μmol/g,P-SH(0.5905±0.0238) μmol/g for macadamia nut,GSH(0.3373±0.0047) μmol/g,P-SH(2.2458±0.0225) μmol/g for cashew nut respectively. The recoveries of the methods were 99.37%~101.45%,and detection limits were 0.1386 μmol/g for GSH and 0.2184 μmol/g for protein thiols. The results provided a useful data for the application of these nuts for the healthcare.
HPLC;nuts;glutathione;thiol compounds
2016-12-20
刘畅(1991-),女,在读硕士研究生,研究方向:植物活性成分分析,E-mail:1007687550@qq.com。
*通讯作者:崔胜云(1957-),男,博士,教授,研究方向:植物活性成分分析,E-mail:huaxuexi@ybu.edu.cn。
国家自然科学基金资助项目(21165021)。
TS255.6
A
1002-0306(2017)14-0001-06
10.13386/j.issn1002-0306.2017.14.001
