基于金属有机骨架材料固载的碲化镉量子点作为信号探针测定心肌肌钙蛋白的电致化学发光免疫传感器
2017-08-09何晓静彭玲芝余燕清
何晓静,蒋 伟,周 雪,彭玲芝,余燕清,卓 颖*
(1.重庆医科大学超声影像学研究所,重庆医科大学附属第二医院,重庆400010)
(2.重庆市纳米材料及传感技术工程实验室,西南大学化学化工学院,重庆400715)
基于金属有机骨架材料固载的碲化镉量子点作为信号探针测定心肌肌钙蛋白的电致化学发光免疫传感器
何晓静1*,蒋 伟1,周 雪1,彭玲芝2,余燕清2,卓 颖2*
(1.重庆医科大学超声影像学研究所,重庆医科大学附属第二医院,重庆400010)
(2.重庆市纳米材料及传感技术工程实验室,西南大学化学化工学院,重庆400715)
该研究基于金属有机骨架材料(MOFs)固载的碲化镉量子点(CdTe QDs)作为信号探针构建了电致化学发光(ECL)免疫传感器用于心肌肌钙蛋白I(cTnI)的检测。具体来讲,在合成MOFs过程中加入CdTe QDs,制得CdTe@MOFs,随后利用CdTe@MOFs外面的氨基与CdTe QDs的羧基交联,制备出CdTe@MOFs/ CdTeQDs复合物,再利用该复合物中CdTe QDs剩余的羧基与二抗 (Ab2)中氨基交联,从而制备出CdTe@MOFs/CdTeQDs/Ab2生物探针。电极敏感界面的构建是首先在裸玻碳电极上修饰一层金纳米颗粒,来固载cTnI的第一抗体(Ab1),再用BSA封闭其非特异性结合位点,从而制得了ECL免疫传感器。基于夹心型反应模式,此免疫传感器实现了对cTnI的灵敏检测且线性响应达8个数量级(1.1 fg/mL至11 ng/mL)。
CdTe量子点;金属有机骨架材料;夹心免疫法;心肌肌钙蛋白I;电致化学发光
0 引言
心肌肌钙蛋白[1-3](cardiac troponin,cTn)是心肌肌肉收缩的调节蛋白,存在于心肌收缩蛋白的细肌丝上。肌钙蛋白的作用之一是把原肌凝蛋白附着于肌动蛋白上,三者共同组成细肌丝。cTn是由三种不同基因的亚基组成:心肌肌钙蛋白T(cTnT)、心肌肌钙蛋白I(cTnI)和肌钙蛋白C(cTnC),其中cTnI在外周血中含量极少。当发生心肌损伤时,心肌细胞破裂,cTnI释放并进入血液循环系统,是近年发展起来的高灵敏度、高特异性的血清标志物,具有在血中出现早、持续时间长的特点。因此准确测定人血中的cTnI对于诊断急性心肌梗死、急性冠状动脉综合征的危险分层、监测各种因素所导致的心肌损伤,以及心脏事件的判断预后等有重要意义。因此,在患病的早期阶段,高效、低浓度、快速的检测出cTnI尤为重要。
迄今为止,检测cTnI的化学方法主要有荧光免疫分析法[4]、化学发光酶免疫分析法[5]、电化学发光免疫分析法等[6]。荧光免疫分析法存在的主要问题是抗原或者抗体在标记发光物质后发生特异性免疫反应后的性能可能改变,并且每次标记发光物质的标记率很大。化学发光酶免疫分析具有酶免疫分析的主要优点,保留了化学发光的高灵敏度,但是酶的催化效果受外界条件的影响较大,不稳定。电致化学发光技术是电化学与化学发光相结合的检测技术,它具有仪器设备简单、操作方便、易于实现自动化、灵敏度高、选择性高、重现性好、抗干扰能力强、线性响应范围宽和分析速度快等特点[7]。其有着突出的优点,如标记物稳定,灵敏度高,可实现多元检测及均相免疫分析,因而日益受到别人的重视。目前已经广泛应用于抗原、半抗原及抗体等的免疫检测。常见的电致化学发光试剂[8]主要有Ru(bpy)32+及其衍生物、Luminol及其衍生物和半导体纳米材料如量子点(quantum dots,QDs)等。量子点凭借发光效率高,ECL具有可调性,发光体系温和稳定,不易光漂白,具有较好的生物兼容性等备受青睐[9]。同时由于量子点表面可通过配位连接或聚合物修饰等方面包覆上有机分子或生物大分子,所以QDs常用做生物探针应用到酶、抗原抗体、小分子键合蛋白和适配体的生物传感器中。因此,在目前的ECL生物传感器应用中,实现对QDs的固载尤为关键。
金属有机骨架材料[10](MOFs)是一种由金属簇与具有刚性的有机配体分子所形成的零维、一维或多维的多孔晶态化合物,一般以金属离子为连接点,以有机配位体为连接点,以有机配体为支撑,以此来筑构3D空间网络结构。MOFs结构相对稳定,且配体中包含多个N、O原子,有很强的配位能力和丰富的配位模式,通常具有较大比表面积,可调节的孔尺寸和孔形状等特点。因此可应用为理想的固载材料,事实上,在之前的报道中,MOFs已实现了对电活性物质[11]、生物聚合物[12]、纳米粒子、蛋白等[13]的固载。由于QDs特殊的性能,已成功地实现了与MOFs的不同方式组装。常见的方式有“ship inabottle”、“bottlearound ship”和直接在MOFs外面修饰上QDs[14-15]。为了提高ECL免疫传感器的灵敏度,该文结合了后两种方式来实现QDs的固载。
该文以cTnI为蛋白质模型,构建了一种基于CdTe QDs电致化学发光超灵敏免疫传感器。实验首先在合成MOFs过程中加入CdTe QDs,制得CdTe@MOFs,随后利用CdTe@MOFs外面的氨基与CdTe QDs的羧基交联, 制备出CdTe@MOFs/CdTeQDs复合物,再利用该复合物中CdTe QDs剩余的羧基与二抗(Ab2)中氨基交联,从而制备出CdTe@MOFs/CdTeQDs/Ab2生物探针,该探针具有很强的ECL信号,用于提高检测的灵敏度,作为该实验的一大亮点,可以实现对一定浓度范围内的cTnI检测。实验证明,根据此原理制备的电极可以有效的检测cTnI,检测限低,灵敏度高,线性范围宽,结果令人满意。
1 实验部分
1.1 实验试剂
心肌肌钙蛋白抗体(Ab1,Ab2)和心肌肌钙抗原 (cTnI)(郑州赛博生物工程有限责任公司提供);过硫酸钠(分析纯AR)(成都市科龙化工试剂厂提供);磷酸盐缓冲液(PBS)(pH值7.4,0.1 mol/L);CdCl2·2.5H2O、Na2TeO3、巯基丙酸(MPA)、氯金酸(HAuCl4)、铁氰化钾(化学试剂有限公司(中国四川))、牛血清白蛋白(BSA,96%~99%)、人体血清样品(重庆市西南医院提供)、无水乙醇溶液、邻苯二甲酸二乙二醇二丙烯酸酯(PDDA)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)(延长生化技术有限公司-上海);N-羟基琥珀酰亚胺(NHS)(延长生化技术有限公司-上海),聚乙烯吡咯烷酮 (PVP)、2-氨基对苯二甲酸 (2-NH2-DBC)、N,N-二甲基甲酰胺(DMF)、Na2S2O8(上海康达氨基酸厂)、柠檬酸三钠、硼氢化钠、其他试剂如Na2HPO4、KH2PO4、KCl、ZnNO3·6H2O均为分析纯试剂。实验用水均为二次去离子水。
1.2 实验仪器
MPI-A型毛细管电泳电化学发光检测仪(西安瑞迈分析仪器有限公司、中科院长春应用化学研究所);CHI610A型电化学工作站(上海辰华仪器公司);FA-2004A FA/JA系列电子天平(Metter Toledo公司);BRANSONIC 200超声清洗仪(德国BRANSON ULTRASCHALL公司);烘箱;反应釜移液枪(成都方舟科技开发公司)。JBZ-12H磁力搅拌器;三电极体系:玻碳电极(GCE,Φ=4mm)及其修饰电极为工作电极,饱和甘汞电极为参比电极,铂丝为对电极。
1.3 实验方法
1.3.1 CdTeQDs的制备
CdTe QDs是根据先前报道的方法合成的[16]。首先将36.89mg CdCl2·2.5H2O溶解在50mL二次去离子水中,随后在搅拌下加入50mg柠檬酸钠固体,1 mL Na2TeO3溶液 (0.01 mol/L),33μL MPA,搅拌溶解后,再迅速加入100mg NaBH4。然后将上述溶液转入圆底烧瓶中接上冷凝管,将温度设置为130℃,回流10 h。溶液颜色逐步从无色变为橘红色,便制得了CdTe QDs溶液,自然冷却后,用无水乙醇离心洗涤三次,重新将CdTe QDs分散于二次去离子水中,并将其放置于4℃下避光保存备用。
1.3.2 MOFs/CdTeQDs/Ab2生物探针的制备
首先,将0.2 g PVP溶于11mL的DMF和7 mL乙醇中,制备溶液①;其次,将0.11155 g Zn(NO3)2·6H2O和0.02715 g 2-NH2-DBC溶于4 mLDMF中,超声溶解,倒入上述制得的溶液①中,混合之后,超声20min,放入反应釜加热12 h,设置温度为100℃。制备的溶液用甲醇洗涤三次,将MOFs分散于二次去离子水中;
然后,取制备的CdTeQDs1mL于干净的烧杯中,加入EDC/NHS(4∶1)后在4℃下搅拌40min,再加入500μL制备的MOFs,在4℃下搅拌过夜,制得MOFs/CdTeQDs溶液,离心洗涤1次,分散于二次去离子水中稀释至原体积,放于冰箱4℃储存。
取制备好的1mLMOFs/CdTeQDs加入干净的烧杯中,加入EDC/NHS(4∶1)在4℃下搅拌活化40min,加入二抗(Ab2)33μL,在4℃下搅拌过夜后,便制得MOFs/CdTeQDs/Ab2溶液,离心后重新分散在二次去离子水中,置于4℃下备用。
1.3.3 沉积金电极的制备
在电极修饰之前,首先将玻碳电极(GCE,Φ =4mm)分别用0.3及0.05μm的三氧化二铝(Al2O3)粉在麂皮上打磨、抛光,然后用蒸馏水洗净并依次用乙醇和蒸馏水超声清洗干净。最后将其置于室温下晾干燥备用。首先将清理好的电极置于氯金酸(HAuCl4,1%)中,并在-0.2的恒电位下电沉积30 s,使电极表面形成一层均匀的纳米金(AuNPs)。
1.3.4 传感器的制备
电极的自组装过程:在金纳米粒子修饰的电极表面滴入10μL的Ab1,在4℃静止12 h,用蒸馏水漂洗,在电极表面加入15μL的BSA,于4℃下静置40min后,于蒸馏水中漂洗,在电极表面滴入15μL的cTnI,静置40min后漂洗,于电极上滴入15μL放置1 h后漂洗,制得修饰电极。传感器构建过程示意图见图1。
1.3.5 测试方法
实验测量采用三电极体系:经修饰的玻碳电极为工作电极,Ag/AgCl(饱和KCl溶液)作为参比电极,铂丝为对电极。在3mL含有0.01mol/L Na2S2O8的0.1mol/L PBS(pH=7.4)溶液中,采用MPI-A型电致化学发光分析系统对所修饰电极的电致化学发光行为的研究。电位扫描范围为-1.5V~0 V,以200mV/s电位扫描速度施加循环伏安(CV)扫描模式和电致化学发光(ECL)检测,除特别说明温度均控制为室温。
2 结果与讨论
2.1 实验条件的优化

图1 ECL传感器构建示意图Fig.1 The operating principle of ECL sensing system
2.1.1 Ab1和cTn I作用时间对传感器性能的影响在生化分析中,温度对生物活性物质也就是对抗体和抗原的活性有着重要的影响,考虑到传感器的寿命这个非常重要的因素,通常选用室温作为测试条件,免疫传感器免疫反应完成的程度与抗原抗体结合时间有关。在室温下,实验中考察了一抗和抗原作用时间对修饰电极的影响,将修饰有BSA/Ab1/Dp-Au的免疫传感器,在电极表面滴入15μL 11 ng/mL的cTnI,孵育时间分别为10min、20min、30min、40min、50min、60min、70 min、80min,利用CV循环伏安法,在0.1mol/L K3Fe(CN)6溶液中,电位扫描范围为-0.2~0.6 V,扫数速率为100mV/s,由图2可知,当小于40min,随着时间增加,电流逐渐下降;当时间达到40 min,响应电流趋于不变;表明抗体与抗原结合基本达到稳定,因此实验对Ab1和cTnI最佳孵育时间为40min。

图2 Ab1和cTnI作用时间对传感器性能的影响Fig.2 Effectof the interaction time between Ab1and cTnI
2.1.2 cTn I与CdTe@MOFs/CdTeQDs/Ab2相互作用时间
在Ab1与cTnI最佳作用时间下,研究了cTnI与MOFs/CdTeQDs/Ab2相互作用时间,在修饰上有Ag/BSA/Ab1/Dp-Au的电极上,滴加MOFs/CdTeQDs/Ab220μL,分别孵育20min、40 min、60 min、80 min、100 min、120 min, 在10 mmol/L的Na2S2O8溶液中进行ECL扫描。结果如图3所示,当时间小于80min,传感器ECL强度随着时间增加而增强;当时间达到80min后,传感器ECL强度随着时间变化较为稳定,cTnI与MOFs/CdTeQDs/Ab2最佳孵育时间为80min。
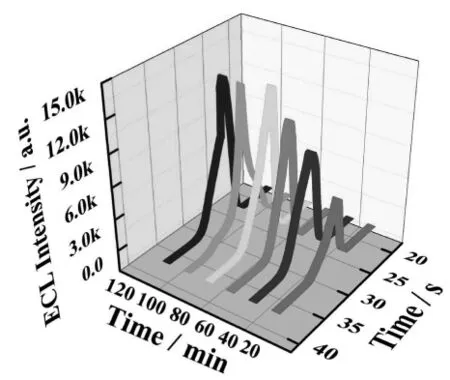
图3 cTnI与MOFs/CdTeQDs/Ab2相互作用时间Fig.3 Effectof the interaction time between cTnIand MOFs/CdTeQDs/Ab2
2.2 双抗夹心电致化学发光免疫传感器修饰电极表征
2.2.1 修饰电极的CV表征
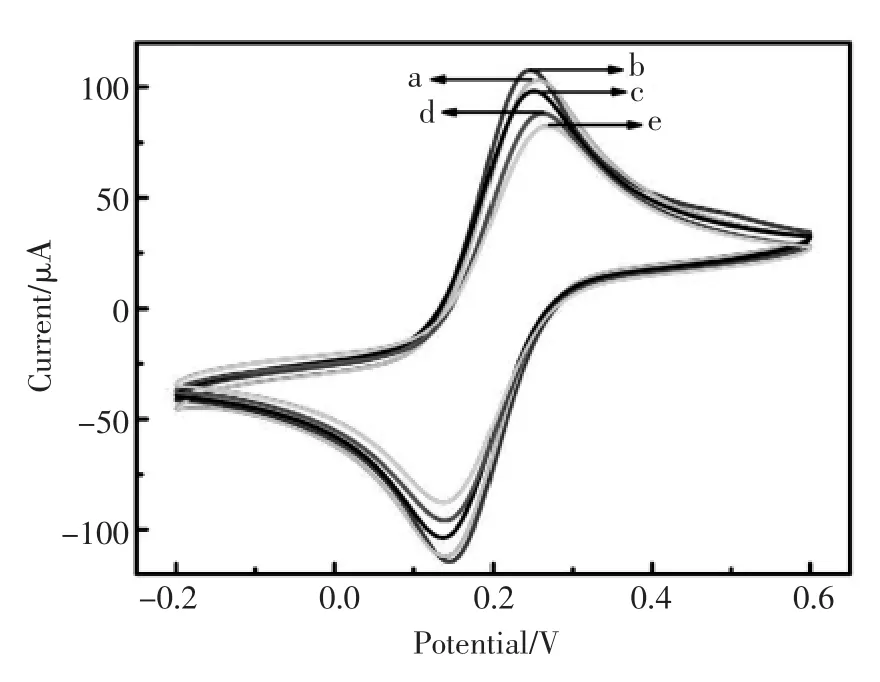
图4 传感器的CV表征(a.裸电极;b.Dp-Au/裸电极;c.Ab1/Dp-Au/裸电极;d.BSA/Ab1/Dp-Au/裸电极;e.cTnI/BSA/Ab1/Dp-Au/裸电极)Fig.4 Cyclic voltammogramsofvariousmodified electrodes in 0.1mol/LK3Fe(CN)6/K4Fe(CN)6solution:(a) bare GCE;(b)Dp-Au/GCE;(c)Ab1/Dp-Au/GCE;(d)BSA/ Ab1/Dp-Au/GCE;(e)cTnI/BSA/Ab1/Dp-Au/GCE
以修饰有不同物质的玻碳电极为工作电极,于含有0.1mol/L的Fe(CN)63-/Fe(CN)64-溶液中,在-0.2 V~0.6 V的电位范围内进行循环伏安(CV)电化学表征。由图4可以观察到,裸电极(曲线a)在测试底液中有一对对称的可逆氧化还原峰。当在裸电极表面沉积了一层金之后,循环伏安峰电流增强,这是由于金纳米粒子的促进电子传递作用。当电极孵育Ab1后,由于蛋白质大分子阻碍了电子传输,电流减弱(曲线c),用牛血清蛋白(BSA)封闭电极表面的非特异性吸附点,峰电流值降低(曲线d),当电极孵育上cTnI后,与抗体Ab1结合后,他们发生特异性免疫反应形成免疫复合物,进一步阻碍了电子传输,峰电流值降低(曲线e)。
2.2.2 电化学阻抗表征
电化学阻抗谱是一个有效的用来表征电极表面修饰过程以及探测电极表面特点的工具。阻抗图包含了半圆,半圆的直径对应的是电子传递阻力,图5表示了电极在不同的修饰阶段的电化学阻抗情况。如图可以看出当电极清洗干净没有修饰任何东西时候,它的阻抗图谱显示如曲线a。当电极修饰了Dp-Au,如曲线b半圆的直径减小,主要是Dp-Au在电极表面增强了氧化还原探针的电子传递动力学,电阻减小。而电极表面依次修饰了Ab1、BSA和cTnI后,电极表面的阻力依次增大 (曲线c~e),这是由于Ab1、BSA和cTnI具有阻碍电子传输的能力。

图5 修饰电极的交流阻抗图Fig.5 The impedance ofvariousmodified electrodes in 0.1 mol/LK3Fe(CN)6/K4Fe(CN)6solution:(a)bare GCE electrode; (b)Dp-Au/GCE;(c)Ab1/Dp-Au/GCE;(d)BSA/Ab1/Dp-Au/ GCE;(e)cTnI/BSA/Ab1/Dp-Au/GCE
2.3 免疫传感器的响应性能

图6 (A)ECL信号(cTnI的浓度分别为a.1.1×10-6ng/mL,b.1.1×10-5ng/mL,c.1.1×10-4ng/mL,d.1.1×10-3ng/mL,e.0.011 ng/mL,f.0.11ng/mL,g.1.1ng/mL,h.11ng/mL)(B)线性拟合图表Fig.6 (A)ECLsignal(cTnIconcentrationwerea.1.1×10-6ng/mL,b.1.1×10-5ng/mL,c.1.1×10-4ng/mL, d.1.1×10-3ng/mL,e.0.011 ng/mL,f.0.11 ng/mL,f.0.011 ng/mL,g.1.1 ng/mL,h.11 ng/mL)(B)Linear fitting chart
在最优条件下,采用循环伏安法对免疫传感器的响应性能进行考察。如图6所示。将修饰有Ab2/CdTeQDs/MOFs/cTnI/BSA/Ab1/Dp-Au的免疫传感器分别浸在不同浓度的cTnI中孵育后,在0.01mol/L的NaS2O8溶液中,测得对应的稳定后的ECL强度随着抗原浓度的不断增加而逐渐增加。该传感器在1.1 fg/mL至11 ng/mL范围内呈现良好的线性关系,其线性回归方程:I=1881log c+7979(c为cTnI的浓度pg/mL),相关系数为r=0.9979,检测限为0.33 fg/mL,信噪比为S/N=3。
2.4 免疫传感器的稳定性
此外,对该免疫传感器的操作稳定性进行了评估。将免疫传感器在0.01mol/L缓冲溶液中进行连续10圈的ECL扫描。从图7可以看出,其ECL响应的相对标准偏差(RSD)为0.11%,表明对cTnI的检测具有良好的操作稳定性。

图7 ECL信号稳定性(cTnI溶液的浓度为1.1 fg/mL)Fig.7 ECL signalstability(cTnIsolution concentration were 1.1 fg/mL)
3 结论
综上所述,该文利用MOFs作为CdTe QDs固载基质构建了一个新型信号探针MOFs/ CdTeQDs/Ab2,并构建了高灵敏的免疫传感器实现了对cTnI的检测。值得指出的是,该信号探针是在MOFs合成过程中和合成后两次加入CdTe QDs,提高了CdTe QDs的固载量,从而该探针具有很强的ECL信号。基于夹心免疫反应,cTnI免疫传感器展现了在1.1 fg/mL~11 ng/mL检测范围内令人满意的分析性能,以及良好的稳定性。鉴于上述优点,该免疫传感器将在疾病诊断和临床分析领域具有较大的应用潜力。
[1]王忠诚,沈均乐,王强,等.心肌肌钙蛋白I的检测方法及临床应用进展[J].国外医学临床生物化学与检验学分册,2004,25:303-306.
[2]李琳,王龙安,朱娟,等.快速检测心肌肌钙蛋白T在急性心肌梗死诊断中的应用[J].现代预防医学,2013, 40:538-540.
[3]宋健,范佳,宋大千,等.量子点偶联抗体型夹心免疫法检测及肌钙蛋白[J].高等学校化学学报,2009,30: 1940-1945.
[4]张杰,卢玲玲,潘晓夫,等.时间分辨荧光免疫分析法检测心肌肌钙蛋白I方法学的建立及临床应用[J].中国免疫学杂志,2014,8:1093-1097.
[5]郭会时.人心肌肌钙蛋白I的几种检测方法及研究应用[D].南京:东南大学,2005.
[6]郭会时.化学发光酶免疫分析法检测人血清中cTnI的研究[J].光谱学与光谱分析,2006,26:291-292.
[7]王晓英.基于电致化学发光技术的纳米生物传感器的设计和研究[D].上海:华东师范大学,2008.
[8]朱晓燕.基于联吡啶钌的电致化学发光新方法研究[D].南昌:南昌大学,2011.
[9]陆家贤,任颜卫.金属-有机骨架材料后合成修饰的催化应用[J].广东化工,2013,40:75-77.
[10]付艳艳,严秀平.金属-有机骨架材料[J].化学进展, 2013,25(3):221-223.
[11]Xie S B,Ye JW,Yuan Y L,et al.Multifunctional hemin@metal-organic framework and its application to constructan electrochemical aptasensor for thrombin detectiont[J].Nanoscale,2015,43:18232-18238.
[12]张慧,周雅静,宋肖楷.基于金属-有机骨架前驱体的先进功能材料[J].化学进展,2015,27(3):174-191.
[13]Liu J,Strachana DM,Chem PK.Enhanced noblegasadsorption in Ag@MOF-74Ni[J].Chemical Society Reviews,2014,50:466-468.
[14]Aguilera-Sigalat J,Bradshaw D.Synthesis and applications of metal-organic framework–quantum dot (QD@MOF)composites[J].Coordination Chemistry Reviews,2016,307:267-291.
[15]穆亲.量子点荧光探针的设计及检测应用[D].上海:东华理工大学,2014.
[16]Perry Iv JJ,Perman JA,ZaworotkoM J.Design and synthesis ofmetal–organic frameworks usingmetal–organic polyhedra as supermolecular building blocks[J].ChemicalSociety Reviews,2009,38:1400-1417.
An ECL immunesensor based onmetalorganic frameworks carried CdTequantum dotsas the signalprobe for cardiac troponin I detection
He Xiao-jing1*,JiangWei1,Zhou Xue1,Peng Ling-zhi2,Yu Yan-qing2,Zhuo Ying2*
(1.Institute ofUltrasound Imaging ofChongqingMedicalUniversity,The Second Affiliated HospitalofChongqing MedicalUniversity,Chongqing 400010,China)
(2.Chongqing Nanomaterialsand Sensing Technology Engineering Laboratory,College ofChemistry and Chemical Engineering,SouthwestUniversity,Chongqing400715,China)
In thiswork,an electrogenerated chemiluminescence(ECL)immunesensorwas developed usingmetal organic frameworks(MOFs)carried CdTe quantum dots(CdTe QDs)as the signal probe for cardiac troponin I(cTnI) detection.Firstly,the as-prepared CdTe QDswere added during the synthesis of MOFs to form the CdTe@MOFs. Then,the CdTe@MOFswere further used as carriers to immobilize the CdTe QDswith the aid of EDC and NHSas coupling agents to form CdTe@MOFs/CdTeQDs nanocomposites.Subsequently,the resultant nanocomposites of CdTe@MOFs/CdTeQDswere served as tracing tags for assembling Ab2to obtain the signal probes of CdTe@MOFs/ CdTeQDs/Ab2(Ab2bioconjugates).Meanwhile,the Au nanopaticleswere firstmodified onto the surface of a glassy carbon electrode(GCE)for sensing interface construction,which afforded a large surface area formassive Ab1anchoring via Au-Sor Au-N bonding.Based on the“sandwich reaction”strategy,this immunesensor provided an ultrasensitive ECL detection of cTnIwith a linear response about8 ordersofmagnitude(from 1.1 fg/mL to 11 ng/mL).
CdTe QDs;metalorganic frameworks(MOFs);sandwich immunoassay;cTnI;electrogenerated chemiluminescence(ECL)
国家自然科学基金青年科学基金项目(81401382);重庆市卫生计生委医学科研项目(2016MSXM024)
*通信联系人,E-mail:He_xiaojing1006@163.com.Tel.:Fax:023-63693060
