糖肾方对糖尿病性肝损伤的保护作用*
2017-08-09姜雪尔蒋媛媛潘晶杜月光章科娜柴可夫
姜雪尔 蒋媛媛 潘晶 杜月光# 章科娜 柴可夫
1浙江中医药大学基础医学院 浙江 杭州 310053 2浙江中医药大学第二临床医学院 浙江 杭州 310053
实验研究
糖肾方对糖尿病性肝损伤的保护作用*
姜雪尔1蒋媛媛2潘晶1杜月光1#章科娜1柴可夫1
1浙江中医药大学基础医学院 浙江 杭州 310053 2浙江中医药大学第二临床医学院 浙江 杭州 310053
目的:观察糖肾方对糖尿病大鼠肝功能、肝脏病理变化及α-平滑肌肌动蛋白(α-SMA)表达的变化,以探讨其对糖尿病大鼠肝损伤的保护作用及机制。方法:采用高糖高脂饲料联合1%链脲佐菌素(STZ)30mg/kg静脉注射复制2型糖尿病大鼠模型,将造模成功的大鼠随机分为5组(n=8):DM模型组、糖肾方低剂量组、糖肾方中剂量组、糖肾方高剂量组及缬沙坦组。药物干预12周,检测空腹血糖(FBG)、甘油三酯(TG)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)等血清生化指标;放射免疫法检测血清胰岛素(FINS)并计算胰岛素抵抗指数(HOMA-IR);光镜(HE染色和Masson染色)观察肝脏病理学改变;免疫组化技术测定肝脏α-SMA蛋白表达情况。结果:与正常组比较,DM模型组大鼠FBG、TG、ALT、AST、FINS、HOMA-IR均明显升高(P<0.05),病理变化显示肝细胞呈明显脂肪油滴状空泡,局灶性肝细胞坏死,炎细胞浸润,肝小叶间、汇管区、窦周间隙纤维增生明显;免疫组化显示肝星形细胞(HSC),α-平滑肌肌动蛋白(α-SMA)表达增加。经糖肾方或缬沙坦干预后,FBG、TG、ALT、AST、FINS、HOMA-IR明显降低(P<0.05),病变减轻,α-SMA表达减少。结论:糖肾方对糖尿病大鼠的肝损伤具有显著的保护作用,其机制可能与改善胰岛素抵抗和抑制肝星形细胞(HSC)的激活有关。
糖尿病性肝损 伤糖肾方 α-平滑肌肌动蛋白 肝星形细胞 胰岛素抵抗 大鼠
糖尿病是以慢性高血糖为特征的代谢紊乱,糖尿病慢性并发症是糖尿病致死致残的主要原因[1]。近年来,人们逐渐意识到糖尿病除了能引起广为人知的心血管、肾脏、眼等并发症外,肝脏病变也是2型糖尿病(T2DM)的主要并发症。其中,非酒精性脂肪肝病(NAFLD)是糖尿病肝损害的最常见临床表现。随着2型糖尿病发病率升高,NAFLD亦日益增多,由其致肝硬化甚至肝细胞癌的比例逐年上升。本课题组在临床及实验研究中发现糖肾方针对糖尿病患者及大鼠模型具有降脂、抗炎和改善血流变等作用[2-3]。本实验观察糖肾方对糖尿病大鼠糖脂代谢和肝功能的影响,探讨糖肾方对糖尿病肝损伤的保护作用及机制,为其在临床上防治糖尿病肝损伤提供实验依据。
1 材料和方法
1.1 动物及饲料:SPF级健康雄性SD大鼠48只,体质量180±20g,7~8周龄,动物许可证号为SCXX(沪):2008-0016,购自上海西普尔-必凯实验动物有限公司,饲养于浙江中医药大学动物实验中心。常规饲料由浙江省医学科学院提供。高糖高脂饲料由10.0%白砂糖、10.0%熟猪油、0.5%胆固醇、10.0%蛋黄粉及69.5%基础饲料组成,由浙江省医学科学院制作成型及烘焙而成。1.2实验用药及试剂:糖肾方:黄芪18g,葛根、灵芝、女贞子各15g,丹参9g,大黄6g。中药由浙江中医药大学门诊部提供,由浙江省中医院药剂室煎制成含生药1g/ml、2g/ml、4g/ml的浓缩液,4℃冰箱密封保存。缬沙坦:片剂,80mg/片,北京诺华制药有限公司,批号:x1433。链脲佐菌素(STZ),由美国Sigma公司生产,批号B57426。α-平滑肌肌动蛋白(α-SMA)抗体购自Abcam公司。
1.3 糖尿病模型复制:所有大鼠适应性喂养1周后,以1%链脲佐菌素(STZ)30mg/kg尾静脉注射及高糖高脂饲料喂养,1月后检测空腹血糖(FBG),FBG≥11.2mmol/L为T2DM,继续高糖高脂饲料喂养。
1.4 分组及给药:将成模大鼠随机分成DM模型组、糖肾方低、中、高剂量组、缬沙坦组,同时设正常对照组,每组8只。糖肾方低、中、高剂量组分别以糖肾方浓缩剂6.5g·kg-1·d-1、13g·kg-1·d-1和26g·kg-1·d-1灌胃;缬沙坦组给予缬沙坦混悬液25mg·kg-1·d-1灌胃。正常对照组和DM模型组均以生理盐水4ml灌胃,每日1次,连续12周,根据体重变化改变给药剂量。
1.5 标本的采集:各组大鼠末次给药后禁食不禁水24h,称量体重。采用戊巴比妥钠30mg/kg腹腔注射麻醉,行腹主动脉采血,4℃,4000r/min,10min离心,收集血清,用于检测生化指标以及胰岛素含量。处死大鼠,摘取肝脏,称重。取肝组织,部分固定于10%甲醛缓冲液,用于病理形态的检测;部分快速冷冻于液氮,然后置于-80℃超低温冰箱保存备用,用于相关指标检测。
1.6 血清生化指标及胰岛素含量测定:采用全自动生化分析仪测定空腹血糖(FBG)、甘油三酯(TG)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)。血清胰岛素(FINS)含量采用ELISA技术,其步骤严格按照试剂说明书进行;计算胰岛素抵抗指数(HOMA-IR)=FBG× FINS/22.5。
1.7 肝组织病理变化:肝脏组织常规固定脱水、透明、包埋、切片,分别行苏木素-伊红(HE)染色和Masson特殊染色,光镜下观察肝脏病理形态学改变。
1.8 肝脏组织中α-SMA蛋白的表达检测:采用免疫组织化学Envision二步法:切片常规脱蜡水化;煮沸修复抗原;3%过氧化氢封闭内源性过氧化酶;滴加I抗(工作浓度为1:100),4℃孵育过夜。滴加Envision工作液,37℃孵育30min;DAB显色,苏木素复染,常规脱水透明,中性树脂封片。以PBS代替I抗作阴性对照,胞浆内出现棕褐色颗粒为阳性反应,每张切片在高倍镜视野下随机选取5个不同视野,人工计数视野下阳性细胞数。
2 结果
2.1 各组大鼠血清生化指标及胰岛素抵抗指数改变:与正常对照组比较,DM模型组大鼠FBG、ALT、AST、TG、FINS和HOMA-IR明显升高(P<0.05);与DM模型组比较,缬沙坦组和糖肾方各干预组FBG水平下降,其中糖肾方高剂量组下降明显(P<0.05),AST、ALT、TG、FINS和HOMA-IR水平明显下降(P<0.05);与缬沙坦组比较,糖肾方干预组的HOMA-IR水平下降更明显。见表1和表2。
表1 血清中FBG、FINS和HOMA-IR水平比较(±s,n=8)
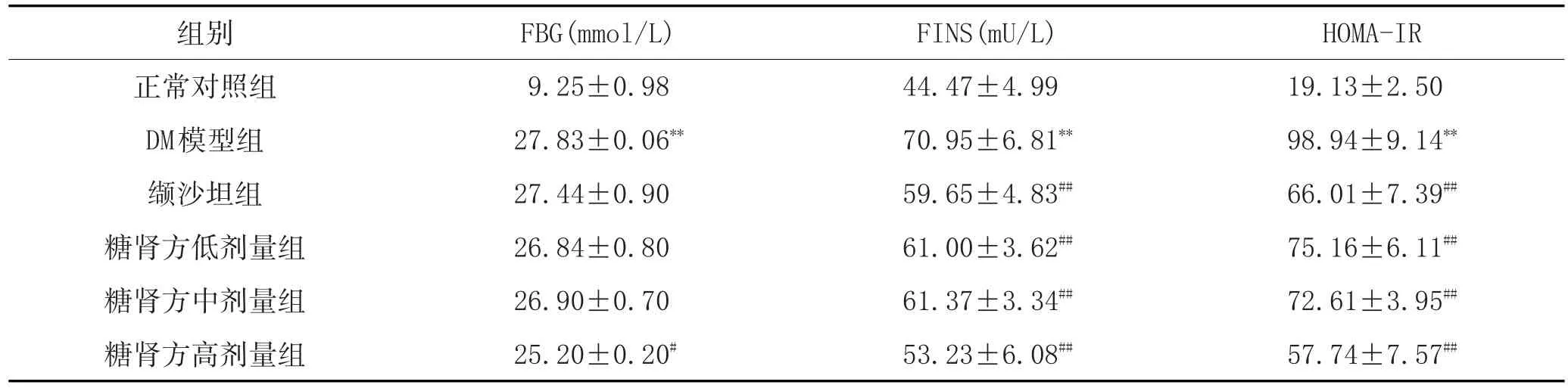
表1 血清中FBG、FINS和HOMA-IR水平比较(±s,n=8)
注:与正常对照组比较,*P<0.05,**P<0.01;与DM模型组比较,#P<0.05,##P<0.01。
HOMA-IR 19.13±2.50 98.94±9.14**66.01±7.39##75.16±6.11##72.61±3.95##57.74±7.57##组别正常对照组DM模型组缬沙坦组糖肾方低剂量组糖肾方中剂量组糖肾方高剂量组FBG(mmol/L) 9.25±0.98 27.83±0.06**27.44±0.90 26.84±0.80 26.90±0.70 25.20±0.20#FINS(mU/L) 44.47±4.99 70.95±6.81**59.65±4.83##61.00±3.62##61.37±3.34##53.23±6.08##
表2 血清中TG、AST和ALT水平比较(±s,n=8)
注:与正常对照组比较,*P<0.05,**P<0.01;与DM模型组比较,#P<0.05,##P<0.01。
ALT(U/L) 44.8±4.2 199.5±95.3*107.5±31.8#128.5±32.9#130.1±20.1#128.4±40.0#组别正常对照组DM模型组缬沙坦组糖肾方低剂量组糖肾方中剂量组糖肾方高剂量组TG(mmol/L) 0.22±0.06 3.56±0.84**1.90±0.71##2.37±0.98#2.11±0.74##1.77±0.75##AST(U/L) 127.5±22.0 174.8±98.6*92.5±20.1#113.1±40.3#107.6±24.8#100.7±37.1#
2.2 各组大鼠肝脏组织病理形态学改变:HE染色显示,正常对照组大鼠肝小叶轮廓清晰完整,肝细胞形态正常;DM模型组大鼠肝细胞呈明显脂肪变,局灶性坏死,坏死区和汇管区可见程度不一的炎症细胞浸润,部分细胞核变型和核偏位。Masson染色显示,正常组大鼠肝组织内血管壁、窦周间隙可见少量胶原纤维,模型组可见窦周间隙以及门管区、小叶间纤维增生明显。经糖肾方或缬沙坦干预后,大部分肝细胞内脂滴明显减少甚至消失,炎性细胞明显减少,胶原纤维均减少,糖肾方高剂量组减少最显著,基本消失。
2.3各组大鼠肝脏组织α-SMA蛋白表达的变化:免疫组化结果显示:与正常对照组比较,DM模型组大鼠肝组织的狄氏间隙可见有棕褐色颗粒的阳性细胞,提示肝星形细胞被激活;经糖肾方或缬沙坦干预12周后,阳性细胞明显减少,阳性细胞数目计数结果见图1。
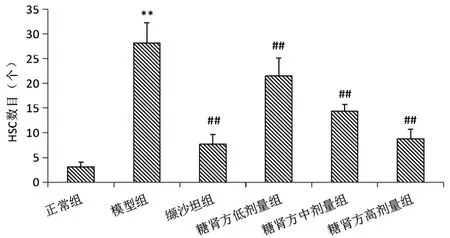
图1 肝脏组织α-SMA蛋白表达(±s,n=8)
3 讨论
研究显示,至2011年全世界糖尿病患者约有3.66亿人,每年约有460万人死于糖尿病及其并发症。世界卫生组织预测到2030年糖尿病将成为世界第七大致死病因[4]。除了糖尿病脑病、肾病、周围神经性病变、视网膜病变等常见并发症外,近年来研究发现糖尿病患者终末期肝病的死亡率高于心血管疾病[5]。亦有研究显示糖尿病与原发性肝癌发病存在相关性,能增加原发性肝癌(PHC)患病风险[6]。
糖尿病肝损伤的病理改变主要表现为非酒精性脂肪肝病(NAFLD),NAFLD包括单纯性脂肪肝、脂肪性肝炎(NASH)和肝硬化。本研究结果显示,DM模型组大鼠肝脏肝细胞呈明显脂肪变,局灶性坏死,坏死区和汇管区可见炎症细胞浸润,肝纤维化明显,说明糖尿病大鼠已出现脂肪性肝炎,但未见肝硬化,这可能与时间较短有关。目前,NAFLD的发病机制普遍认可是由胰岛素抵抗和氧化应激组成的“二次打击”理论[7]。初次打击:当由于肥胖、高脂血症、糖尿病等代谢性疾病的前提下,糖脂代谢紊乱会导致肝脏过多摄取游离脂肪酸(FFAs)、增快机体摄入脂质分解速率和促进肝脏内合成甘油三酯(TG),造成高胰岛素血症和胰岛素抵抗(IR),从而导致肝脏内脂质过多蓄积,形成单纯肝细胞脂肪变性;二次打击:在初次打击的前提下,FFA的脂毒性、线粒体功能障碍和大量细胞因子(瘦素、脂联素、抵抗素等)作用,诱导氧化应激反应,从而激活相关炎性细胞因子,引起NASH。在二次打击的基础上,炎性细胞因子激活肝星形细胞(HSC)和合成大量细胞外基质(ECM),形成肝纤维化。本研究结果发现DM模型组大鼠存在明显胰岛素抵抗。
肝纤维化作为糖尿病肝病晚期的发病基础,主要表现为细胞外基质特别是间质胶原的沉积。近年研究表明,HSC是肝内胶原及其他细胞外基质的主要来源,HSC活化是各种病因导致纤维化的主要发病机制。其中,当发生肝损伤时,在炎性和细胞因子作用下,处于静止状态的HSC被激活,表达α-平滑肌肌动蛋白(α-SMA)并分泌大量ECM,对肝纤维化的发生和发展起着重要的作用,临床上常以α-SMA作为HSC的阳性蛋白标志物。本研究免疫组化结果显示,相比较于正常组,模型组α-SMA阳性颗粒明显升高,提示HSC被大量激活。
中医学认为,糖尿病并发症的基本病机为瘀浊互阻,气阴两虚。消渴日久,治不得法,伤阴耗气,痰瘀互结于肝络可致糖尿病肝病。糖肾方在临床实践证实能有效治疗糖尿病肾病,在动物实验研究发现对糖尿病并发症均有明显保护作用,且对T2DM大鼠模型具有较好的降糖、降脂、抗炎和改善血流变等功效[2-3],根据“肝肾同源”中医理论,推测糖肾方对糖尿病肝病治疗也有一定疗效。本实验结果显示,经糖肾方治疗后血清FBG、TG、AST、ALT显著降低,HOMA-IR水平明显下降;病理形态学发现肝细胞形态多数恢复正常,脂肪变肝细胞、炎性细胞和胶原纤维明显减少,肝内α-SMA蛋白表达明显减少,提示糖肾方可能通过干预胰岛素抵抗和抑制肝星形细胞的激活以调整糖脂代谢紊乱和缓解肝纤维化,从而对糖尿病肝损伤起到了保护作用。
[1]潘小红.脑心通胶囊治疗糖尿病并发症概况[J].浙江中医杂志,2010,45(3):232-233.
[2]柴可夫,吴喜喜,杜月光.糖肾颗粒对糖尿病大鼠肾脏NF-κB和MCP-1表达的影响[J].中华中医药杂志,2016,31(8):3290-3293.
[3]杜月光,钱俊文,宋光明,等.糖肾颗粒对2型糖尿病大鼠肾脏的保护作用及对炎症的影响[J].中华中医药学刊, 2013,31(10):2217-2220.
[4]Martha Kerr.Diabetes Epidemic on Relentlessly Upward Trajectory[C].Medscape medical news from the:europeanassociationforthestudyofdiabetes (EASD)47th annual meeting.September 12-16,2011;Lisbon,Portugal.
[5]黄银琼.2型糖尿病伴非酒精性脂肪肝的危险因素分析[J].福建医药杂志,2014,36(2):4-6.
[6]陈小菁,周凯.原发性肝癌患病的糖尿病相关因素研究[J].江西医学院学报,2009,49(5):80-81.
[7]Lu Zeng,Wai J Tang,Jin J Yin,et al.Signal Transductions and nonalcoholic fatty liver:a mini-review [J].Int J Clin Exp Med,2014,7(7):1624-1631.
2016-12-14
国家自然科学基金项目基于AGEs/RAGE/NF-κB/MCP-1炎症路径多靶点探究早期糖尿病肾病“气阴两虚、络脉瘀阻”病机,编号:81273615;浙江省新苗人才计划项目基于Sirt1/PGC-α通路研究新加下瘀血汤对糖尿病大鼠肝损伤保护作用的机制,编号:2016R410003
#通讯作者:杜月光,E-mail:duyueguang@163.com
