纯合子型家族性高胆固醇血症临床诊疗进展
2017-08-09陈盼盼陆叶王绿娅
陈盼盼 陆叶 王绿娅
·综述·
纯合子型家族性高胆固醇血症临床诊疗进展
陈盼盼 陆叶 王绿娅
家族性高胆固醇血症; 诊断标准; 冠心病
家族性高胆固醇血症(familial hypercholesterolemia,FH)是一种常染色体遗传疾病,临床分为纯合子型与杂合子型,其中纯合子型FH(HoFH)是一种严重的罕见病[1]。HoFH患者同时携带两个突变基因导致低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)升高,根据突变类型可分为真纯合、复合杂合及双杂合。据报道,HoFH患病率为1/(16~100)×104,患者血清LDL-C>13 mmol/L,在不采取任何治疗手段的情况下,患者通常于30岁之前死于冠心病[2]。HoFH主要致病基因包括低密度脂蛋白受体(low density lipoprotein receptor,LDLR)、载脂蛋白B(apolipoprotein B,apoB)、前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin kexin-9,PCSK9)和低密度脂蛋白受体衔接蛋白1(low density lipoprotein receptor adaptor protein 1,LDLRAP1),其中LDLR基因突变最为常见,该基因发生突变直接导致LDLR功能受损或缺失;apoB为LDLR的主要配体,apoB基因发生突变将导致LDLR不能与血清中低密度脂蛋白(low density lipoprotein,LDL)正常结合;PCSK9功能获得型突变可导致LDLR的过度降解以及肝细胞内胆固醇的加速合成;LDLRAP1是LDLR衔接蛋白,该基因的纯合突变会导致肝摄取及运载LDL发生障碍,最终导致HoFH样表型,但遗传方式属于常染色体隐性遗传[1]。以上四种基因突变均可导致HoFH患者血浆LDL清除力降低或丧失,LDL-C水平显著升高。HoFH患者通常从出生起就伴随着心血管疾病的进展。
1 HoFH的临床特征
HoFH患者的冠心病发生率为正常人群100倍,且HoFH患者多数在儿童期和青春期即可发病[3]。其主要临床表现为血浆LDL-C水平极度增高(为正常人的6~8倍)[4]、角膜弓、皮肤肌腱黄色瘤、早发冠心病以及主动脉瓣疾病[5]。主动脉瓣疾病主要由于主动脉根部受累,导致瓣膜和主动脉瓣上狭窄,甚至累及冠状动脉开口[6]。由于HoFH患者从出生起就暴露在极高水平的LDL-C中,因此动脉粥样硬化疾病的发生发展从出生就开始。Kusters等[7]在196例6~17岁的FH儿童中,用B超监测他们的颈动脉内中膜厚度(carotid intima-media thickness,cIMT)发现,FH儿童平均cIMT显著高于64例未受影响的兄弟姐妹[(0.398±0.052)mm比(0.377±0.045)mm,P<0.01],并且发现FH儿童cIMT厚度的差异可能早在8岁就显现出来。Pereira等[8]202例FH患者踝臂指数(ankle brachial index,ABI)以诊断外周动脉疾病发现,FH患者的外周动脉疾病检出率显著高于健康对照组(17.3%比2.3%,P<0.05)。国内有学者曾对20例HoFH患者进行经胸超声心动图和双源计算机断层扫描,观察冠状动脉血流储备、主动脉及冠状动脉病变,发现HoFH患者的冠状动脉血流储备显著低于健康对照组(3.36比1.92,P< 0.01),且20例HoFH患者均有主动脉斑块,其中9例患者斑块累及冠状动脉开口,5例患者冠状动脉钙化形成[9-10]。从上可见,HoFH患者的心血管病变迅速,且常累及主动脉瓣和主动脉根部,引起相应部位出现钙化及狭窄。影像学检查可作为HoFH患者心血管系统病变评估的手段。
2 国内外HoFH的诊断标准
近年来,HoFH受到了国际社会的高度重视,相继出台了多个HoFH管理指南。2014年欧洲动脉粥样硬化协会(European Atherosclerosis Society,EAS)HoFH管理指南提出,HoFH的诊断应基于基因诊断标准或符合临床诊断标准,其中基因诊断标准:LDLR、apoB、PCSK9和LDLRAP1基因可检测到明确的两个基因突变位点;临床诊断标准:治疗前LDL-C>13 mmol/L或治疗后LDL-C>8 mmol/L,并且10岁之前出现皮肤肌腱黄色瘤或者父母LDL-C水平与杂合子型FH(HeFH)一致[1]。2016年英国指南也推荐使用基因诊断或临床诊断标准,其中基因诊断标准与EAS HoFH管理指南标准基本一致,临床诊断标准中将儿童和成人分开:儿童LDL-C>11 mmol/L,并且10岁之前出现皮肤肌腱黄色瘤;成人LDL-C>13 mmol/L并且有明显的皮肤肌腱黄色瘤;或者LDL-C水平达到临床诊断标准同时父母均确诊为HeFH。该指南还提出,由于HoFH患者遗传和临床表现的异质性特征,即使较低的LDL-C水平也不能完全排除HoFH的可能[11]。
我国早在1994年陈在嘉主编的《临床冠心病学》[12]中就提及HoFH诊断标准:成人治疗前血清总胆固醇(total cholesterol,TC)>7.8 mmol/L,16岁以下儿童TC>6.7 mmol/L或LDL-C>4.4 mmol/L,患者或亲属有肌腱黄色瘤者诊断为HeFH,其中治疗前TC>16 mmol/L伴有肌腱黄色瘤者诊断为HoFH。
以上介绍的国内外多个诊断标准均为HoFH的临床诊断提供了参考依据。由此可见,基因诊断并不是确诊HoFH的唯一依据,甚至在缺乏基因突变检测的情况下,根据临床诊断标准确诊HoFH同样可行。尤其在经济落后的发展中国家,临床诊断标准可能会更普及,一旦符合临床诊断标准,应立即启动降脂治疗以延长患者生命。
3 HoFH的治疗概况
EAS和国际FH基金会建议成年FH患者LDL-C水平<2.5 mmol/L,合并冠心病或糖尿病患者者LDL-C<1.8 mmol/L,儿童LDL-C<3.5 mmol/L[1, 13]。美国国家脂质协会提出FH患者LDL-C水平降至2.5 mmol/L以下或者较治疗前降幅≥50%[14-15]。现有的治疗方式主要包括生活方式改变、药物治疗和肝移植。生活方式的改变是降脂治疗的基石,包括减少饱和脂肪酸和胆固醇的摄入,食用富含纤维素的食物,戒烟和限盐,适当而有规律的体力活动,减重等。常规降脂药物包括他汀、依折麦布、胆酸螯合剂、普罗布考、烟酸等,对于年龄>16岁的HoFH患者,即便尚未发展为冠心病,阿司匹林也应作为常规用药[1]。HoFH是一种严重遗传性疾病,即便多种药物联合应用配合生活方式干预的情况下仍很难使LDL-C达标[16]。EAS HoFH管理指南建议HoFH患者以高强度可耐受剂量他汀为起始治疗,逐步联合依折麦布、非诺贝特等其他类型降脂药物,进而联合PCSK9抑制药等,或者进行血浆脂蛋白置换术,部分患者可选择行肝移植手术(图1)[1]。
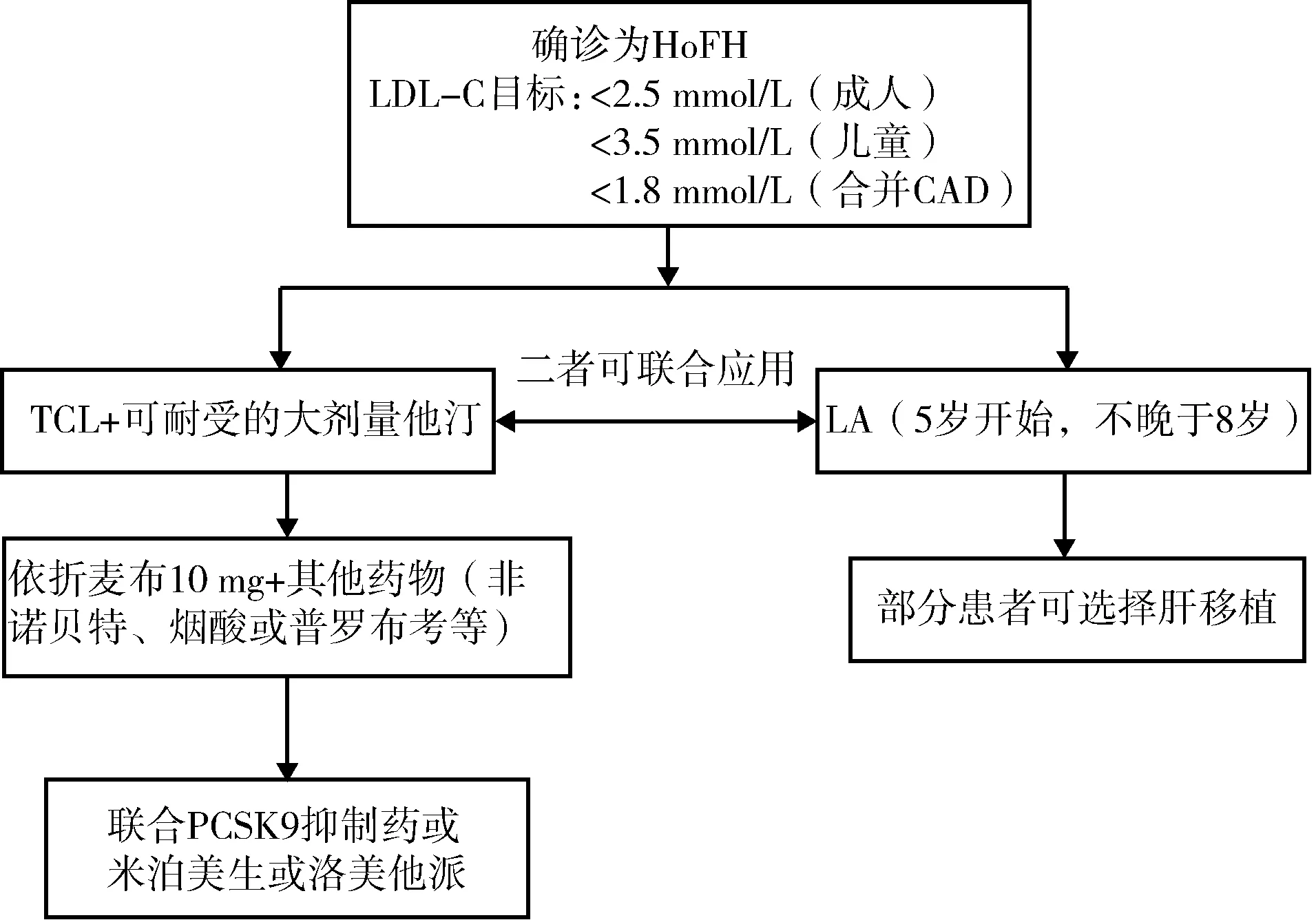
注: LDL-C,低密度脂蛋白胆固醇;HoFH,纯合型家族性高胆固醇血症;CAD,冠状动脉疾病;TCL,治疗性生活方式改变;LA,血浆脂蛋白置换术;PCSK9,前蛋白转化酶枯草溶菌素9图1 欧洲动脉粥样硬化协会提出的HoFH治疗流程[1]
3.1 常规降脂药物
他汀类药物是降脂治疗的首选。大量临床试验及荟萃分析均显示,他汀类药物的使用显著降低了冠心病事件的发生率[17-19], HoFH患者服用他汀可使LDL-C下降10%~25%[1]。 因此,HoFH患者应首先接受高强度他汀治疗,一般需联合依折麦布、普罗布考或烟酸等,然而药物的不良反应在一定程度上限制了其在HoFH患者中的疗效。一项大型调查对4688例确诊为FH的患者在1992年至2010年心血管死亡率进行了回顾性分析,发现即便服用常规降脂药物,FH患者的心血管疾病死亡率仍显著高于普通人群(标准化死亡比 2.29,95%CI1.65~3.19)[20]。
3.2 血浆脂蛋白置换术
血浆脂蛋白置换术是一种类似于肾透析的治疗方式,可以选择性清除血浆中富含胆固醇的脂蛋白。单次治疗就可使LDL-C降低55%~70%,联合高强度他汀和依折麦布则可使HoFH患者LDL-C水平进一步降低[21]。对于 HoFH患者,每周至少透析一次效果最佳。EAS HoFH指南推荐进行血浆脂蛋白置换术的理想年龄是5岁,且不能晚于8岁[1]。Koziolek等[22]对38例接受血浆脂蛋白置换术治疗长达20年的HeFH和HoFH患者进行回顾分析发现,血浆脂蛋白置换术长期治疗安全有效,并能显著减少冠状动脉事件的发生。但血浆脂蛋白置换术容易诱发导管相关性血栓,一定程度上限制其在HoFH患者中的应用。
3.3 肝移植
由于超过90%的LDLR位于肝,因此肝移植可能是个较好的治疗方法。在美国已有1/3的HoFH患者接受肝移植手术[23]。需指出的是,肝移植对已存在的心血管病变无法逆转,因此建议手术应在心血管疾病进展之前进行。另外,肝移植供体一般来自父母或者旁系亲属,当父母其中一方充当供体时,接受肝移植的患者术后仍要辅助降脂药物治疗,因为HoFH患者的父母几乎无一例外均为HeFH。此外,肝移植出现的排异反应也需慎重考虑,某些排异反应严重的HoFH患者心血管疾病仍在进展[23]。Greco等[24]报道了1例7岁接受肝移植的HoFH患者,即便在术后血脂正常且无排异反应的情况下,20个月后,经胸超声心动图显示,主动脉瓣狭窄病变仍在加重。因此,接受肝移植的患者需要严密监测主动脉瓣疾病的进展。
3.4 新药治疗
近年来,随着胆固醇代谢机制的深入研究,新型靶标治疗药物不断涌现,最具代表性的新药主要有米泊美生(mipomersen)、洛美他派(lomitapide)以及两种PCSK9单克隆抗体抑制药(alirocumab 和 evolocumab)。米泊美生是一种寡核苷酸抑制药,2013年经美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于HoFH。Raal等[25]在一项Ⅲ期临床研究中发现,米泊美生可使HoFH患者LDL-C水平在常规用药基础上进一步降低24%,常见不良反应为局部注射样反应等,其中4例患者在研究阶段出现肝酶升高>3倍正常上限的情况。洛美他派于2012年经美国FDA批准用于治疗HoFH。Cuchel等[26]在一项Ⅲ期临床研究中发现,每日服用40 mg洛美他派能使HoFH患者的LDL-C降低50%,并有35%HoFH患者LDL-C降至2.5 mmol/L以下。然而,93%患者在服药期间出现消化道不良反应,其中4例患者肝酶升高>5倍正常上限,20例患者出现不同程度肝脂肪堆积。基于米泊美生和洛美他派较高的不良反应发生率,建议HoFH患者尤其是较大剂量应用时应严密监测肝功能。
PCSK9抑制药是通过抑制PCSK9与LDLR结合,阻断LDLR的降解,从而发挥降LDL-C作用。evolocumab于2015年7月、8月分别被欧盟、美国批准,作为饮食控制的一种辅助疗法,用于治疗原发性(杂合子型家族性和非家族性)或混合性血脂异常成年患者;或联合其他降脂疗法,用于成人或年龄12岁及以上的HoFH患者。截至目前,evolocumab是唯一被批准用于治疗HoFH的PCSK9抑制药。evolocumab的Ⅲ期临床试验(TESLA-B研究)[27]对49例HoFH患者进行了随机、双盲安慰剂对照试验,试验按照2∶1原则随机分组,evolocumab组33例(evolocumab 420 mg,每4周1次),安慰剂对照组16例。结果显示,evolocumab可使HoFH的LDL-C水平在常规用药基础上进一步降低30.9%,且安全性较好。evolocumab心血管终点研究FOURIER研究[28]也于2017年2月宣布已达到研究主要终点,证实evolocumab在强效降低LDL-C的同时能减少不良心血管终点事件的发生。但目前evolocumab仅在欧美等国家和地区上市,国内备受期待。另一种PCSK9抑制药——alirocumab,也已开展多项临床试验,但目前尚缺乏针对HoFH患者的疗效和安全性资料。
4 国内FH研究概况
国内有学者基于改良的荷兰标准进行中国人群FH诊断及筛查,结果显示,确诊/可疑 FH的发病率约0.28%(1.4/500)[29]。但目前国内尚缺乏HoFH患病率的调查数据。中国是个多民族国家,人口基数大,按照1/(6~100)×104计算HoFH发病率,全国大约有1280~4000例HoFH患者,然而已报道的中国HoFH患者仅百例左右,因此中国HoFH的诊断及管理任重而道远。Li等[30]对1843例急性心肌梗死患者以荷兰标准进行FH筛查,结果显示,确诊或疑似FH患者达到3.9%,其中在早发冠心病患者中该比例达到7.1%,但该调查没有明确指出HoFH所占的比例。Jiang等[31]对64例疑似HoFH先证者进行基因检测,患者LDL-C水平7.1~23.5(13.86±3.50)mmol/L,结果显示,15例为真纯合,34例为复合杂合,9例为杂合,剩余6例未检测到致病基因。此次检测共发现了66个LDLR突变位点,26个为新突变,其中最常见的突变位点是Trp462X(c1448G→A),占比17%(11/64),未检测到apoB和PCSK9突变。但该团队曾报道过1例apoB及PCSK9突变HoFH患者[32-33]。
5 展望
HoFH是严重的遗传代谢性疾病,患儿从一出生就伴随着极高的心血管疾病风险,儿童期便可发生难以逆转的心血管病变。因此,任何年龄阶段的HoFH患者一经诊断就应立即启动降脂治疗[22, 34]。然而,即便大剂量应用降脂药物,HoFH患者的LDL-C也很难达标。儿童期肝移植、定期血浆脂蛋白置换术是可以尝试的治疗方式。米泊美生和洛美他派可大幅度降低HoFH,但费用高昂且不良反应发生率较高。相比之下,PCSK9抑制药由于其治疗效果及较高的效价比,无疑是现阶段更好的选择。另外,基因治疗研究也已取得突破性进展[35],但我国FH患者的规范化临床管理尚在起步阶段,因而需呼吁全国临床医护工作者加强对此病的认识。中国HoFH的规范化诊疗制度的完善,离不开广大医师的共同努力。
[1] Cuchel M, Bruckert E, Ginsberg HN, et al. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the consensus panel on familial hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J, 2014, 35(32):2146-2157.
[2] Page MM, Bell DA, Hooper AJ, et al. Lipoprotein apheresis and new therapies for severe familial hypercholesterolemia in adults and children. Best Pract Res Clin Endocrinol Metab,2014, 28(3):387-403.
[3] Vuorio A, Tikkanen MJ, Kovanen PT. Inhibition of hepatic microsomal triglyceride transfer protein- a novel therapeutic option for treatment of homozygous familial hypercholesterolemia. Vasc Health Risk Manag,2014, 10:263-270.
[4] Jiang L, Sun LY, Dai YF, et al.The distribution and characteristics of LDL receptor mutations in China: A systematic review. Sci Rep,2015, 5:17272.
[5] Gidding SS. The complexities of homozygous familial hypercholesterolemia management. Pediatr Transplant,2016, 20(8):1020-1021.
[6] France M.Homozygous familial hypercholesterolaemia: update on management. Paediatr Int Child Health,2016, 36(4):243-247.
[7] Kusters DM, Wiegman A, Kastelein JJ, et al. Carotid intima-media thickness in children with familial hypercholesterolemia. Circ Res,2014, 114(2):307-310.
[8] Pereira C, Miname MH, Makdisse MR, et al.Peripheral arterial disease in heterozygous familial hypercholesterolemia. Atherosclerosis,2015, 242(1):174-178.
[9] 杨娅, 李治安, 张小衫,等. 家族性高胆固醇血症患者的临床表现和超声心动图特征. 中华医学超声杂志电子版,2009, 6(3):469-475.
[10] Yang Y, Zhang X, Li R, et al. Evaluation of coronary flow velocity reserve in homozygous familial hypercholesterolemia by transthoracic Doppler echocardiography and dual-source computed tomography. Ultrasound Med Biol,2010, 36(10):1756-1761.
[11] France M, Rees A, Datta D, et al. HEART UK statement on the management of homozygous familial hypercholesterolaemia in the United Kingdom. Atherosclerosis,2016, 255:128-139.
[12] 陈在嘉, 徐义枢, 孔华宇.临床冠心病学.北京: 人民军医出版社,1994: 77.
[13] Watts GF, Gidding S, Wierzbicki AS, et al.Integrated guidance on the care of familial hypercholesterolaemia from the International FH Foundation. Eur J Prev Cardiol,2015, 22(7):849-854.
[14] Ito MK, Watts GF.Challenges in the diagnosis and treatment of homozygous familial hypercholesterolemia. Drugs,2015, 75(15):1715-1724.
[15] Jacobson TA, Ito MK, Maki KC, et al. National Lipid Association recommendations for patient-centered management of dyslipidemia: part 1- executive summary. J Clin Lipidol, 2014, 8(5):473-488.
[16] Besseling J, Sjouke B, Kastelein JJ. Screening and treatment of familial hypercholesterolemia- Lessons from the past and opportunities for the future (based on the Anitschkow Lecture 2014). Atherosclerosis,2015, 241(2):597-606.
[17] Messerli FH, Pinto L, Tang SS, et al.Impact of systemic hypertension on the cardiovascular benefits of statin therapy--a meta-analysis. Am J Cardiol, 2008, 101(3):319-325.
[18] Roberts CG, Guallar E, Rodriguez A.Efficacy and safety of statin monotherapy in older adults: a meta-analysis. J Gerontol A, Biol Sci Med Sci,2007, 62(8):879-887.
[19] 张明,李轩,陈宏,等.中国患者应用大剂量阿托伐他汀安全性的Meta分析.中国介入心脏病学杂志,2016,24(2):88-85.
[20] Mundal L, Sarancic M, Ose L, et al.Mortality among patients with familial hypercholesterolemia: a registry-based study in Norway, 1992-2010. J Am Heart Assoc,2014, 3(6):e001236.
[21] Julius U.Lipoprotein apheresis in the management of severe hypercholesterolemia and of elevation of lipoprotein(a): current perspectives and patient selection. Med Devices (Auckl),2016, 9:349-360.
[22] Koziolek MJ, Hennig U, Zapf A, et al. Retrospective analysis of long-term lipid apheresis at a single center. Ther Apher Dial,2010, 14(2):143-152.
[23] Martinez M, Brodlie S, Griesemer A, et al. Effects of liver transplantation on lipids and cardiovascular disease in children with homozygous familial hypercholesterolemia. Am J Cardiol,2016, 118(4):504-510.
[24] Greco M, Robinson JD, Eltayeb O, et al.Progressive aortic stenosis in homozygous familial hypercholesterolemia after liver transplant. Pediatrics,2016, 138(5).
[25] Raal FJ, Santos RD, Blom DJ, et al.Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet, 2010, 375(9719):998-1006.
[26] Cuchel M, Meagher EA, du Toit Theron H, et al.Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolaemia: a single-arm, open-label, phase 3 study. Lancet, 2013, 381(9860):40-46.
[27] Raal FJ, Honarpour N, Blom DJ, et al. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B): a randomised, double-blind, placebo-controlled trial. Lancet,2015, 385(9965):341-350.
[28] Vlachopoulos C, Tousoulis D. The FOURIER study:the profound study of Nature is the most fertile source of discovery. Hellenia J Cardiol,2017,[Epub ahead of print]
[29] Shi Z, Yuan B, Zhao D, et al.Familial hypercholesterolemia in China: prevalence and evidence of underdetection and undertreatment in a community population. Int J Cardiol,2014, 174(3):834-836.
[30] Li S, Zhang Y, Zhu CG, et al. Identification of familial hypercholesterolemia in patients with myocardial infarction: A Chinese cohort study. J Clin Lipidol,2016, 10(6):1344-1352.
[31] Jiang L, Kuang ZM, Pan XD, et al. Homozygous familial hypercholesterolaemia in China: a genotype-phenotype analysis of cross-sectional data. Lancet,2016, 388:S83.
[32] 潘晓冬, 苏鹏宇, 王绿娅, 等.1例家族性高胆固醇血症患者的apoB100基因型分析. 临床检验杂志,2010,28(3):179-181.
[33] 蔺洁, 王绿娅, 夏军辉, 等.家族性高胆固醇血症患者新的致病基因——PCSK9基因突变分析. 中国动脉硬化杂志,2007,15(7):518.
[34] Gidding SS, Champagne MA, de Ferranti SD, et al.The agenda for familial hypercholesterolemia: a scientific statement from the American Heart Association. Circulation,2015, 132(22):2167-2192.
[35] Ajufo E, Cuchel M. Recent developments in gene therapy for homozygous familial hypercholesterolemia. Curr Atheroscler Rep,2016, 18(5):22.
10.3969/j.issn.1004-8812.2017.06.012
100029 北京,首都医科大学附属北京安贞医院心内科 北京市心肺血管疾病研究所动脉硬化研究室(陈盼盼、王绿娅);江苏南京,中国药科大学基础医学与临床药学院(陆叶)
王绿娅,Email:wangluya@126.com
R589.2
2017-02-14)
