玉米降血糖活性肽制备分离及其氨基酸序列分析
2017-08-08胡宇航陈尚卫张学军
胡宇航 戴 军 陈尚卫 朱 松 张学军 张 平
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 江南大学食品学院,江苏 无锡 214122;3. 山东天久生物技术有限公司,山东 菏泽 274108)
玉米降血糖活性肽制备分离及其氨基酸序列分析
胡宇航1,2戴 军1陈尚卫1朱 松1张学军3张 平3
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 江南大学食品学院,江苏 无锡 214122;3. 山东天久生物技术有限公司,山东 菏泽 274108)
以水解度(DH)和游离氨基酸含量为指标优化玉米蛋白粉的酶水解工艺,结果显示,在pH 8.5,60 ℃条件下经过正交试验得到最适组合为:酶底物比3.5 g/100 g,水解时间2 h,料液比1∶20 (g/mL),在该条件下其DH为27.02%,多肽含量为85.23%。同时,还优化了玉米肽的脱色工艺,最佳条件为:温度50 ℃,pH 3.5,活性炭用量1.5 g/100 mL,脱色时间45 min,该条件下玉米肽得率为77.86%,脱色率为87.27%。将脱色脱盐后的玉米多肽经过凝胶色谱分离得到3个组分。体外降血糖活性结果显示,CP1促进正常HepG2细胞葡萄糖消耗效果最优,并且其α-糖苷酶抑制活性也最高(34.64%);CP1经过RP—HPLC制备柱纯化得到含量较高的14个组分,其中CP1-13的α-糖苷酶抑制活性最強,达到39.50%。经UPLC—Q—TOF—MS/MS测定,其氨基酸序列为A-P-A-L-L-P-F。
玉米肽;水解;降血糖活性;氨基酸序列
近年来,临储价格不断增加使2012年后玉米产量和临储量不断增高,同时使中国进口玉米和替代品也大幅增加。据报道[1],2016年中国玉米储量超过2.5×108t,远超2016年玉米产量2.18×108t。虽然目前调整玉米临时收储政策为“市场化收购”加“补贴”的新机制,有效地减少了进口玉米和替代品的量,但要消化掉这些临储玉米难度颇大。玉米蛋白粉水溶性和风味差,是限制性蛋白,多用于饲料工业。酶解玉米蛋白粉,会提高其在食品工业中的应用价值[2]。
玉米蛋白中含有许多支链氨基酸,疏水氨基酸,水解后会得到大量的含有这些氨基酸的小肽。国内外研究者关于玉米肽的活性也作了大量研究,结果表明[3]玉米肽对恢复运动疲劳,醒酒护肝,清除自由基抗氧化,降血压都有很好的作用。目前,国内外市场上有许多的玉米肽保健产品,主要分为两大类:① 功能性饮料,包括醒酒护肝类饮品和运动饮品;② 经过水解后的玉米粗肽产品,目前中国已经有几家生物肽公司规模生产玉米粗肽产品。
随着人口老龄化和物质生活水平的提高,糖尿病的发病率呈现迅速增长的趋势。目前国内外对具有降血糖作用的生物活性肽进行了大量研究。Luis Mojica等[4]研究显示黑豆肽可以有效减少Caco-2细胞模型的葡萄糖吸收,使口服葡萄糖耐量试验的小鼠餐后葡萄糖水平降低24.5%。Rim Nasri等[5]通过研究发现虾虎鱼蛋白酶解物可以显著减少喂食高脂高糖饲料小鼠的α-淀粉酶活性和血糖含量。黄景麟等[6]研究发现抗菌肽Dybowskin-2CDYa可以促进胰岛细胞增殖和胰岛素分泌,在高血糖条件下会有效降低血糖水平且不会引起低血糖。关于玉米肽降血糖的研究较少。根据李翔[7]的研究显示,在饮食中添加玉米肽不仅可以降低肥胖大鼠的胰高血糖素(glucagon)水平,还能降低大鼠体内MCP-1(单核细胞趋化蛋白-1)的水平,提高PYY(酪酪肽)的水平,后两者被认为与高血糖症密切相关。Taisuke Mochida等[8]研究发现玉米蛋白水解物对小鼠可以起到诱导GLP-1的分泌和抑制GPL-1降解的双重作用,从而增加胰岛素的分泌。Noriyuki Higuchi等[9]在此基础上对正常的雄性大鼠和患有糖尿病的GK大鼠喂食玉米蛋白水解物,结果显示口服也能够促使GLP-1和GIP含量的增多;在糖耐量试验中,口服玉米醇溶蛋白水解液可以显著抑制升糖反应,说明其提高了正常和糖尿病大鼠的糖耐量。上述研究表明玉米蛋白肽具有明显的降血糖作用,但中国相关报道很少。本试验首先对玉米蛋白水解工艺进行了优化,然后进一步分离纯化,并进行降血糖活性研究,以筛选出活性组分并测序。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
玉米蛋白粉(CGM):蛋白含量68.27%,中食都庆(山东)生物技术有限公司;
中温α-淀粉酶:4 000 U/g,无锡市酶制剂厂;
碱性蛋白酶(Alcalase):2.4 L(2.4 AU/g),丹麦诺维信公司;
767活性炭、聚丙烯酰胺凝胶、P-2 Gel:美国伯乐医药生命医学产品公司;
HepG2:美国Ctccbio Science公司;
FBS、DMEM:生化试剂,美国Hyclone 公司;
DMSO:分析纯,中国赛默飞世尔科技;
α-糖苷酶:100 UN,西格玛奥德里奇(中国)公司;
乙腈、TFA:色谱纯,国药集团化学试剂有限公司;
NaOH、HCl、NaCO3、酒石酸钠、酚试剂等:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器
冷冻干燥机:SCIENTZ-10N型,宁波生物科技有限公司;
高速冷冻离心机:Beckman J-26xp型,美国贝克曼公司;
旋转蒸发仪:RE-52A型,上海亚荣生化仪器厂;
定时数显恒流泵:HL-2D型,上海沪西分析仪器厂;
紫外检测器:HD-3型,上海沪西分析仪器厂;
细胞培养箱:Thermo Scientific 8000型,美国赛默飞世尔科技公司;
倒置光学显微镜:XDS-1A型,上海蔡康光学仪器有限公司;
超高效液相色谱仪:Waters Acquity UPLC型,美国Waters公司;
高效液相色谱仪:Waters 2545型,美国Waters公司;
超高液相色谱—飞行时间质谱联用仪:Waters Acquity UPLC-Waters MALDI Synapt Q-TOF型,美国Waters公司。
1.2 试验方法
1.2.1 玉米低聚肽的制备工艺
玉米蛋白粉→α-淀粉酶水解→碱性蛋白酶水解→活性炭脱色→过滤(0.22 μm)→纳滤脱盐→冷冻干燥→玉米低聚肽
1.2.2 玉米蛋白粉组成分析及预处理
(1) 水分含量的测定:按GB 5009.3—2010执行。
(2) 灰分含量的测定:按GB 5009.4—2010执行。
(3) 蛋白含量的测定:按GB 5009.5—2010执行。
(4) 脂肪含量的测定:按GB/T 14772—2008执行。
(5) 预处理:取100 g玉米蛋白粉原料,过80目筛,加入1 000 mL水,90 ℃糊化1 h,冷却至65 ℃,调pH至5.5,加入0.5 g/100 g·原料预先在65 ℃下活化的中温淀粉酶,反应2 h,4 000 r/min离心10 min,弃上清液,再水洗2次,沉淀物冷冻干燥。
1.2.3 酶解工艺优化 经过预处理的CGM加入一定量的水,预先在80 ℃下水浴20 min,搅拌,然后在适宜条件下水解,结束后90 ℃加热20 min灭酶,离心取上清液。玉米蛋白粉的酶解工艺优化先进行单因素试验,影响因素分别为:pH、温度、料液比、酶底物比[E]/[S]、酶解时间,响应值为水解度(DH)[10]。单因素试验选出最优pH为8.5,最适温度为60 ℃。然后以酶底物比、酶解时间、料液比为因素进行3水平的正交试验,见表1。以水解度[10]和游离氨基酸[11] 16为指标并参考行业标准(QB/T 4707—2014)选出最优工艺条件,多肽含量由总蛋白质含量减去游离氨基酸含量得出。

表1 酶解工艺正交试验因素水平设计
1.2.4 脱色条件优化 因蛋白水解液中色素的存在导致水解后颜色加深,同时存在一定程度的褐变,影响其品质,所以应进行脱色。参考文献[12]的脱色方法,以得率和脱色率为指标进行脱色优化,采用加权评分法:Z=0.5X+0.5Y,其中X为脱色率(%),Y为肽损失率(%)。经过前期单因素试验确定反应温度为50 ℃,进行正交试验,因素水平设计见表2,正交试验筛选最优工艺。
1.2.5 纳滤脱盐 趁热将脱色得到的混合液过滤得到澄清的玉米蛋白水解液,调节pH至6.5。将澄清玉米蛋白水解液使用180 D的纳滤膜纳滤脱盐并将其浓缩冻干。
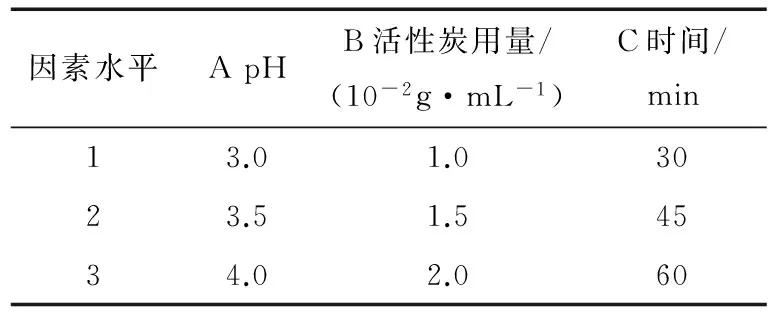
表2 脱色工艺正交因素水平设计
1.2.6 聚丙烯酰胺柱分离多肽 将冻干脱色的玉米多肽上聚丙烯酰胺柱(Bio-Gel P-2 Gel,4.5 cm×90 cm)进行分离,在进样前用超纯水进行平衡。取1 g多肽样品溶于30 mL去离子水中,水膜过滤,然后过聚丙烯酰胺柱分离,流速为2.5 mL/min,220 nm紫外检测,按照不同的出峰时间收集,得到3个不同的组分。将3个组分进行浓缩冻干进行下一步筛选及分离纯化。
1.2.7 降血糖活性研究
(1)α-葡萄糖甘酶抑制活性:测定不同组分的α-葡萄糖甘酶抑制活性,参考文献[13]的方法,作如下改动,预先加入300 μL磷酸缓冲液,再加入0.2 U的α-葡萄糖甘酶50 μL和2 mg/mL样品100 μL,振荡混匀后,将其在37 ℃恒温10 min,快速加入5 mmol PNPG 100 μL混匀,37 ℃恒温20 min后,加入0.5 mol NaCO3800 μL混匀,在405 nm下测定吸光值A1,设置空白对照,另不加样品的对照组吸光值A2,不加酶的背景组A0。抑制率按式(1)计算:
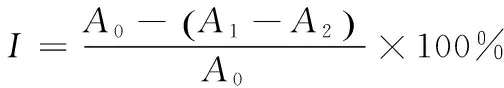
(1)
式中:
I——α-糖苷酶抑制率,%;
A0——对照组吸光值;
A1——样品组吸光值;
A2——背景组吸光值。
(2) 多肽对正常细胞葡萄糖消耗的影响:先进行细胞培养得到对数生长期的HepG2,倾去培养液,用PBS清洗1次,然后加适量胰蛋白酶—EDTA消化液,37 ℃消化1~3 min变为球形后,加入10%胎牛血清DMEM培养液终止消化反应。1 000 r/min离心5 min,去上清后,调整细胞密度约4×105cells/mL,100 μL/孔接种于96孔板,然后在37 ℃,5% CO2,95%湿度培养24 h。在细胞贴壁后,按组进行葡萄糖消耗试验。样品预先用DMEM培养基配好试验分为玉米肽高中低剂量组,正常HepG2对照组和二甲双胍组(0.01 mg/mL)组,每组3个复孔,培养24 h后,每孔取细胞上清液用葡萄糖试剂盒测定各组的葡萄糖含量[14]。
MTT试验,将上述孔板每孔加入10 μL MTT,置于培养箱中避光培养3~4 h,加入200 μL的DMSO,室温震摇10 min;在492 nm处测量同一时间的OD 值,进行细胞增殖影响分析[14]。
1.2.8 反相高效液相色谱分离纯化(RP-HPLC) 将冷冻干燥活性最高的组分用制备型反相高效液相色谱(RP—HPLC)分离纯化[15]。仪器为Waters2545制备型高效液相色谱仪,色谱柱为Waters xBriidge PrepC18(250 mm×19 mm,5 μm)。紫外检测波长220 nm,柱温20 ℃,多肽样品浓度50 mg/mL,进样量500 μL,流速10 mL/min。流动相:A为纯乙腈,B为0.05% TFA,其二元梯度洗脱条件为:0~40 min,95% A~65% A;40~45 min,65% A~20% A;45~50 min,20% A~20% A;50~55 min,20% A~95% A;55~60 min,95% A~95% A。重复收集其组分进行浓缩冷冻干燥。
1.2.9 降血糖肽氨基酸序列的确定 用RP—HPLC分离纯化的组分测定其α-糖苷酶抑制活性,筛选出活性较高组分,由超高效液相色谱-四极杆-飞行时间串联质谱(UPLC—Q—TOF—MS/MS)测定其氨基酸序列。
(1) 液相色谱条件:色谱仪为WATERS ACQUITY UPLC型;检测器为WATERS ACQUITY PDA型;检测波长200~400 nm;色谱柱:BEH C18(2.1 mm×150 mm,1.7 μm);柱温:45 ℃,流速:0.3 mL/min;样品:浓度1 mg/mL,进样量5 μL;流动相:A 0.1%甲酸,B乙腈;其二元洗脱曲线为,0~40 min,100% A~70% A;40~45 min,70%~20% A;45~50 min,20%~0% A;50~55 min,0%~100% A。
(2) 质谱条件:仪器为WATERS MALDI SYNAPT Q-TOF MS型;离子方式为ESI+;毛细管电压3.5 kV;锥孔电压30 V;离子源温度100 ℃;脱溶剂气:温度400 ℃,气流700 L/ h,锥孔气流 50 L/h;碰撞能量6/20 V;质量范围20~2 000m/z;检测器电压1 800 V。
2 结果与讨论
2.1 玉米蛋白粉组成及预处理结果
由表3可知,中温α-淀粉酶处理后玉米蛋白粉的蛋白含量达到81.25%(以干基计),为浅黄色固体粉末。预处理有效地提高了蛋白含量,便于水解的进行。

表3 CGM与预处理后样品组成成分
2.2 酶解工艺优化
由表4可知,影响DH的因素顺序为:酶底物比>料液比>酶解时间,最优的组合为A3B3C2。在保证水解度高的前提下,游离氨基酸含量越低,多肽含量就越高,活性肽就越多。影响游离氨基酸含量的因素顺序为:酶底物比>料液比>酶解时间,最优组合为A1B1C2。综合考虑玉米肽的得率和游离氨基酸含量,选取A3B1C2为最优水解条件,其DH为27.02%,游离氨基酸含量为1.87%。水解液为深黄褐色液体。
2.3 蛋白水解液的脱色及脱盐
由表5可知,影响肽得率和脱色率的因素顺序为:活性炭用量>pH>时间。综合考虑Z值、得率与脱色率,选择第二组为最佳脱色工艺。最终选定脱色条件为:温度50 ℃,pH 3.5,活性炭用量:1.5 g/100 mL的活性炭,脱色时间45 min,此条件下玉米肽得率为77.86%,脱色率为87.27%。经过脱盐,玉米肽蛋白含量(以干基计)为90.91%;多肽含量(以干基计)为88.85%,远高于行业标准中的80%和75%,是一种优质的玉米肽产品。经过水解及脱色脱盐,其最终产品得率为37.10%。
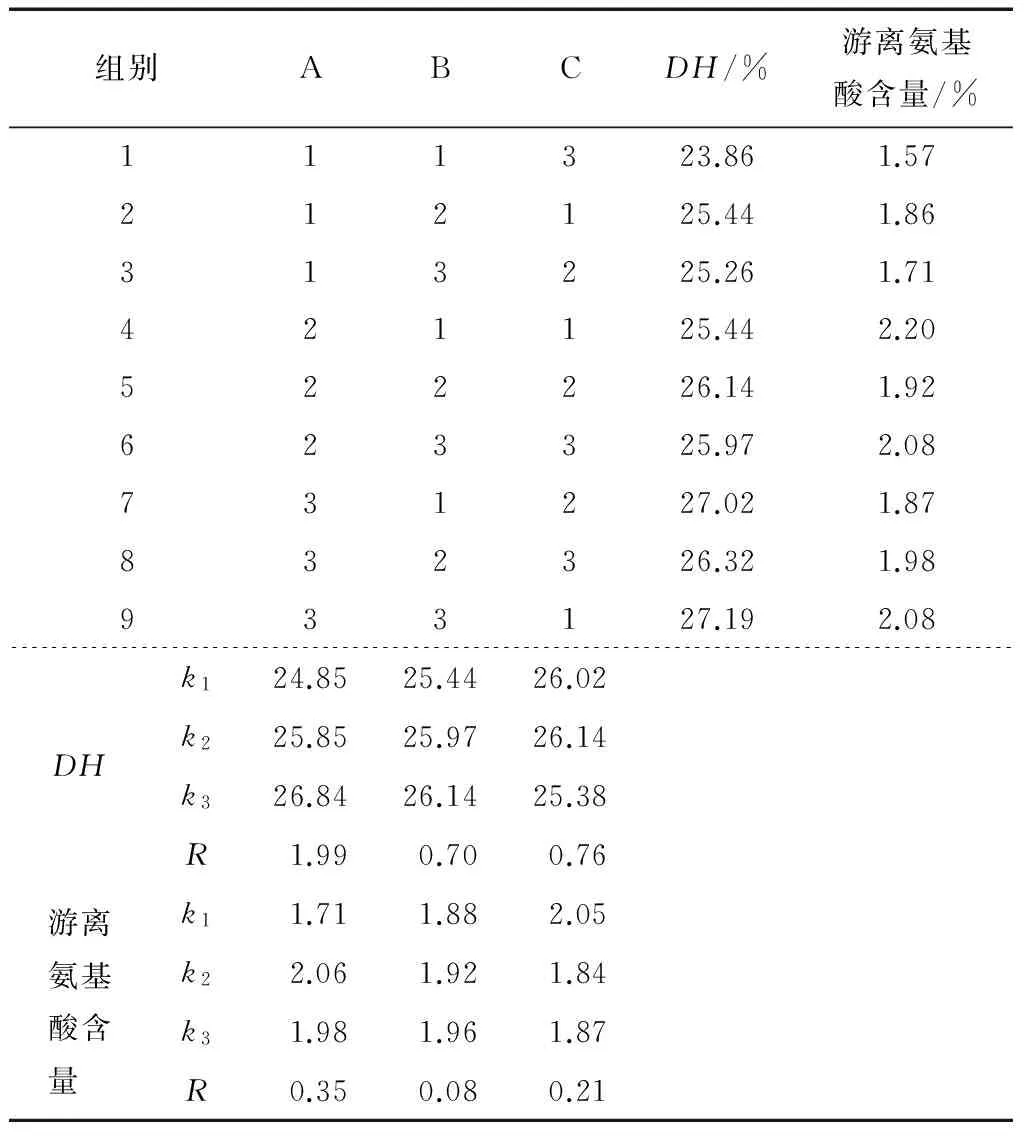
表4 酶解工艺正交试验结果及分析

表5 脱色工艺正交结果及分析
2.4 凝胶过滤色谱分离
用聚丙烯酰胺凝胶柱对脱色脱盐后的玉米多肽进行分离,其洗脱曲线见图1。按照出峰顺序分成如下3个组分,分别命名为CP1,CP2,CP3。将3组样品进行体外降血糖活性分析,以进一步筛选和分离。

图1 聚丙烯酰胺凝胶柱分离色谱图
2.5 体外降血糖活性
如表6所示,各组在经过MTT试验矫正后的GC/OD与对照组相比较,显示各组分对葡萄糖的消耗均有一定的促进作用,其中粗肽、CP1量效关系较为明显。但是各组的值均未达到二甲双胍组的,且有部分值低于对照组,考虑到MTT试验结果,可能为玉米肽具有促进HepG2细胞(人体肝癌细胞)凋亡的作用,在一定程度上影响了其生物活性,与LI Jiang-tao等[16]的研究结果一致。α-葡萄糖苷酶抑制活性试验显示,在3个组分中CP1的活性最高为34.59%。表明玉米肽具有较好的降血糖活性。
2.6 制备型反相高效液相色谱分离
将经过凝胶色谱柱(Bio-Gel P-2 Gel)分离的活性较好的组分CP1用制备型RP—HPLC进行分离制备,分离的色谱图见图2。收集的组分中含量较高的组分共14个,其α-糖苷酶抑制活性见图3,其中CP1-13的活性最高达到了39.5%,对其进行氨基酸序列分析。
2.7 氨基酸序列分析
CP1-13经过UPLC—Q—TOF—MS/MS分析,二级质谱图见图4,用Biolynx软件处理后得到该肽组分氨基酸序列为A-P-A-L-L-P-F。二肽基肽酶(DPP-Ⅳ)能够通过特异地断开X-Ala和X-Pro的N末端来调节氨基酸激素循环的生物活动,如胰高血糖素肽类(GLP-1)的代谢[17]。Tadashi Hatanaka等[16]在文献中提到具有抑制DPP-Ⅳ活性的小肽,其氨基酸序列中倒数第二位均为Pro,包括抑二肽素类(Ile-Pro-Ile,Val-Pro-Leu)和胶原蛋白肽类(Gly-Pro-X)。从氨基酸序列来看,七肽与胶原蛋白肽类(Gly-Pro-X)结构相似,DPP-IV不能特异地断开X-Pro-Phe中的Pro,推测其可能为DPP-IV抑制剂,需进一步研究来证实。Zhuang Hong等[18]在玉米抗氧化肽的研究中曾经发现过一个四肽L-L-P-F,其具有很好的抗氧化活性;黄文浩等[19]在研究降血压活性中发现的3个肽中有一种序列为Q-Q-L-L-P-F;Ma Zhi-li等[20]色谱分离得到醒酒肽单体,序列为R-L-L-P-F。这3种肽与本试验所发现的七肽中后4个氨基酸序列相同,说明X-L-L-P-F为玉米肽活性组成中的一个特征序列。
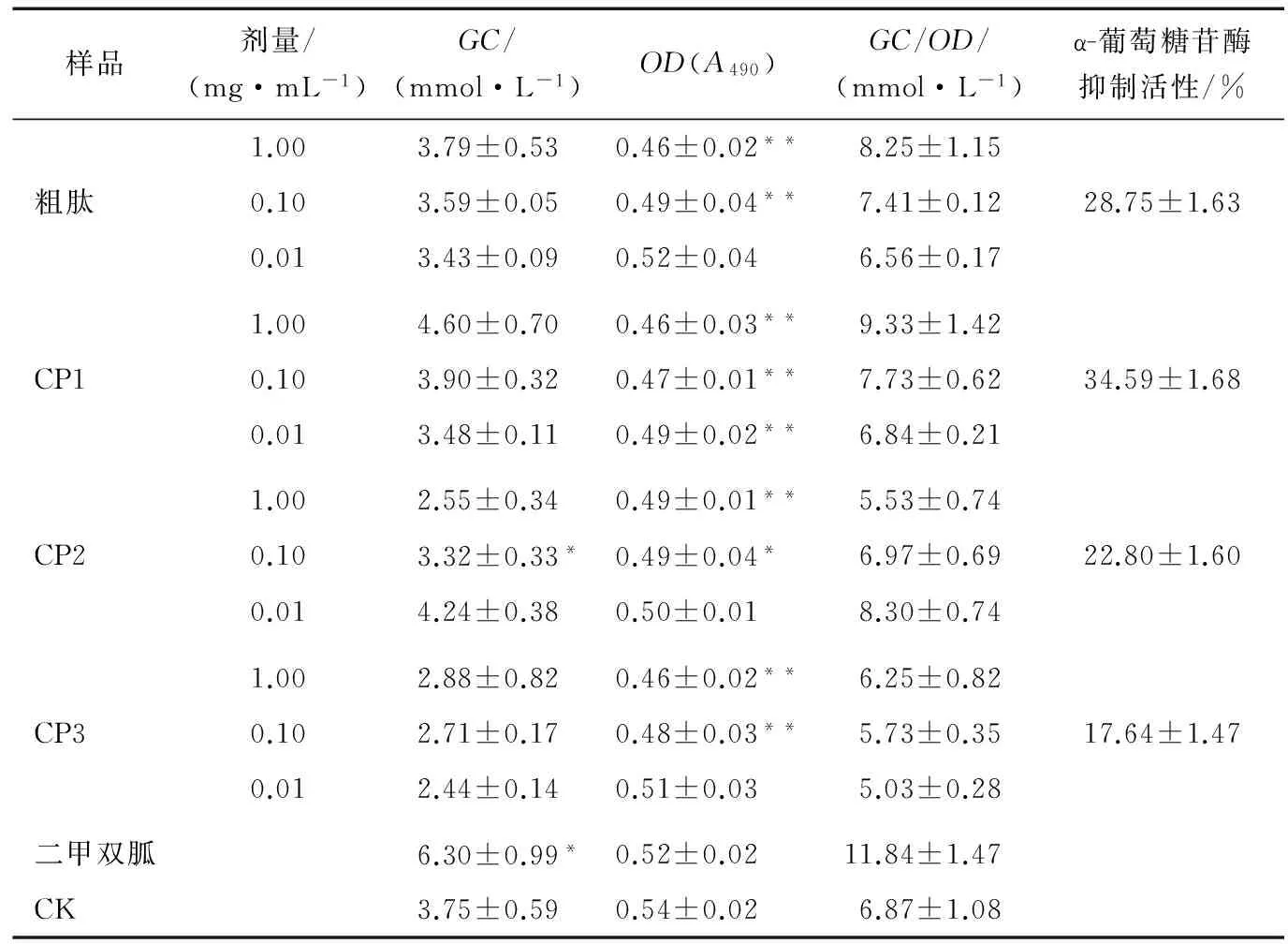
表6 玉米蛋白肽的体外降血糖活性†
†GC为葡萄糖消耗量,OD为MTT试验中的OD值,GC/OD为校正值;*为差异显著,P<0.05;**为差异极显著,P<0.01。

图2 制备型反相超高液相色谱分离CP1色谱图
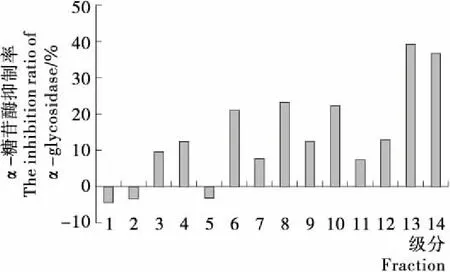
图3 反相超高液相色谱仪分离CP1组分的α-糖苷酶抑制活性
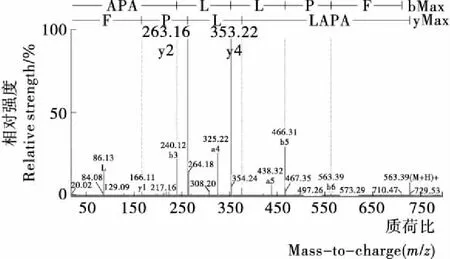
图4 二级质谱得到CP1-13的氨基酸序列图
3 结论
(1) 经过条件优化,确定了脱色效果好、肽含量较高的最佳水解和脱色工艺,其条件分别为:pH 8.5,温度60 ℃,酶底物比3.5 g/100 g,水解时间2 h,料液比1∶20 (g/mL);脱色温度50 ℃,pH 3.5,活性炭用量1.5 g/100 mL,脱色时间45 min。以体外降血糖活性为筛选指标,得到体外降血糖活性较强的CP1-13号肽组分,经过二级质谱分析其氨基酸序列为A-P-A-L-L-P-F,分子量为727.89。目前国内外关于降血糖玉米肽的研究较少,马伟[11] 40-41曾以α-糖苷酶活性分离出一个八肽为A-E-P-N-L-S-G-D-A-P,尚无其它具有降血糖活性的玉米肽单体报导。本研究为进一步开发、优化玉米蛋白资源和研究玉米肽的降糖活性提供了新的依据。
(2) 本研究只进行了体外降血糖活性的研究,有待动物试验的进一步验证;另本研究得到了的氨基酸序列还需要进一步化学合成,并与分离到的CP1-13的质谱进行分析比对,并验证其生物活性。
[1] 中国报告大厅. 2016/17年度中国玉米市场形势: 总消费量为19 711万吨[EB/OL]. (2017-01-13)[2017-01-23]. http://www.chinabgao.com/stat/stats/81417.html.
[2] 田京歌, 陈海霞, 陈书涵. 玉米肽的制备及其生物活性研究进展[J]. 食品安全质量检测学报, 2013, 4(3): 754-759.
[3] 刘雪姣. 玉米低聚肽保肝作用的研究[D]. 苏州: 江苏大学, 2016: 2-4.
[4] MOJICA L, MEJIA E G D, MENJIVAR M. Evaluation of the hypoglycemic potential of a black bean hydrolyzed protein isolate and its pure peptides using in silico, in vitro and in vivo approaches[J]. Journal of Functional Foods, 2017, 31: 274-286.
[5] NASRI R, ABDELHEDI O, JEMIL I, et al. Ameliorating effects of goby fish protein hydrolysates on high-fat-high-fructose diet-induced hyperglycemia, oxidative stress and deterioration of kidney function in rats[J]. Chem Biol Interact, 2015, 242: 71-80.
[6] 黄景麟. 抗菌肽Dybowskin-2CDYa促胰岛素分泌及对二型糖尿病大鼠的降血糖和治疗效果[D]. 吉林: 辽宁大学, 2015: 48-49.
[7] 李翔, 史仍飞, 娄淑杰. 玉米肽和有氧运动对肥胖大鼠血浆Glucagon、MCP-1、PP和PYY水平的影响[J]. 实验动物与比较医学, 2014, 34(3): 214-218.
[8] MOCHIDA T, HIRA T, HARA H. The Corn Protein, Zein Hydrolysate, Administered into the Ileum Attenuates Hyperglycemia via Its Dual Action on Glucagon-Like Peptide-1 Secretion and Dipeptidyl Peptidase-IV Activity in Rats[J]. Endocrinology, 2010, 151(7): 3 095-3 104.
[9] HIGUCHI N, HIRA T, YAMADA N, HARA H. Oral Administration of Corn Zein Hydrolysate Stimulates GLP-1 and GIP Secretion and Improves Glucose Tolerance in Male Normal Rats and Goto- Kakizaki Rats[J]. Endocrinology, 2013, 154(9): 3 089-3 098.
[10] 李秀霞, 韩鲁佳. 玉米抗氧化肽的制备及纯化[J]. 食品与发酵工业, 2010, 36(7): 73-77.
[11] 马伟. 玉米低聚肽的制备、分离及其生物活性研究[D]. 无锡: 江南大学, 2015.
[12] 黄敏, 郑喜群, 刘晓兰. 玉米蛋白酶解液的脱色方法研究[J]. 粮食与饲料工业, 2012(4): 25-28.
[13] 包美丽, 杨添植, 张立钢, 等. 双酶法制备马鹿茸降血糖肽条件优化及其对α-葡萄糖苷酶的抑制效果[J]. 食品科学, 2016(6): 88-95.
[14] YAMASHITA R, SAITO T, SATOH S, et al. Effects of dehydroepiandrosterone on gluconeogenic enzymes and glucose uptake in human hepatoma cell line, HepG2[J]. Endocrine Journal, 2005, 52(6): 727-733.
[15] 马伟, 戴军, 陈尚卫, 等. 醒酒玉米低聚肽的分离制备及其氨基酸序列分析[J]. 食品与机械, 2015, 31(5): 197-200, 221.
[16] LI Jiang-tao, HE Hui, MA Zhi-li, et al. Apoptosis in human hepatoma HepG2 cells induced by corn peptidesand its anti-tumor efficacy in H22 tumor bearing mice[J]. Food and Chemical Toxicology, 2013, 51: 297-305.
[17] HATANAKA T, KAWAKAMI K, URAJI M. Inhibitory effect of collagen-derived tripeptides on dipeptidylpeptidase-IV activity[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2014, 29(6): 823-828.
[18] ZHUANG Hong, TANG Ning, YUAN Yuan. Purification and identification of antioxidant peptides from corn gluten meal[J]. Journal of Functional Foods, 2013, 5(4): 1 810-1 821.
[19] 黄文浩, 何慧, 董华伟, 等. 酶膜耦合制备高活性ACE抑制玉米肽及结构研究[J]. 中国粮油学报, 2011, 26(4): 24-29.
[20] MA Zhi-li, ZHANG Wen-jun, YU Guo-cai, et al. The primary structure identification of a corn peptide facilitating alcohol metabolism by HPLC-MS/MS[J]. Peptides, 2012, 37(1): 138-143.
Preparation, separation and amino acid sequence analysis of corn peptides with hypoglycemic activity
HU Yu-hang1,2DAI Jun1CHEN Shang-wei1ZHU Song1ZHANG Xue-jun3ZHANG Ping3
(1. The School of Food Science and Technology of Jiangnan University, Wuxi, Jiangsu 214122, China;2. State Key Laboratory of Food Science and Technology of Jiangnan University, Wuxi, Jiangsu 214122, China;3. Shangdong Tianjiu Biotechnology Co, Ltd., Heze, Shandong 274108, China)
In this study, the degree of hydrolysis (DH) and polypeptide content were index optimization for corn gluten meal of hydrolysis process. Under the condition of pH 8.5, 60 ℃, orthogonal experiment to obtain the optimal combination for: amount of enzymeenzyme 3.5 g/100 g, hydrolysis time 2 h, solid-liquid ratio 1︰20 (g/mL); on this condition, theDHis 27.02%, peptide content is 85.23%. Meanwhile, optimized the decolorization technology, the best conditions: temperature 50 ℃, pH 3.5, activated carbon dosage: 1.5 g/100 mL, decoloring time 45 min; under the condition, corn peptide yield was 77.86%, the decolorization rate was 87.27%. After decoloring and desalination, three components were isolated by chromatographic separation. The result of hypoglycemic activity in vitro showed that CP1 had the better effect on promoting normal HepG2 cells’ glucose consumption, and theα-glycosidic enzyme inhibitory activity reached 34.64%, after RP-HPLC column purification, 14 components were gotten; the thirteenth (CP1-13) had the bestα-glycosidic enzyme inhibitory activity, and reached 39.50%. Determined by UPLC-Q-TOF-MS/MS, the amino acid sequence was A-P-A-L-L-P-F.
Corn peptide; hydrolysis; hypoglycemic activity; amino acid sequence
胡宇航,男,江南大学在读硕士研究生。
戴军(1957—),男,江南大学研究员,博士。 E-mail:daihplc@163.com
2017—04—26
10.13652/j.issn.1003-5788.2017.06.030
