补阳还五汤对肝纤维化小鼠肝功能、肝组织转化生长因子-β1、肿瘤坏死因子-α水平的作用及机制
2017-08-08张英博李春旭柏青杨张晓杰费洪新周忠光
张英博 李春旭 柏青杨 张晓杰 费洪新 周忠光
(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
·基础研究·
补阳还五汤对肝纤维化小鼠肝功能、肝组织转化生长因子-β1、肿瘤坏死因子-α水平的作用及机制
张英博 李春旭 柏青杨 张晓杰 费洪新 周忠光1
(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
目的 探讨补阳还五汤(BHD)对肝纤维化(LF)小鼠肝功能、转化生长因子(TGF)-β1和肿瘤坏死因子(TNF)-α水平的影响和机制。方法 雄性小鼠随机分成对照组,模型组,秋水仙碱组(0.001 g/kg),BHD高、中、低剂量组(37.06、18.53、9.26 g/kg)。采用30% CCl4(1 ml/kg)腹腔注射诱导LF小鼠。放射免疫法检测小鼠血清透明质酸(HA)、层黏连蛋白(LN)水平。生化分析法检测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)水平。Masson染色和透射电镜观察小鼠肝形态结构并计算肝指数。酶联免疫吸附法(ELISA)检测肝TGF-β1和TNF-α水平。结果 与模型组比较,BHD高、中剂量组小鼠血清HA、LN、ALT和AST明显降低(P<0.05),LF明显减轻,肝指数明显降低(P<0.05),肝TGF-β1和TNF-α明显降低(P<0.05)。结论 BHD可改善小鼠LF,这与降低小鼠肝TGF-β1和TNF-α表达有关。
补阳还五汤;肝纤维化
肝纤维化(LF)是一种肝内结缔组织异常增生而形成的病理生理过程之一〔1〕。LF出现肝细胞损伤,肝血窦内肝巨噬细胞活化而产生大量因子,例如产生转化生长因子(TGF)-β1、肿瘤坏死因子(TNF)-α等〔2〕,促进肝星状细胞(HSC)活化而产生细胞外基质(ECM),ECM降解后血清透明质酸(HA)、层黏连蛋白(LN)水平增加〔3〕,同时LF伴有血清谷丙转氨酶(ALT)、谷草转氨酶(AST)含量增加〔4〕。目前可采用四氮化碳(CCl4)诱导建立LF小鼠、大鼠模型〔5,6〕。复方补阳还五汤(BHD)的应用十分广泛,例如BHD下调核转录因子(NF)-κB-p65蛋白表达〔7〕、抑制内皮细胞凋亡〔8〕、调控细胞周期〔9〕、治疗动脉粥样硬化〔10〕、抑制肝癌血管生成〔11〕、治疗缺血性脑卒中〔12〕、治疗脊髓损伤等〔13〕。但是BHD抗小鼠LF的实验研究国内外尚无文献报道,因此本实验探讨BHD对LF小鼠模型的影响及机制。
1 材料与方法
1.1 材料 动物:清洁级雄性昆明小鼠,体重(20±3)g,黑龙江中医药大学实验动物中心李宝龙副主任提供,许可证号:SCXK(黑)2013-004。药品和试剂:BHD由黑龙江中医药大学中医药研究院周忠光教授购买,田明教授制备成水煎剂,再制备成干粉后保存,BHD原药材(黄芪120 g、当归尾6 g、赤芍4.5 g、川芎3 g、地龙3 g、桃仁3 g和红花3 g)组方提纯成干粉的提纯率为36.12%;秋水仙碱,西双版纳药业有限责任公司,批号140808;血清HA、LN、ALT、AST试剂盒,TNF-α和TGF-β1酶联免疫试剂盒均购于南京建成生物工程研究所;CCl4和其他试剂均为国产分析纯,由齐齐哈尔医学院张英博副主任医师提供。仪器:台式离心机,TGL-16G (上海安亭科学仪器厂);RT雷杜酶标仪,6100型 (美国RT公司);透射电镜,EM-1200EX型 (日本Jeol公司),冰冻切片机,CM1900型 (Leica公司)等。
1.2 方法
1.2.1 复制LF模型 采用30% CCl4(1 ml/kg,使用橄榄油配制)腹腔注射昆明小鼠,诱导小鼠LF模型,每周对小鼠注射2次,共8 w,通过小鼠尾静脉采血,检验小鼠血清学指标,确认LF小鼠模型制备成功,此过程参考文献〔5〕。同时对照组采用同样方法腹腔注射等量100%橄榄油。
1.2.2 动物分组与给药方法 昆明小鼠42只,随机分成对照组,模型组,秋水仙碱组,BHD高、中、低剂量组,每组7只。对照组、模型组灌胃等量生理盐水,秋水仙碱组灌胃秋水仙碱0.001 g/kg,BHD高、中、低剂量组分别灌胃BHD(37.06、18.53、9.26 g/kg),灌胃40 d。
1.2.3 血清LF指标 小鼠灌胃结束后禁食20 h,眼球采混合血,静置分层,离心机3 000 r/min离心10 min,取上清液分装,保存,采用放射性免疫法检测血清HA、LN。
1.2.4 血清肝功能指标 小鼠灌胃结束后禁食20 h,眼科镊子摘除小鼠眼球,采混合血,静置,离心机2 500 r/min离心15 min,取上清分装,保存。按照试剂盒说明书测定血清生化指标ALT、AST。
1.2.5 Masson染色 小鼠灌胃结束后水合氯醛麻醉,心脏灌注80 ml生理盐水,4%多聚甲醛灌注,取材肝,制备石蜡切片。石蜡切片脱蜡至水,铬化处理,蒸馏水洗涤,Weigert苏木精液染核5~10 min,盐酸酒精分化,蒸馏水洗涤,Masson丽春红酸性品红液染5~10 min,2%冰醋酸水溶液浸洗,1%磷钼酸水溶液分化3~5 min,苯胺蓝染5 min,0.2%冰醋酸水溶液浸洗,乙醇脱水,二甲苯透明,中性树胶封固,镜下观察。
1.2.6 透射电镜 小鼠灌胃结束后,禁食20 h,水合氯醛麻醉,心脏灌注80 ml生理盐水,2.5%戊二醛灌注,取材肝,2.5%戊二醛和四氧化锇分别固定、脱水、包埋、切片等,透射电镜观察肝组织。
1.2.7 肝指数 小鼠灌胃结束后,断头处死小鼠,取材肝,电子天平称重,计算肝指数。肝指数(mg/g)=肝质量(mg)/体重(g)。
1.2.8 肝组织TGF-β1和TNF-α 实验结束后,断头处死,剪开腹腔皮肤、腹膜,取材肝组织,匀浆,4 000 r/min离心15 min,取上清液,分装,-80℃保存,酶标仪上450 nm波长处测定吸光度(A),绘制TGF-β1和TNF-α的标准曲线,测定肝组织TGF-β1和TNF-α含量。
1.3 统计学方法 应用SPSS19.0软件行单因素方差分析。
2 结 果
2.1 血清LF指标 与对照组比较,模型组LF小鼠的血清HA、LN含量明显升高(P<0.05);与模型组比较,秋水仙碱组,BHD高、中剂量组LF小鼠的血清HA、LN含量明显降低(P<0.05)。见表1。
2.2 血清肝功能指标 与对照组比较,模型组LF小鼠血清的ALT和AST含量明显升高(P<0.05);与模型组比较,秋水仙碱组,BHD高、中剂量组LF小鼠血清ALT和AST含量明显降低(P<0.05)。见表2。
2.3 Masson染色观察肝组织 镜下可见对照组肝细胞辐射状排列,肝板清晰,中央静脉清晰可见,肝细胞质丰富,胶原纤维较少;模型组肝板较宽,肝细胞质较少,中央静脉较粗大,肝细胞之间胶原纤维较多;秋水仙碱组,BHD高、中、低剂量组肝细胞之间胶原纤维不同程度地减少,肝细胞结构不同程度地得到改善,肝板较清晰。见图1,图2。
2.4 透射电镜观察肝组织 镜下可见对照组肝细胞质内线粒体未出现肿胀,粗面内质网清晰可见;模型组肝细胞的细胞器较少,例如线粒体数量减少,伴有脂滴较多,空泡较多;秋水仙碱组,BHD高、中、低剂量组肝细胞内空泡不同程度地减少,伴有脂滴和线粒体均较少。见图3。
2.5 肝指数 与对照组比较,模型组LF小鼠肝指数明显升高(P<0.05);与模型组比较,秋水仙碱组,BHD高、中剂量组LF小鼠肝指数明显降低(P<0.05)。见表3。
2.6 肝组织TGF-β1和TNF-α 与对照组比较,模型组LF小鼠肝组织TGF-β1和TNF-α含量明显升高(P<0.05);与模型组比较,秋水仙碱组,BHD高、中剂量组小鼠肝组织TGF-β1、TNF-α含量明显降低(P<0.05)。见表4。
表1 BHD对LF小鼠血清HA、LN的影响
与对照级比较:1)P<0.05;与模型组比较:2)P<0.05,下表同
表2 BHD对LF小鼠血清ALT、AST的影响
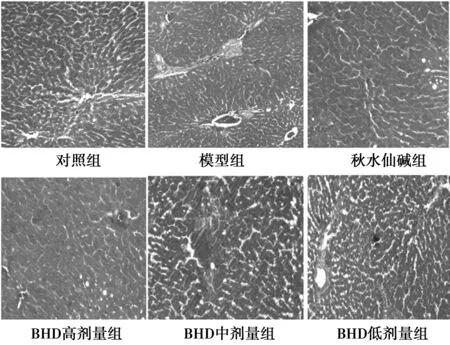
图1 Masson染色观察肝组织(Masson,× 100)
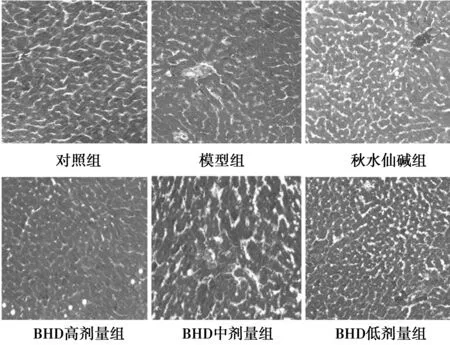
图2 Masson染色观察肝组织(Masson,× 400)
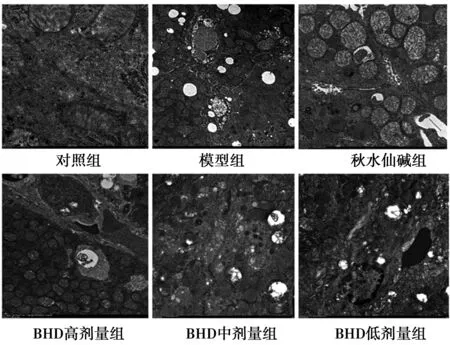
图3 透射电镜观察肝组织超微结构 (透射电镜,× 16 500)
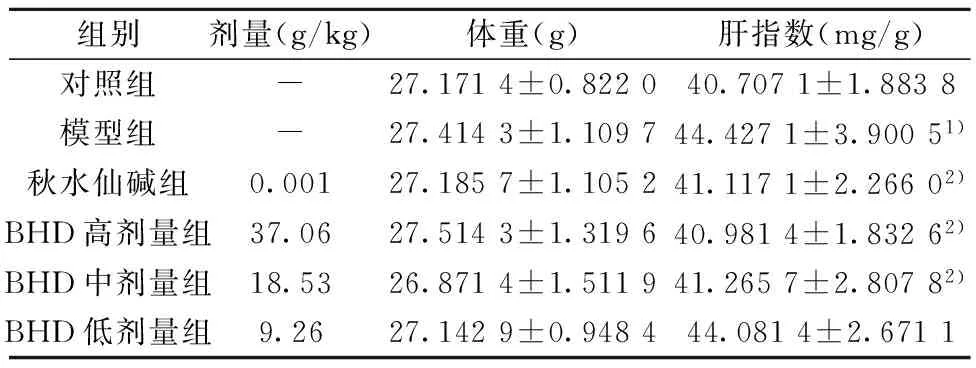
组别剂量(g/kg)体重(g)肝指数(mg/g)对照组-27.1714±0.822040.7071±1.8838模型组-27.4143±1.109744.4271±3.90051)秋水仙碱组0.00127.1857±1.105241.1171±2.26602)BHD高剂量组37.0627.5143±1.319640.9814±1.83262)BHD中剂量组18.5326.8714±1.511941.2657±2.80782)BHD低剂量组9.2627.1429±0.948444.0814±2.6711
表4 BHD对LF小鼠肝组织TGF-β1、TNF-α含量的影响
3 讨 论
本实验表明BHD高、中剂量可改善小鼠肝组织LF程度,减少肝组织ECM,减少肝组织胶原纤维的含量,以此治疗LF。BHD高、中剂量可部分恢复小鼠肝功能。LF模型小鼠肝组织损伤明显,出现肝代偿性增生。经过BHD治疗后,BHD高、中剂量可不同程度地减少肝肝代偿性增生,避免肝组织损伤,以此增加对肝脏的保护作用。LF伴有肝巨噬细胞分泌TGF-β1和TNF-α含量增加,肝星状细胞大量增殖,诱导成纤维细胞增生,促进ECM沉积,最终促进肝组织演化为LF。本实验结果表明,LF小鼠模型稳定。BHD高、中剂量可干扰肝组织内肝星状细胞大量增殖,减少成纤维细胞生成,减弱小鼠LF程度。同时肝组织TGF-β1和TNF-α含量降低的同时,伴有肝组织形态结构改善,LF指标及其肝功能指标得到改善,肝指数得到部分恢复,提示高、中剂量BHD通过改善肝组织TGF-β1和TNF-α含量水平来治疗LF。
1 Wanich N,Vilaichone RK,Chotivitayatarakorn P,etal.High prevalence of hepatocellular carcinoma in patients with chronic hepatitis B infection in Thailand〔J〕.Asian Pac J Cancer Prev,2016;17(6):2857-60.
2 Robert S,Gicquel T,Bodin A,etal.Characterization of the MMP/TIMP imbalance and collagen production induced by IL-1β or TNF-α release from human hepatic stellate cells〔J〕.PLoS One,2016;11(4):e0153118.
3 Cai XG,Xia JR,Li WD,etal.Anti-fibrotic effects of specific-siRNA targeting of the receptor for advanced glycation end products in a rat model of experimental hepatic fibrosis〔J〕.Mol Med Rep,2014;10(1):306-14.
4 Tang N,Zhang Y,Liu Z,etal.Correlation analysis between four serum biomarkers of liver fibrosis and liver function in infants with cholestasis〔J〕.Biomed Rep,2016;5(1):107-12.
5 Motino O,Agra N,Brea Contreras R,etal.Cyclooxygenase-2 expression in hepatocytes attenuates non-alcoholic steatohepatitis and liver fibrosis in mice〔J〕.Biochim Biophys Acta,2016;1862(9):1710-23.
6 Zhang F,Gu JX,Zou XP,etal.Protective effects of S-adenosylmethionine against CCl4-and ethanol-induced experimental hepatic fibrosis〔J〕.Mol Biol (Mosk),2016;50(2):284-90.
7 费洪新,周忠光,刘 斌.补阳还五汤对阿尔茨海默病小鼠NF-κBp65蛋白的影响〔J〕.中国老年学杂志,2015;35(19):5369-71.
8 Shen J,Zhu Y,Huang K,etal.Buyang Huanwu Decoction attenuates H2O2 induced apoptosis by inhibiting reactive oxygen species-mediated mitochondrial dysfunction pathway in human umbilical vein endothelial cells〔J〕.BMC Complement Altern Med,2016;16(1):154.
9 刘 芳,王宇红,蔡光先,等.补阳还五汤及其精简方(脑健片)对脑缺血大鼠海马组织、CDK4/cyclinD1表达的影响〔J〕.中国中药杂志,2015;40(20):4058-62.
10 张红珍,李 丽,焦 瑞,等.补阳还五汤对动脉粥样硬化模型大鼠主动脉Rho激酶及NF-κB p65 mRNA表达的影响〔J〕.中国中西医结合杂志,2015;35(12):1495-500.
11 Min L,Ling W,Hua R,etal.Anti-angiogenic therapy for normalization of tumor vascu lature:a potential effect of Buyang Huanwu decoction on nude mice bearing human hepatocellular carcinoma xenografts with high metastatic potential〔J〕.Mol Med Rep,2016;13(3):2518-26.
12 Chen HJ,Shen YC,Shiao YJ,etal.Multiplex brain proteomic analysis revealed the molecular therapeutic effects of buyang huanwu decoction on cerebral ischemic stroke mice〔J〕.PLoS One,2015;10(10):e0140823.
13 Guo ZP,Huang MN,Liu AQ,etal.Buyang Huanwu decoction up-regulates Notch1 gene expression in injured spinal cord〔J〕.Neural Regen Res,2015;10(8):1321-3.
〔2016-10-19修回〕
(编辑 袁左鸣)
Effects of Buyang Huanwu Decoction on liver fibrosis mice and its mechanism
ZHANG Ying-Bo,LI Chun-Xu,BAI Qing-Yang,etal.
Qiqihar Medical University,Qiqihaer 161006,Heilongjiang,China
Objective To investigate the effects of Buyang Huanwu Decoction (BHD) against liver fibrosis(LF) mice and its mechanism.Methods Male mice were randomly divided into control,model, colchicine (0.001 g/kg),BHD high-dose (37.06 g/kg),BHD medial-dose (18.53 g/kg),BHD low-dose (9.26 g/kg) groups. The radioimmunoassay was used to determine hyaluronic acid (HA) and laminin(LN) levels in serum. The biochemical analysis was used to determine alanine aminotransferase (ALT) and aspartate aminotransferase (AST) levels in serum. The morphology of liver tissue was observed by optical microscope and electron microscope,calculated the organ coefficients of liver. The enzyme-linked immuno sorbent assay (ELISA) was applied for detecting transforming growth factor(TGF)-β1 and tumor necrosis factor(TNF)-α levels in the liver. Results Compared with those of model group,the levels of HA,LN,ALT and AST in BHD high-dose and medial-dose groups were significantly decreased (P<0.05);the liver pathological variations of fibrotic mice were changed obviously;organ coefficients of liver significantly were decreased (P<0.05);the TGF-β1 and TNF-α levels in the liver were significantly decreased (P<0.05).Conclusions BHD could attenuate liver injury and the fibrosis level in LF mice. The mechanisms possibly contribute to down-regulating expressions of TGF-β1 and TNF-α in liver of mice.
Buyang Huanwu Decoction;Liver fibrosis
国家自然科学基金资助项目(No.81373777,81173599);黑龙江省教育厅科学研究项目(No.12531788);齐齐哈尔医学院院内科研博士专项基金(No.QY2016B-21)
费洪新(1978-),男,博士,博士后,讲师,主要从事肝纤维化、肿瘤、痴呆研究。
张英博(1973-),男,博士,副教授,副主任医师,主要从事肝纤维化、肿瘤、痴呆研究。
R285
A
1005-9202(2017)14-3381-04;
10.3969/j.issn.1005-9202.2017.14.001
1 黑龙江中医药大学
