葛根素和丹参酮ⅡA对维甲酸诱导骨质疏松大鼠生殖系统的修复作用
2017-08-08雒志恒祁珊珊冯自立吴婕王永吉
雒志恒 祁珊珊 冯自立 吴婕 王永吉
陕西理工大学维生素D生理与应用研究所,陕西 汉中 723001
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP),通常因女性绝经后卵巢功能衰退,体内雌激素水平急剧下降,导致破骨细胞活动度增加、骨转化率升高而表现出全身骨量减少、骨密度降低、骨脆性增加的一种骨代谢疾病[1]。在维甲酸诱导的大鼠骨质疏松症模型中,维甲酸造成生殖系统损伤引起体内雌激素水平降低导致骨质疏松,与人类PMOP具有良好的相似性[2,3]。由于雌激素降低引起骨质疏松的同时也对生殖系统引起生理改变而造成一定损伤[4],通过传统的雌激素治疗会导致子宫内膜增生,卵巢增生甚至引发生殖系统癌变,存在一定风险性,因此使用植物雌激素治疗PMOP便得到广大研究者的青睐。本研究使用葛根素与丹参酮ⅡA在对骨质疏松症进行治疗的同时观察其是否对生殖系统存在修复作用,并对葛根素与丹参酮ⅡA这两种植物雌激素对生殖系统的修复作用进行比较,为绝经后骨质疏松患者的生殖系统修复与治疗提供参考。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:50只健康雌性SD大鼠(SPF级,由第四军医大学实验动物中心提供,许可证号:SCXK-(军)2012-0007)12周龄,体重200~220 g。
1.1.2 主要试剂:维甲酸,含量99.4%,购于北京贝丽莱斯生物化学有限公司。葛根素98%、丹参酮ⅡA 10%,购于北京鼎国昌盛生物技术公司。苯甲酸雌二醇注射液4 mg/2 mL 购于赤峰博恩药业公司。大鼠雌二醇Elisa(96T)试剂盒,购于上海西唐生物科技有限公司。
1.1.3 主要仪器:尼康倒置荧光显微镜(Nikon Ti-S)、酶标仪(BioTek)、分析天平(TB-214北京赛托利斯仪器有限公司)、小动物麻醉机(美国MATRX)。
1.2 实验动物分组与给药
50只雌性大鼠随机分为正常组、模型组、葛根素组、丹参酮ⅡA组、苯甲酸雌二醇阳性对照组,每组10只,分笼饲养,自由饮水、摄食。适应性饲养1 w后开始骨质疏松建模。除正常组外,其余各组每日给予维甲酸80 mg/(kg·d)灌胃,建模21 d[5,6],正常组每日给予等量蒸馏水灌胃。建模21 d后开始给药,葛根素组每日按50 mg/(kg· d)、丹参酮ⅡA组每日按200 mg/(kg·d)灌胃,雌二醇组每日按40 μg/(kg·d)腹腔注射,连续给药70 d。
1.3 组织样品采集与指标测定
1.3.1 血清样品采集:给药结束后分别记录各组大鼠体重,每只使用小动物麻醉机调节麻醉气体(异氟烷)流量500~700 mL/min麻醉后称重、眼眶静脉采血5 mL,3000 r/min 4℃离心6 min,取上清置于- 80 ℃冰箱冻存,以备后用。
1.3.2 生殖系统(子宫、阴道、卵巢)采集及脏器指数测定:CO2窒息法处死大鼠后用手术剪从大鼠腹腔正中剪开,迅速找到子宫及卵巢并分离周围脂肪组织,连阴道一并迅速取出,剔除周围结缔组织后,PBS冲洗2次,用无尘无菌纸将PBS吸干,置于分析天平上称重,记录数据计算脏器指数[7]。记录后将组织置于4%多聚甲醛中固定24h,备用。
1.3.3 血清雌二醇含量测定:使用大鼠ELISA试剂盒(96T),采用竞争结合法,每只大鼠血清做2个复孔,其余操作严格按照说明书进行。反应完毕后使用BioTek酶标仪进行OD值读数,检测采用终点动力学法,450 nm光波长测定。将所得OD值代入标准曲线方程由Elisa计算软件计算出E2含量。
1.3.4 组织形态学观察:取已固定好的各组子宫、阴道组织经酒精梯度脱水,二甲苯透明,石蜡包埋,5~7 μm切片,HE染色。置于尼康倒置荧光显微镜下进行40、100、200倍观察,每张切片分别取3~5个视野拍照。
1.3.5 形态计量学测定:将 HE 染色切片置于 10倍镜下,随机选择6个视野,应用 Image-Pro Plus 显微测量系统,进行子宫、阴道形态计量学相关参数的测定,分别测定子宫上皮厚度、子宫腔径、子宫肌层厚度、管径厚度,统计子宫腺体个数,以及对阴道上皮厚度、阴道壁厚度进行测量。
1.4 统计学处理

2 结果
2.1 葛根素与丹参酮ⅡA对骨质疏松大鼠生殖系统脏器指数的影响
通过各组脏器指数比较发现,模型组较正常组显著降低(P<0.05),提示维甲酸在造成骨质疏松症的同时对生殖系统也有较大损伤作用。其中,丹参酮组较模型组脏器指数显著升高(P<0.01)差异极显著。葛根素组较模型组有所升高但差异不显著(P>0.05)。此外,葛根素组与丹参酮组虽较模型组均有升高,但都低于阳性对照雌二醇组。雌二醇组与模型组相比差异极显著(P<0.01)(见图1)。

图1 各组生殖系统脏器指数比较与模型组比较,*P<0.05,**P<0.01Fig.1 Comparison of organ index of reproductive system between each group(*Compared with the Model group, P<0.05,** Compared with the Model group, P<0.01)
2.2 血清雌二醇检测结果
通过分析血清Elisa检测结果,模型组较正常组显著降低(P<0.05)。提示,维甲酸对大鼠生殖系统损伤较大,导致血清E2水平显著降低。葛根素组较模型组有所升高,差异显著(P<0.05),丹参酮组E2恢复水平较模型组显著升高(P<0.05),植物雌激素两组E2水平均低于雌二醇阳性药物组。提示,两种植物雌激素均能有效增加大鼠体内雌二醇水平。丹参酮组与葛根素组相比,两者差异不显著(P>0.05)但丹参酮组E2水平稍高于葛根素组。提示,丹参酮药效优于葛根素。见图2。

图2 各组血清E2含量与模型组比较,*P<0.05Fig.2 Serum E2 levels in each group(*compared with the Model group, P<0.05)
2.3 组织病理学分析结果
2.3.1 子宫组织病理学分析:通过分析HE染色结果发现,正常组子宫断面全层结构正常,子宫上皮为单层柱状上皮,排列均一较为致密,固有层较厚,血管较为丰富,视野中可见多个单管状子宫腺体。模型组子宫出现萎缩形态,4倍镜视野下可见子宫断面全貌,管径厚度较正常组明显减少,腔径增加,子宫单层柱状上皮较正常组明显变薄,排列不规则、薄厚不均一。雌二醇组子宫出现向腔内增生现象,上皮厚度明显增加颜色较深,柱状上皮细胞排列致密,管径厚度明显增加,腔内有较多脱落细胞。葛根素组与丹参酮组子宫断面全层形态较模型组有所改善,子宫管径厚度有所增加,上皮厚度有所增加,但程度均小于雌二醇组(见图3)。
2.3.2 阴道组织病理学分析:组织学观察显示,正常组阴道上皮为复层扁平上皮,上皮较厚,可见呈深红色的完全角化细胞,固有层较厚,毛细血管丰富。模型组阴道复层扁平上皮及阴道壁厚度较正常组明显减小。葛根素组及丹参酮组阴道上皮厚度、阴道壁厚度均较模型组有所增加,视野可见红色角化上皮细胞。其中,丹参酮组阴道形态较葛根素组恢复良好,上皮及管壁生长较厚。雌二醇组阴道上皮厚度较各组均显著增加,上皮细胞排列致密,形状不规则。植物雌激素两组虽较模型组上皮厚度及阴道壁厚度有所恢复,上皮细胞形态较为规则,但整体水平均低于雌二醇组(见图4)。
2.4 形态计量结果
2.4.1 子宫形态计量结果:通过统计各组子宫形态计量值发现,模型组子宫各项指标均较正常组显著减少,差异极显著(P<0.01),子宫腔径显著扩大(P<0.01)。葛根素组子宫管径较模型组显著升高(P<0.01),子宫腔径较模型组显著减少(P<0.01),子宫肌层厚度、腺体数量较模型组显著升高(P<0.05),子宫上皮厚度较模型组有所增加但差异不显著(P>0.05)。丹参酮组子宫腺体数量较模型组有所改善但差异不显著(P>0.05),其余各项指标均较模型组差异极显著(P<0.01)。通过丹参酮组与葛根素组对比发现,丹参酮组子宫管径、上皮厚度、肌层厚度、均大于葛根素组,其中子宫管径差异显著(P<0,05)(见表1)。

图3 各组子宫组织结构(HE染色)A:正常组子宫断面全层40×;B:正常组子宫内膜100×;C:模型组子宫断面全层40×;D:模型组子宫内膜100×;E:葛根素组子宫断面全层40×;F:葛根素组子宫内膜100×;G:雌二醇组子宫断面全层40×;H:雌二醇组子宫内膜100×;I:丹参酮组子宫断面全层40×;J:丹参酮组子宫内膜100×;EP:子宫上皮;LP:固有层;▲:子宫腺体Fig.3 The structure of the uterus of each group (H&E staining)A: The whole layer of the uterus in control group 40×; B: The endometrium in control group100×;C: The whole layer of the uterine in retinoic acid group 40×; D: The endometrium in retinoic acid group100×; E: The whole layer of the uterine in PUE group 40×; F: The endometrium in PUE group100×; G: The whole layer of the uterus in estradiol group 40×; H: The endometrium in estradiol group 100×; I: The whole layer of the uterus in tanshinone group 40×; J: The endometrium in tanshinone group 100×; EP: Epithelium; LP: lmin propri; ▲: Uterine gland.

图4 各组阴道组织结构(HE染色)A:正常组阴道40×;B:正常组阴道100×;C:模型组阴道40×;D:模型组阴道100×;E:葛根素组阴道40×;F:葛根素组阴道100×;G:雌二醇组阴道40×;H:雌二醇组阴道100×;I:丹参酮组阴道40×;J:丹参酮组阴道100×;EP:阴道上皮Fig.4 The structure of the vagina each group (H&E staining)A: The vagina in control group 40×; B: The vagina in control group 100×; C: The vagina in retinoic acid group 40×; D: The vagina in retinoic acid group 100×; E: The vagina in PUE group 40×; F: The vagina in PUE group 100×; G: The vagina in estradiol group 40×; H: The vagina in estradiol group 100×; I: The vagina in tanshinone group 40×; J: The vagina in tanshinone group 100×; EP: Epithelium

组别 子宫管径(μm)子宫腔径(μm)子宫上皮厚度(μm)子宫肌层厚度(μm)子宫腺体数量正常组991.8358±275.6278240.7124±198.807233.97659±5.623866158.5273±48.5328430.0001±3.858612模型组583.0727 ±201.8474**795.1664±514.8004**25.93363±9.365569**100.6479 ±22.34258**20.91667±8.295216**葛根素组856.1824 ±93.98819##252.0668±205.9611##29.3568±17.70335113.0565 ±28.75176#29.0010 ±5.577734#雌二醇组1041.806 ±145.5733##536.4675±206.4699#35.78157±5.080769##185.7924 ±42.59179##35.7000 ±9.569047##丹参酮组957.0978 ±196.0955##▲273.6201±260.7165##31.50211 ±8.348472##188.2642±31.57878## 28.33333 ±3.444803
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与葛根素组比较,▲P<0.05
2.4.2 阴道形态计量结果:各组大鼠阴道形态计量值如表2所示,模型组阴道上皮厚度较正常组减少,差异极显著(P<0.01),阴道壁厚度显著减少(P<0.05)。葛根素组阴道上皮厚度较模型组显著增加(P<0.01),阴道壁厚度有所恢复但差异不显著(P>0.05)。丹参酮组阴道上皮厚度较模型组显著升高(P<0.01),阴道壁厚度较模型组有所增加但差异不显著(P>0.05)。两种植物雌激素药物组指标均低于雌二醇阳性对照组。丹参酮组阴道上皮厚度恢复程度较葛根素组有明显改善,差异极显著(P<0.01),见表2。
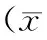
表2 各组大鼠阴道形态计量值±s)Table 2 The measurement of vagina morphometry in±s)
注:与正常组比较,aP<0.05,aaP<0.01;与模型组比较,bP<0.05,bbP<0.01;与葛根素比较,ccP<0.01)
3 讨论
PMOP在45岁以上妇女中发病率为30%,在75岁以上妇女中发病率约为90%[8]。妇女绝经后因卵巢功能衰退,体内雌激素含量急剧下降引起骨代谢异常、骨钙矿盐丢失、骨密度下降,骨脆性增加,导致骨质疏松、骨痛的同时也对生殖系统造成损伤,引起子宫上皮、内膜萎缩,局部微循环受阻,子宫功能减退,免疫力下降而容易受外界病原体侵袭[9]。同样,由于雌激素的丢失出现阴道上皮萎缩,上皮细胞糖原减少导致阴道pH值上升,抑菌能力减弱,易遭受病原微生物感染[10]。此类人群易患绝经型或老年性阴道炎、宫颈炎,生活质量受到严重影响。
在临床治疗中,通常使用雌二醇、孕激素等来治疗骨质疏松症以及绝经型阴道炎等,此类激素型药物能够直接提高体内雌激素水平,刺激成骨细胞活性,纠正骨代谢异常,缓解生殖系统萎缩[11,12]。但长期使用化学合成类激素,引发宫颈癌、卵巢癌、子宫内膜癌等生殖系统癌变以及心血管血栓等的可能性较大,具有一定风险性[13]。
在本试验中,通过维甲酸诱导建立骨质疏松大鼠模型,对维甲酸模型组脏器指数、血清E2水平、子宫阴道组织学观察和形态计量发现,其各项指标均与正常组差异显著,说明维甲酸在引起骨质疏松症的同时能够引发生殖系统损伤,可以较为良好地模拟人类PMOP[14,15]。在本研究中,选用葛根素、丹参酮ⅡA两种药物,葛根素为黄酮类化合物,具有雌激素样作用,能够有效对骨质疏松大鼠起到骨保护作用[16],丹参酮ⅡA属于丹参中脂溶成分:丹参酮Ⅰ、ⅡB、Ⅴ、Ⅵ、隐丹参酮、异丹参酮多种成分中之一,具有良好的雌激素样活性[17],二者均有抗骨质疏松和促进骨形成作用[18]。
通过检测发现,葛根素与丹参酮ⅡA均能发挥其类雌激素样作用,能够显著提升大鼠血清E2水平。此外,两种植物雌激素均能作用于生殖系统,显著增加子宫上皮厚度、管径厚度,阴道上皮厚度。能够提升子宫肌层厚度和腺体数量,增加生殖系统湿重。通过对比发现,丹参酮ⅡA在提升血清E2水平、子宫管径、上皮厚度、肌层厚度、阴道上皮厚度方面较模型组均有极显著差异,程度均优于葛根素组,恢复水平更接近于正常大鼠。但两组药物水平均低于阳性药物苯甲酸雌二醇组,由此说明,植物雌激素作用强度较化学合成类激素弱、起效时间较长,提示这正是植物雌激素的安全性和长期使用性的优势所在[19,20]。
鉴于此,葛根素与丹参酮ⅡA在发挥雌激素样作用治疗骨质疏松的同时均能有效改善PMOP所导致的生殖系统损伤,预测其对老年性阴道炎、宫颈炎、子宫萎缩等具有一定的治疗和修复作用,为绝经后生殖系统修复治疗及药物研发提供参考和依据。
