骨疏康胶囊治疗糖皮质激素性骨质疏松症的临床研究
2017-08-08杨亚珊罗云霞竺红
杨亚珊 罗云霞 竺红
1.宁夏医科大学,银川 750004 2.宁夏医科大学总医院风湿科,银川 750004
骨质疏松症(osteoporosis,OP)是一种以骨量低下、骨微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性骨病[1],分为原发性和继发性两大类。其中糖皮质激素诱导性骨质疏松症(Glucocorticoid induced osteoporosis,GIOP)是继发性骨质疏松症的首要原因,也是继绝经后和老年性骨质疏松症之后最常见的骨质疏松症[2]。相对于原发性骨质疏松症患者,GIOP患者具有更高的骨折风险[3]。在治疗这类患者原发疾病的同时,采取有效措施防治骨质疏松,增加骨密度,减少骨折的发生,缓解患者骨痛症状,已经成为临床工作的重点。本研究通过对试验组GIOP患者采用骨疏康胶囊(0.32 g×24粒,辽宁康辰药业有限公司)联合阿法骨化醇软胶囊(0.5 μg×20粒)、碳酸钙D3片(500 mg/200IU×36片)进行治疗,观察其骨密度及其相关骨代谢指标的改变,现报道如下。
1 资料与方法
1.1 一般资料
本研究采用前瞻性随机对照研究,选取宁夏医科大学总医院门诊及住院确诊的风湿性疾病并GIOP患者80例,随机分为试验组40例,对照组40例。试验组男性7例,女性33例;年龄22~78岁,平均55.03±15.00岁。对照组男性17例,女性23例,年龄17~79岁,平均年龄51.60±12.82岁。其中类风湿关节炎患者43例,原发性干燥综合征患者 3例,强直性脊柱炎患者5例,系统性红斑狼疮患者 25例,白塞病患者3例,银屑病关节炎患者 1例。上述所有患者均使用糖波质激素治疗大于3个月,并确诊为骨质疏松症。本研究中所有病例均随访12个月,无失访病例,对测评的工作人员采取盲法,随机方法采用区组随机化方法。
1.2 纳入标准
(1)风湿类疾病患者,使用糖皮质激素治疗超过3个月;(2)有自主行为能力,无行动受限;(3)无脊柱侧凸或者后凸畸形;(4)腰椎或髋部双能X线骨密度检测T≤-2.5,符合2011年原发性骨质疏松症诊治指南[1];(5)门诊随访,能够按时随诊者。
1.3 排除标准
(1)原发性骨质疏松患者;(2)肝、肾等慢性疾患和内分泌疾患:垂体、甲状腺、甲状旁腺、肾上腺皮质功能紊乱的疾病(亢进或减退)等病史;(3)半年内曾患急性心肌梗死、脑血管意外者,患有肿瘤或者肝炎、结核等传染病史;(4)半年内曾服用影响骨代谢的药物者;(5)脊椎后凸及侧凸畸形者;(6)正在参与影响本研究结果评价的其他临床试验者。
1.4 分组及治疗方法
将所有患者随机分为试验组和对照组,每组各40 例。两组患者的一般资料比较差异无统计学意义,具有可比性。两组均采用常规治疗,包括健康教育,给予富含钙、低盐和适量优质蛋白质的均衡膳食,适当进行户外活动和日照,避免嗜烟酗酒,补充钙剂和维生素 D,骨痛明显者给予适量非甾体抗炎药等治疗。对照组口服阿尔法骨化醇软胶囊,0.5 μg/次,1次/天,碳酸钙D3片 1片/次,2次/天,试验组在对照组的基础上口服骨疏康胶囊,4粒/次,2次/天。两组均连续观察12个月。
1.5 观察指标
骨密度(Bone mineral density,BMD)检测采用法国迈迪公司生产的双能 X 线骨密度测定仪(DEXA),型号:OSTEOCORE2。分别于治疗前、治疗 12 个月时测定受检者腰椎 (L1-4) 和髋部 (股骨颈、大转子、全髋)的骨密度及血清钙、碱性磷酸酶(Alkaline phosphatase,ALP)、骨钙素(Osteocalcin,OC)、25-羟维生素D(25- hydroxy vitamin D,25- (OH) D)、I型前胶原N端前肽(N-terminal propeptide of type I precollagen,PINP)。
1.6 不良反应
观察并记录两组患者出现血象异常、肝功异常(ALT、AST增高)、肾功异常(血肌酐、尿素增高)、恶心呕吐、尿路及呼吸道感染等不良反应的发生情况。
1.7 统计学方法
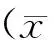
2 结果
2.1 试验组与对照组BMD比较
试验组腰椎(L1~4)、股骨颈、大转子、全髋的BMD均较对照组升高,与治疗前相比明显升高,差异均具有统计学意义(P<0.05),见表1。
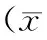
表1 治疗前后BMD在试验组和对照组的比较±s,n=40)Table 1 Comparison of BMD before and after treatment in the experimental group and the control group (±s,n=40)
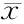
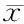
2.2 试验组和对照组OC、血清钙、ALP、25-(OH)D、PINP比较
试验组血清钙治疗前后无明显变化(P>0.05),OC、ALP降低,25- (OH) D、PINP升高,差异均有统计学意义(P<0.05)。与对照组比较,血清钙与OC无明显变化(P>0.05),ALP降低,25- (OH) D、PINP升高,差异均具有统计学意义(P<0.05),见表2。
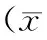
表2 治疗前与治疗后血清学指标在试验组与对照组比较±s,n=40)Table 2 Comparison of serum indexes before and after treatment in the experimental group and the control group (±s,n=40)
2.3 不良反应
两组治疗过程中均未见明显不良反应。
3 讨论
继发性骨质疏松症是由于疾病或药物等原因所致的骨量减少、骨微结构破坏、骨脆性增加和易于骨折的代谢性疾病[17]。其中很多药物均可影响骨代谢,如钙调磷酸酶抑制剂、抗逆转录病毒药、选择性 5-HT 再摄取抑制剂、抗惊厥药、袢利尿药、肝素、口服抗凝血剂,以及质子泵抑制剂等[18],而GIOP在药物导致的骨质疏松症中最为常见。糖皮质激素 (Glucocorticoids,GCs) 广泛应用于免疫系统疾病的治疗,由于长期大剂量 GCs应用所致的不良反应如感染扩散、代谢紊乱、肌肉骨骼病变等近年来不断受到重视,其中骨质疏松为其最严重的副作用之一。文献报道[19],GIOP 的风险因素与一般骨质疏松不同,具有以下显著特点:1)老年人;2)使用时间长于3个月;3)骨质疏松家族史;4)低钙饮食和维生素D缺乏。研究表明,有30%~50%的长期接受GCs治疗的患者会发生骨折[5]。GIOP的骨丢失分两期,在第1年内,BMD降低6%~12%,随后每年缓慢减少3%。在最初3个月的治疗中,特别是在骨密度明显降低之前,骨折风险增高达75%。GCs明显好发于富含骨松质的部位,如腰椎,在一项对患各种疾病的患者接受GCs治疗的队列研究表明,10 mg/d泼尼松持续治疗超过90天,与增加7倍髋部骨折和17倍椎骨骨折相关[6]。小剂量使用激素,患者骨密度也会明显下降,骨折风险增高[7]。GCs对骨骼的作用呈时间和剂量依赖性,没有安全剂量及性别差异。停用GCs后,在不合并其他致骨丢失原因时,一般BMD不再继续下降,并可以在停药后数月至数年内恢复至基线水平[19]。
GIOP的病理生理机制复杂,有研究认为,GCs对骨骼的不良影响是直接作用于成骨细胞、骨细胞和破骨细胞,减少成骨细胞和破骨细胞的产生,增加成骨细胞和骨细胞的凋亡,延长破骨细胞的寿命。这项证据来自于一系列的转基因小鼠过表达11β-HSD2灭活酶的实验中[9]。Hakeda[4]研究也表明在GIOP患者中,破骨细胞生成减少,但其活性明显增强及生存期明显延长。GCs也通过增强对骨形成非常重要的Wnt信号通路拮抗物(Dickkopf-1)的表达[10]及激活糖原合成酶激酶3β[20]、抑制骨形成蛋白和小牛相关转录因子2、多个诱导成骨细胞分化所必需的因子,而间接作用于成骨细胞的生产。Yu W[10]等人最新研究表明神经肽Y1受体能够通过ERK信号通路调节糖皮质激素诱导的小鼠成骨细胞分化的抑制。综上,使用 GCs 的患者进行有效的预防和早期药物干预显得尤为重要。同时SFR[21](French Society of Rheumatology)、IOF[22](International Osteoporosis Foundation)、ACR[23](American College of Rheumatology)等相关指南都指出长期服用GCs者需通过DEXA监测 BMD,并将钙和维生素D作为一级预防和二级预防的基础用药。
骨生化标志物可反映骨代谢状态,是协助代谢性骨病的诊断、鉴别诊断、治疗以及疗效评价的重要指标。其中能反映骨代谢转换的指标称为骨转换标志物(Bone turnover markers,BTMs)。BTMs包括骨形成标志物和骨吸收标志物,PINP、骨特异性碱性磷酸酶(Bone-specific alkaline phosphatase,BALP)、骨钙素(OC)均属于骨形成标志物。成骨细胞中含有大的I型前胶原,骨形成时I型前胶原被分泌到细胞外,裂解为PINP、I型胶原羧基端前肽PICP和I型胶原3个片段,因此PINP可以反应骨形成水平。骨矿化过程中,成骨细胞分泌BALP,BALP是总碱性磷酸酶的重要部分,当BALP升高时,血清总碱性磷酸酶也相应升高,当肝功能正常时,肝脏和骨骼来源的碱性磷酸酶各占血液总碱性磷酸酶的一半,因此血清碱性磷酸酶受肝功能的影响。OC是骨机制中含量最丰富和骨形成过程产生较晚的标志物,由成骨细胞合成类骨质时释放到细胞外基质,其中一小部分进入血液循环,其中作用尚不清楚,可能与影响类骨质矿化并在骨重建过程中起负反馈作用有关。破骨细胞骨吸收时OC也会增高,因此OC除了反应骨形成状态外,更代表骨转换水平的综合状态[8]。本研究结果显示,在骨代谢指标中,试验组血清钙治疗前后无明显变化(P>0.05),OC、ALP降低,25-(OH)D、PINP升高,差异均有统计学意义(P<0.05)。与对照组比较,血清钙与OC无明显变化(P>0.05),ALP降低,25-(OH)D、PINP升高,差异均具有统计学意义(P<0.05)。综上,提示骨疏康胶囊与阿法骨化醇及钙剂联合应用可以改善相关的骨代谢指标,降低骨转化。
中医学认为“肾藏精”,肾所藏之精气是维持机体生命活动的根本物质基础。骨骼正常机能的发挥也离不开肾精的“生髓养骨”作用,即“肾主骨”。所以,骨质疏松作为代谢性骨病,肾虚是其发病的主要病机。糖皮质激素长期应用产生的骨骼副作用,属于中医学的“药邪”伤肾,致肾精损伤、骨失所养而引发的骨质疏松。以补肾为主防止GIOP的疗效也得到大量动物实验和临床实践的证实[11,13]。骨疏康为临床较常用的用于治疗肾虚兼血气不足所致的原发性骨质疏松症的中药制剂,其主要成分为熟地黄、淫羊藿、骨碎补、黄芪、丹参等,具有补肾填精壮骨、益气活血化瘀的作用。有研究表明,骨疏康胶囊能够有效提高去卵巢大鼠体内的雌激素水平,改善雌激素受体水平,发挥了类雌激素的效果,从而改善了骨代谢,增加骨密度[24]。张倚的骨疏康胶囊对去卵巢骨质疏松大鼠骨密度的研究也证实了这一点[16]。同时大量的临床试验表明骨疏康可抑制骨吸收,减缓骨量丢失,提高骨密度,能有效地防治骨质疏松症。如从飞、刘建等研究观察了疏康胶囊联合骨化三醇和阿仑膦酸钠与对照组使用骨化三醇和阿仑膦酸钠治疗骨质疏松症6个月,显著提高了腰椎及全髋部的骨密度[14]。黄莉等关于骨疏康治疗原发性骨质疏松症随机对照临床研究Meta分析中显示,骨疏康可提高原发性骨质疏松症的骨密度、改善骨痛情况,且在维持正常血钙水平方面优于其他抗骨质疏松药[15]。本研究结果显示,对于GIOP患者,试验组腰椎(L1~4)、股骨颈、大转子、全髋的骨密度均较对照组升高,与治疗前相比明显升高,差异均具有统计学意义(P<0.05)。提示骨疏康胶囊与阿法骨化醇及钙剂联合应用可以提高GIOP患者骨密度,与上述研究结果相一致。
综上所述,骨疏康胶囊与阿法骨化醇及钙剂联合应用可明显增高 GIOP患者的骨密度,并且能降低骨转换。
